金属硫蛋白-1和CT23在肝细胞癌中的表达及意义*
2019-03-06卢丽斯黄秒孙克俭覃世兴王莉雯冯祥匡琪琪葛盈盈王弘姚家丽付骏吴圣明胡启平
卢丽斯, 黄秒, 孙克俭, 覃世兴, 王莉雯, 冯祥, 匡琪琪, 葛盈盈, 王弘, 姚家丽, 付骏, 吴圣明, 胡启平△
广西医科大学 1临床医学系,基础医学院, 3细胞生物学与遗传学教研室, 4组织学与胚胎学教研室(广西南宁 530021); 广西医科大学附属肿瘤医院 2影像学诊断中心, 5病理科(广西南宁 530021)
原发性肝癌(primary liver cancer,PLC)是肝细胞或肝内胆管上皮细胞发生的恶性肿瘤,原发性肝细胞癌(hepatocellular carcinoma,HCC)为其最常见的组织类型之一,亦是全球最常见的恶性肿瘤之一。2017年我国国家癌症中心发布的最新数据显示,2013年全国各大中小城市肝癌发病率为28.17/10万,新发病例63 800例,在所有恶性肿瘤中排名第三;死亡率24.70/10万,仅次于肺癌排名第二[1-3]。HCC发生于肝细胞,分化程度差异大,具有预后差、术后复发率高、远处转移多见、5年生存率较低等特征。在广西地区,HCC也被公认为是高发且死亡率最高的恶性肿瘤之一。金属硫蛋白(metallothionein,MT)中的MT-1,包括MT-1A、MT-1E、MT-1F等。有研究表明金属硫MT-1在多种恶性肿瘤(肺癌、肝癌、胃癌等)的表达与肿瘤的发展和愈后有密切关系。众多学者研究显示,MT-1在肝癌细胞中表达显著降低,但其具体机制尚不十分清楚[4-6]。在Lu等[7]的研究中,MT-1F 被认为是一个潜在的肿瘤抑制基因,能抑制肝癌细胞 HepG2 的生长。癌-睾丸抗原(cancer testis antigen, CTA)是一类可在多种肿瘤组织中表达而在睾丸以外的其他正常组织中几乎不表达的抗原,是近期肿瘤抗原研究领域的一大热点。CT23又称OY-TES-1,是CTA家族中的一员,2001年由Ono等[8]首次报道。目前研究表明,CT23在HCC中有较高的表达频率及表达水平, 该蛋白具有较强的免疫原性, 有望作为用于HCC辅助诊断及免疫治疗的肿瘤抗原[9-10]。现有研究提示,HCC的发生、发展可能与MT-1表达下调和CT23高表达有关。而MT-1和CT23两种蛋白在肿瘤的发生、发展中是否存在相关性尚未可知,目前国内外亦无联合探究MT-1和CT23与HCC发生发展的关系及相关临床意义的报道。因此,本研究运用RNA干扰(RNA interfering,RNAi)、表达谱芯片分析、荧光定量PCR、免疫组化SP法检测CT23与MT-1在肝癌细胞中的表达关系、CT23与MT-1在癌组织与癌旁组织表达的差异以及与患者临床资料的相关性和意义,旨在了解MT-1和CT23 在HCC发生、发展中的联系,为进一步研究HCC的发生、发展机制和相应治疗措施提供实验依据。
1 资料与方法
1.1 一般资料 共62例HCC(HCC组)及癌旁组织(癌旁组),标本均取自广西医科大学第一附属医院普外科2015—2016年行手术治疗的HCC患者,所有病例均经病理证实。其中男55例,女7例,<60岁49例,≥60岁13例;Edmondson分级Ⅰ~Ⅱ级28例,Ⅲ~Ⅳ级30例,未能分级4例;有转移15例,无转移44例,3例无法判断。多发肿瘤29例,单发肿瘤37例;肿瘤最大径≥5 cm 43例,<5 cm 19例;乙肝表面抗原(HBsAg)阳性53例,阴性9例;甲胎蛋白(AFP)阳性42例;伴有肝硬化23例;伴肝细胞脂肪变性10例。
1.2 实验材料 人HCC 细胞系Bel-7404购于中国科学院上海细胞所,用含10%胎牛血清(Gibco)的DMEM培养基进行培养。62例HCC癌组织及癌旁组织取自广西医科大学第一附属医院普外科行手术治疗的HCC患者,并经患者本人同意使用于本研究。
1.3 CT23 RNA干扰和表达谱芯片分析 针对CT23的siRNA序列制备和siRNA瞬时转染按Fu等[11]的方法进行。简而言之,Bel-7404细胞培养于24孔板,当细胞融合达到约50%时,以siRNA∶转染试剂=1 μg∶5 μL 的比例进行siRNA转染。细胞分别于转染24、48、72 h后收获。转染CT23特异性siRNA的组记为si.CT23组,未处理组记为Untreated组,转染试剂处理组记为MOCK组,无关序列siRNA处理组记为si.Ctrl组。转染后的Bel-7404细胞总RNA用Trizol试剂制备后用安捷伦的Human 1A基因芯片(V2)(安捷伦科技有限公司,上海,中国)分析CT23下调后的基因表达情况。CT23 RNA干扰后兴趣基因的表达验证用荧光定量PCR进行[12]。
1.4 免疫组化SP法 HCC组织和癌旁组织置于10% 甲醛溶液固定,经脱水、透明、浸蜡、石蜡包埋后 4 μm厚连续切片,进行免疫组织化学法染色。本实验采用免疫组织化学SP法试剂盒(北京中杉公司)。检测操作步骤如下:石蜡切片烘干,水化,加入0.1 mol/L枸橼酸溶液高压修复10 min;3%H2O2去离子水孵育5~10 min,PBS冲洗3 min×3次;滴加正常山羊血清工作液室温孵育10~15 min,去除废液;滴加一抗(小鼠抗人metallothionein 单克隆抗体,abcam公司;兔抗人CT23单克隆抗体[13],广西医科大学组织与胚胎学教研室制备),4℃孵育过夜;过夜后PBS冲洗3 min×3次;滴加生物素标记山羊抗兔IgG,37℃孵育10~15 min,PBS冲洗3 min×3次;滴加S-A/HRP,37℃孵育10~15 min,PBS冲洗3 min×3次;使用DAB显色,苏木素复染,封片。阴性对照使用PBS溶液替代一抗溶液。染色结果采用组织化学评分法(H-score)[14]进行评分。H-score=Σpi(i+1),式中pi表示阳性细胞数量占切片中所有细胞数量的百分数;i代表着色强度。MT-1和CT23的阳性染色标准为细胞质或膜、核上有黄染部分。阳性细胞百分比:任意观察5个高倍视野得出阳性细胞数量占切片中所有细胞数量的百分数。染色强度分为5级,分别是无显色:0分;浅黄染:1分;较浅黄染:2分;中等黄染:3分;深黄染:4分;棕褐色:5分。评分过程由2 位经验丰富的病理医师采用双盲原则共同阅片、计分。
1.5 统计学方法 数据应用Excel进行整理、用SPSS 17.0统计软件进行分析。组间表达差异采用两独立样本t检验,MT-1和CT23表达与临床资料的相关性分析采用两配对样本t检验,MT-1与CT23表达关系采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌细胞中CT23与MT-1的表达关系 下调CT23后的Bel-7404细胞的基因表达谱显示,与si.Ctrl组比较,si.CT23组中8个MT-1基因表达全部上调,且差异表达都在3倍以上,其中MT-1F表达上调最明显,达到31倍左右(表1)。选取差异表达最明显的MT-1F和MT-1E用荧光定量PCR进一步证实,Bel-7404细胞中CT23下调后MT-1表达是明显上调(图1)。

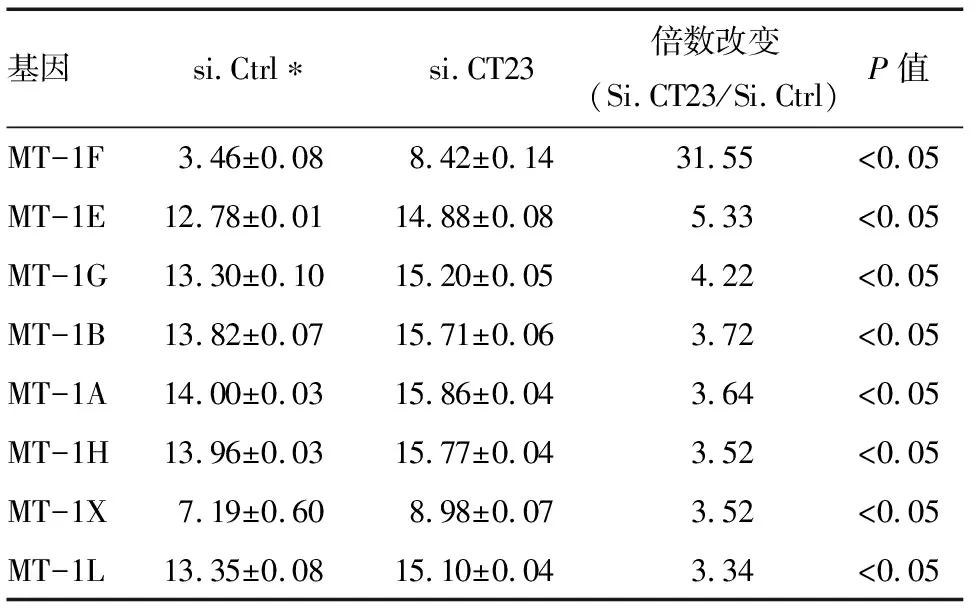
基因si.Ctrl∗si.CT23倍数改变(Si.CT23/Si.Ctrl)P值MT-1F3.46±0.088.42±0.1431.55<0.05MT-1E12.78±0.0114.88±0.085.33<0.05MT-1G13.30±0.1015.20±0.054.22<0.05MT-1B13.82±0.0715.71±0.063.72<0.05MT-1A14.00±0.0315.86±0.043.64<0.05MT-1H13.96±0.0315.77±0.043.52<0.05MT-1X7.19±0.608.98±0.073.52<0.05MT-1L13.35±0.0815.10±0.043.34<0.05
*表达值的自然对数值
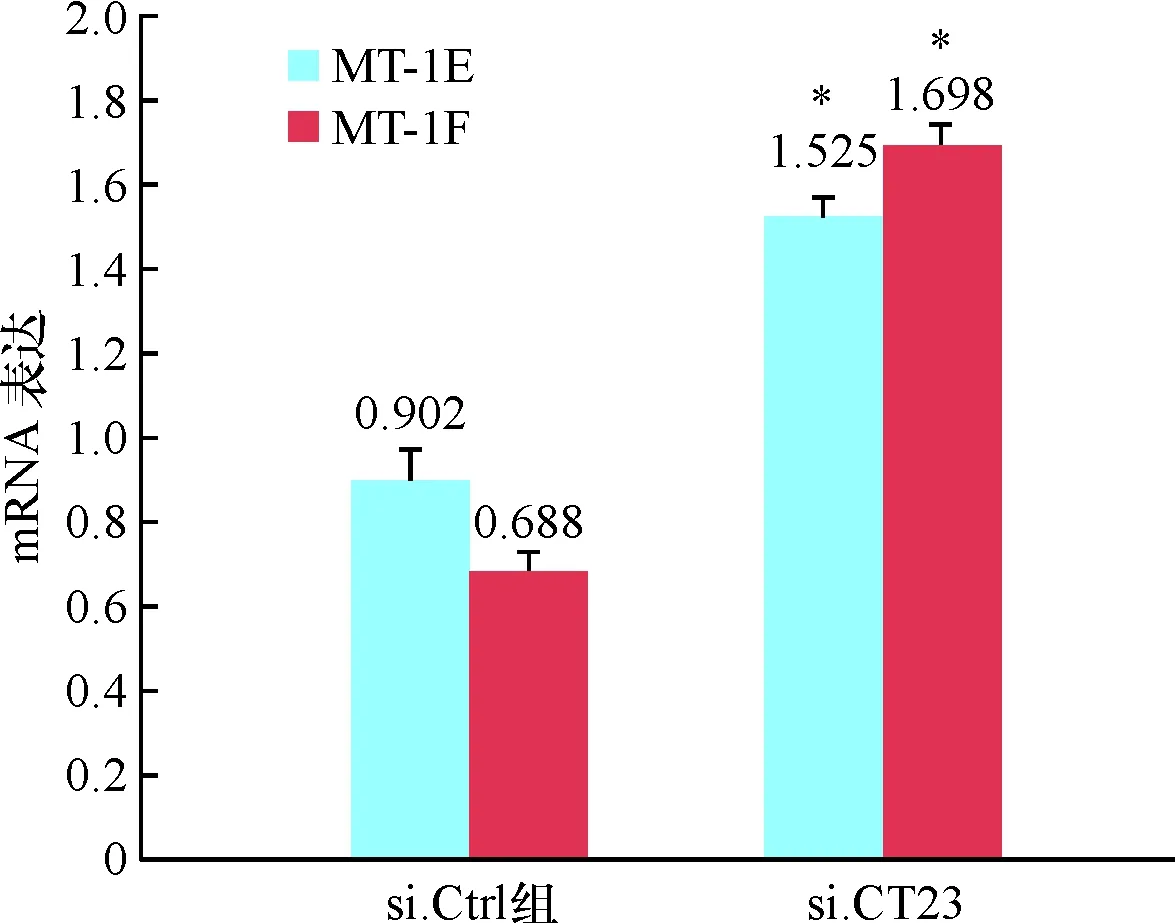
*与si.Ctrl组比较P<0.05
图1荧光定量PCR验证Bel-7404细胞中CT23下调后MT-1F和MT-1E的mRNA表达
2.2 MT-1和CT23在HCC组织及癌旁组织中的分布 MT-1和CT23的阳性信号主要定位于细胞质,部分细胞胞膜、细胞核也有少量分布,光学显微镜下呈棕黄色或棕褐色颗粒或团块状(图2)。
2.3 MT-1和CT23在HCC组织及癌旁组织中的表达 HCC组织中MT-1和CT23的表达均较癌旁组织低,差异有统计学意义(P<0.05),见图2和表2。

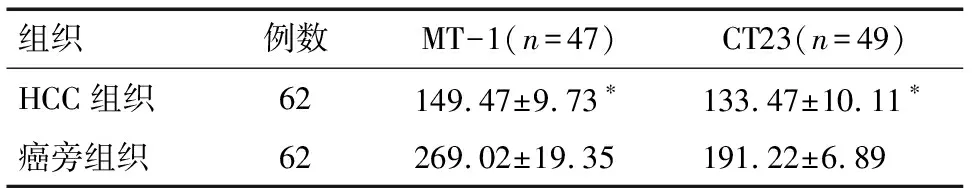
组织例数MT-1(n=47)CT23(n=49)HCC组织62149.47±9.73∗133.47±10.11∗癌旁组织62269.02±19.35191.22±6.89
*与癌旁组织比较P<0.05
2.4 HCC组织及癌旁组织中MT-1和CT23表达与临床资料间的关系
2.4.1 MT-1表达 在HCC组织中,Edmondson分级越低,MT-1的阳性表达评分越高,差异有统计学意义(P<0.05);并且,肿瘤数目为单发的HCC组织中MT-1阳性表达评分高于肿瘤多发的HCC组织,差异有统计学意义(P<0.05)。MT-1在HCC组织中与年龄、性别、HBsAg、肿瘤大小、AFP、肝硬化、肝脂肪变性、有无转移无明显关系(P>0.05)。在癌旁组织中,MT-1与年龄、性别、HBsAg阳性、肿瘤大小、Edmondson分级、AFP、肝硬化、肝脂肪变性、有无转移、肿瘤数目等均无明显关系(P>0.05)。见表3。

图2 MT-1和CT23在癌旁组织及HCC组织中的表达(免疫组化,×100)
2.4.2 CT23表达 在HCC组织和癌旁组织中,CT23蛋白的阳性表达与年龄、性别、HBsAg、肿瘤大小、Edmondson分级、AFP、肝硬化、肝脂肪变性、有无转移、肿瘤数目等均无明显关系(P>0.05)。见表3。
2.5 MT-1与CT23表达之间的关系 在癌旁组织中,MT-1与CT23之间的表达无明显关系(P>0.05),见表4。在HCC组织中,MT-1与CT23之间的表达可能存在相关性,P值接近0.05。
3 讨论
MT是一类低相对分子质量、高金属含量、富含半胱氨酸、功能独特的小分子胞质结合蛋白,在人体肝脏内含量最多。国内外众多学者研究发现,MT在肝癌细胞中表达显著降低,但其具体机制尚不十分清楚[4-5]。易石坚等[15]研究发现肝癌中MT表达低,且病理分化越差者的表达更加明显下降,提示MT可能抑制肝癌的发生发展。根据MT所带电荷性质的差异, 其家族可分为MT-1、MT-2、MT-3和MT-4四类异构体。在Tao等[16]对肝癌组织及对应的非癌性肝组织标本的研究中,显示MT-1在肝癌组织中的表达下降,Park等[16-19]经实验证实MT-1/2在肝癌细胞的细胞核和细胞质中的表达明显低于正常的肝细胞。Ono等[8]发现人类CT23基因以来,国内外对CT23与肿瘤间的联系做了较多的研究,如卵巢癌、大肠癌、胶质瘤、肝癌等,并证实CT23了肿瘤组织中CT23表达量与临床资料存在相关性,提示CT23有望成为辅助诊断及免疫治疗肿瘤的新抗原[12,20-24]。本课题组前期研究表明,下调HCC细胞株中CT23基因的表达可通过上调caspase-3和下调cyclin E来抑制HCC细胞的生长、迁移,并减弱其侵袭力[11];还可能通过影响NANOG、 CD9、CCND2和CDCA3的表达来调控癌细胞的恶性行为[25],然而尚无研究表明肝癌组织中MT-1表达与CT23表达有关。
本研究结果显示,HCC组织中MT-1的表达较相应癌旁组织低(P<0.05);Edmondson分级越低,MT-1的阳性表达评分越高(P<0.05);肿瘤数目为单发的HCC组织中MT-1阳性表达评分高于肿瘤多发的HCC组织。MT-1是肝脏参与解毒的物质基础之一,所含硫基可与镉等亲电性金属、自由基以及某些细胞代谢物等结合,从而参与重金属解毒、自由基清除以及应激反应。哺乳动物细胞内自发性基因突变最重要的原因是内源氧化损伤,MT-1表达的下降可导致氧自由基的堆积,从而引起某些原癌基因的激活或抑癌基因的失活。有研究[26]提出镉能够诱发产生脂质过氧化物、DNA损伤,还有研究表明MT-1的分泌减少使得癌细胞进一步增殖和转移[15]。由此推断MT-1表达减少MT-1,引起肝组织对重金属解毒及清除自由基能力下降, 自由基和重金属的共同作用导致肝脏功能受损和细胞癌变及转移,是癌组织分级升高、肿瘤多发的原因之一。Tao等[16]研究发现,HCC组织与非癌组织相比MT表达显著下调,HBsAg 与MTs 表达下调有关。本研究中未发现HCC组织中MT-1的减少与HBsAg有关,可能由于本研究样本数较少所致,具体原因仍有待进一步研究验证。综合上述,MT-1的表达与HCC的发生、发展密切相关。


临床资料MT-1CT23例数HCC组织P值例数癌旁组织P值例数HCC组织P值例数癌旁组织P值性别0.9280.781〛0.741〛0.184 男41149.88±77.2747275.40±91.0844132.27±73.3947199.57±91.03 女6146.67±106.336286.67±108.575144.00±87.645142.00±89.55年龄0.7220.952〛0.957〛0.623 ≤60岁36151.81±81.5242276.29±97.2838133.16±74.3342190.96±91.62 >60岁11141.82±78.7211278.18±72.9111134.55±76.4710207.00±95.46HBsAg0.7810.547〛0.327〛0.315 阳性39151.41±80.5545273.42±92.6240128.50±74.7243188.14±92.38 阴性8140.00±82.818295.00±93.049155.56±70.559222.22±87.43肿瘤最大径0.9140.469〛0.504〛0.235 <5 cm16151.25±87.3214292.14±100.3216143.75±77.0213167.69±89.27 ≥5 cm31148.55±77.6739271.13±89.7133128.48±73.1939202.82±91.85Edmondson分级0.0350.325〛0.758〛0.852 Ⅰ~Ⅱ级20164.00±81.2022290.18±86.1621134.76±74.5422189.55±80.62 Ⅲ~Ⅳ级25127.40±69.6628263.57±99.5624127.92±73.0126154.52±98.03AFP0.0750.356〛0.209〛0.778 阳性34136.62±73.0437284.43±97.1934120.59±69.5935196.57±99.59 阴性13183.08±90.8716258.75±79.0715162.67±77.7817188.92±75.16肝硬化0.4640.145〛0.435〛0.352 无28142.32±79.9732261.69±99.9321140.71±74.9331203.87±84.05 有19160.00±81.3821299.52±75.3328123.81±73.4521179.52±96.53转移0.7000.762〛0.913〛0.057 无29146.38±77.5637274.05±94.1233134.24±72.8536208.61±82.23 有16156.25±88.9113264.92±89.5513131.54±79.5713155.38±89.50肝脂肪变性0.8650.330〛0.813〛0.800 无40147.63±80.9346271.83±94.2243134.42±72.8446159.22±93.26 有7152.29±81.427308.57±74.716126.67±89.146185.00±85.26肿瘤数目0.0470.169〛0.899〛0.209 单发25162.40±84.5230292.00±78.6725134.80±76.0028208.93±85.52 多发22134.77±74.0123256.70±105.6324132.08±73.4824176.67±97.21
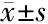

组织表达评分MT-1CT23Pearson相关系数P值HCC组织150.57±80.335128.18±71.9910.2880.058癌旁组织278.71±93.294192.04±94.0050.2130.134
本研究结果显示,在HCC组织中CT23蛋白表达量较相应的癌旁组织少,差异有统计学意义(P<0.05),与年龄、性别、癌症分期等临床资料无相关性。但是范蓉等[10]研究发现,在37对HCC组织及配对癌旁组织中, HCC组织中CT23 mRNA水平明显高于对应的癌旁组织, 其差异与病理分级有关(P<0.05),与本研究结果中蛋白表达水平相反,此外HCC组织中CT23蛋白阳性率仅为40%。综合两项研究推测,肝癌细胞中CT23表达过程中可能存在mRNA转录后的调控和蛋白合成后的修饰,mRNA水平与蛋白水平间的联系并不十分紧密[27]。此外,CT23表达与原发性肝癌临床资料的相关性存疑,存在此差异的具体原因,有待进一步分析研究。
本研究中RNAi实验显示,肝癌细胞中CT23下调后MT-1表达上升,由此结合MT-1的功能可推测CT23下调后肝癌细胞恶性行为的下调可能还通过MT-1表达上调来实行。本研究试图在HCC组织和癌旁组织中分析蛋白水平上CT23和MT-1表达的关系时,发现两者的蛋白表达在HCC组织中也有一定的相关性,其P值为0.058,可能为研究病例不足所致。因此该结果是否是肝癌发生、发展过程中CT23与MT-1关系的真实反映,尚需更多病例进行研究。
综上所述,MT-1在HCC组织中表达较癌旁组织中为低,且在Edmondson分级较高、肿瘤多发者中MT-1表达较低,可见MT-1与HCC的发生、发展密切相关,其机制可能与肝组织中MT-1下调后金属解毒能力下降、自由基堆积导致细胞进一步恶化相关。CT23下调后细胞中MT-1表达上升,CT23下调后肝癌细胞恶性行为的下调可能通过MT-1表达上调来实现,在HCC组织及癌旁组织中MT-1与CT23的表达也具有一定相关性, 提示MT-1与CT23在HCC的发生、发展中相关,但其具体机制尚不明确,有待进一步研究。
