卵巢过度刺激综合征大鼠肠道菌群高通量测序初步探索*
2019-03-06莫毅李云娟牛向丽徐亦辰公方强王娟谢丹尼岳桂华梁方方
莫毅, 李云娟, 牛向丽, 徐亦辰, 公方强, 王娟, 谢丹尼, 岳桂华, 梁方方
广西壮族自治区计划生育研究中心 1科教科, 2妇科, 3生殖医学科, 4主任办公室(广西南宁 530021); 5广西卫生职业技术学院院办(广西南宁 530023); 6广西大学动物科学技术学院遗传育种实验室(广西南宁 530001)
2007年国际联合研究项目人类微生物组计划 (The Human Microbiome Project,HMP) 和人类肠道元基因 (或宏基因) 组学计划 (Metagenomics of The Human Intestinal Tract,MetaHIT) 正式启动,标志着肠道宏基因组研究的时代已经到来[1]。随着项目的推进,越来越多的科研结果表明肠道菌群在维持人体健康稳态中起至关重要的作用,而这种作用主要依赖于菌群种类的多样性、菌群结构的稳定性和微生态的平衡性。各种原因导致的肠道菌群稳态的失衡都会影响到人的健康,引发相关的疾病,例如肥胖[2-3]、糖尿病[4-5]、非酒精性脂肪肝[6]、强直性脊柱炎[7]、炎症性肠病[8]、肿瘤[9-11]等。卵巢过度刺激综合征(ovarian hyperstimulation syndrome, OHSS)是辅助生殖技术应用领域常见的医源性并发症,其临床表现为胃肠道不适、腹腔积液、胸腔积液、少尿、卵巢增大等,严重可危及生命。目前,对于OHSS肠道菌群变化的相关研究报道十分稀少。本研究拟通过高通量测序技术对卵巢过度刺激组、超促排卵组和生理盐水组大鼠盲肠前段内容物菌群16S rDNA 的V3~V4区域的基因序列进行比对,初步探讨辅助生殖技术中外源激素应用对于大鼠肠道菌群的分布和丰度的影响。
1 材料与方法
1.1 材料 孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(HCG)购于北京索莱宝科技有限公司;刚断奶的雌性SD大鼠,22日龄,购于广西医科大学实验动物中心。
1.2 动物分组和用药方案 于2017年11月9—13日在广西大学动物科学技术学院遗传育种实验室动物房饲养,将10只SD大鼠随机分为3组: 卵巢过度刺激组4只、超促排卵组3只和生理盐水对照组3只。
用药方案如下:生理盐水对照组腹腔皮下注射生理盐水0.2 mL/d,连续5 d;超促排卵组腹腔皮下注射10 IU PMSG/d,连续4 d,第5天注射10 IU HCG;卵巢过度刺激组腹腔皮下注射50 IU PMSG/d,连续4 d,第5天注射25 IU HCG。注射HCG 48 h后,使用苯巴比妥钠麻醉开腹腔收集盲肠前段内容物,液氮速冻,-80℃冷冻保存备用。
1.3 高通量测序 于2017年11月24日将收集好的盲肠前段内容物交由生工生物工程(上海)有限公司进行肠道菌群宏基因组DNA提取和16s rDNA V3-V4可变区域的高通量测序。
1.4 生物信息学分析 通过生物学统计软件SPSS 17.0统计软件,利用One Way ANOVA开展样本组间差异的显著性检验,以P<0.05为差异有统计学意义。生物信息学分析主要包括了操作单元(operational taxonomicunits,OTU)聚类分析、菌群多样性分析、菌群分类学分析和菌群群落结构分析。
2 结果
2.1 大鼠肠道内容物菌群的测序质量 大鼠盲肠内容物细菌16S rDNA 基因经抽提纯化、PCR 扩增后进行高通量测序,菌群多样性统计结果见表1。参试的3组大鼠肠道内容物菌群的测序覆盖指数均达到0.993以上,说明样品中序列未被测到的概率较低,高通量测序结果可用于后续的分析。

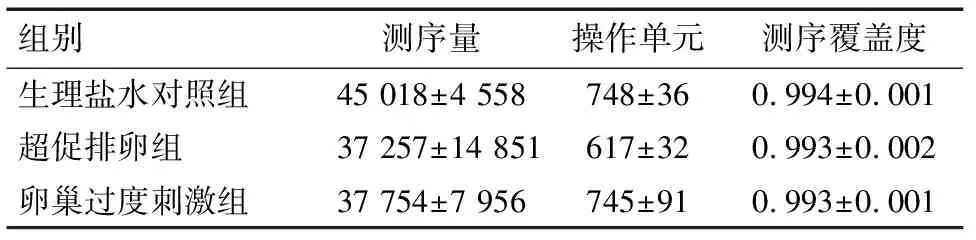
组别测序量操作单元测序覆盖度生理盐水对照组45 018±4 558748±360.994±0.001超促排卵组37 257±14 851617±320.993±0.002卵巢过度刺激组37 754±7 956745±910.993±0.001
对参试各样品进行a指数稀疏曲线的绘制(图1)。各样品的稀疏曲线在序列数目为200左右时出现拐点,后续随着测序深度不断增加;当序列数达2 000条时,曲线趋于平缓,并逐步进入平台期。各样品的稀疏曲线证实测序量足够,覆盖所有细菌物种,其丰富程度足以满足后续的分析。
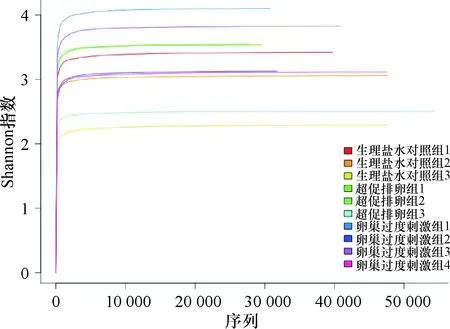
图1 10份肠道内容物样品的稀疏曲线
2.2 大鼠肠道内容物多样性统计分析 参试的3 组大鼠肠道内容物菌群在97%相似性水平的多样性指数见表2。其中ACE指数用于对菌群丰度进行的评估,表2数据表明,超促排卵和卵巢过度刺激组肠道内容物菌群较生理盐水对照组丰富性高,但差异无统计学意义(P>0.05)。而Simpson和Shannon指数用于对菌群微生物多样性进行的评估值,Simpson指数数值越大,表明群落多样性越低,Shannon值越大,表明群落多样性越高,表2数据表明,超促排卵组和卵巢过度刺激模型组大鼠肠道内容物菌群较生理盐水对照组的多样性高。

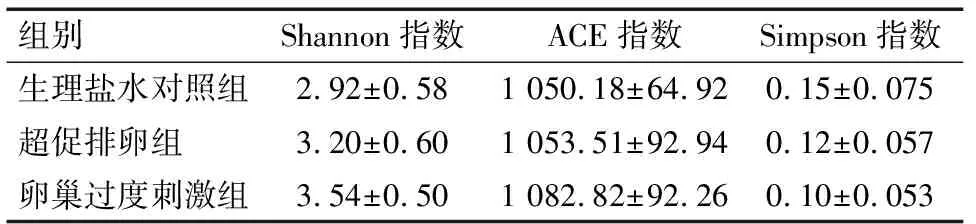
组别Shannon指数ACE指数Simpson指数生理盐水对照组2.92±0.581 050.18±64.920.15±0.075超促排卵组3.20±0.601 053.51±92.940.12±0.057卵巢过度刺激组3.54±0.501 082.82±92.260.10±0.053
2.3 微生物群落结构分析 在门(Phylum)的水平上,参试3组样品的微生物群落构成及其相对丰度如图2所示。所有样品均包含厚壁菌门(Firmicutes)、 疣微菌门(Verrucomicrobia)和拟杆菌门(Bacteroidetes)3个主要的门,占肠道内含物菌群含量的97.38以上。3个主要菌门中厚壁菌门(Firmicutes)在肠道菌群含量最高,分别为生理盐水对照组74.12%,超促排卵组63.76%,卵巢过度刺激组76.56%;Verrucomicrobia菌群含量比例随着激素用量的增加而递减,分别为生理盐水对照组21.57%,超促排卵组16.28%,卵巢过度刺激组8.03%;而Bacteroidetes在生理盐水对照组中含量比例最低3.10%,而超促排卵和卵巢过度刺激组比例相对较高,分别为17.35%和13.55%。
此外,3组肠道内容物中还含有变形菌门(Proteobacteria),放线菌门(Actinobacteria)和无壁菌门(Tenericuters)及其他一些门的微生物,占菌群含量相对较低<2.62%。其中,变形菌门(Proteobacteria)含量随着激素用量的提高而增加,生理盐水对照组0.33%,超促排卵组1.02%,卵巢过度刺激组1.22%;Actinobacteria含量则反而递减,生理盐水对照组0.81%,超促排卵组0.71%,卵巢过度刺激组0.42%。见图2。
在属(Genus)的水平上,3组样品相对丰度较高的有乳酸杆菌属(Lactobacillus)、艾克曼菌属(Akkermansia)、肠球菌(Enterococcus)和梭状芽胞杆菌XlVa(Clostridium XlVa)4个属,占肠道内含物菌群含量的54.70%以上。
与生理盐水对照组相比,随着外源激素用量增加超促排卵和卵巢过度刺激组肠道菌群微生物组成复杂度有所提高,且各优势菌群含量比例亦发生相应变化:乳酸杆菌属(Lactobacillus)在3组肠道菌群中占比最高,但其数量改变未呈现出规律性;艾克曼菌属(Akkermansia)呈现递减趋势(生理盐水对照组21.57%,超促排卵组16.28%和卵巢过度刺激组8.03%);而Enterococcus(生理盐水对照组8.76%,超促排卵组14.43%和卵巢过度刺激组17.02%)、未定义分类菌(Unclassified)(生理盐水对照组4.05%,超促排卵组5.28%和卵巢过度刺激组10.14%)和Barnesiella(生理盐水对照组1.85%,超促排卵组7.78%和卵巢过度刺激组7.79%)却呈现递增趋势。此外,Clostridium XlVa(生理盐水对照组8.45%,超促排卵组6.34%和卵巢过度刺激组6.76%)、Romboutsia(生理盐水对照组8.64%,超促排卵组0.02%和卵巢过度刺激组0.16%)和Acetatifactor(生理盐水对照组4.48%,超促排卵组0.26%和卵巢过度刺激组3.35%)含量也有较大降幅。见图3。
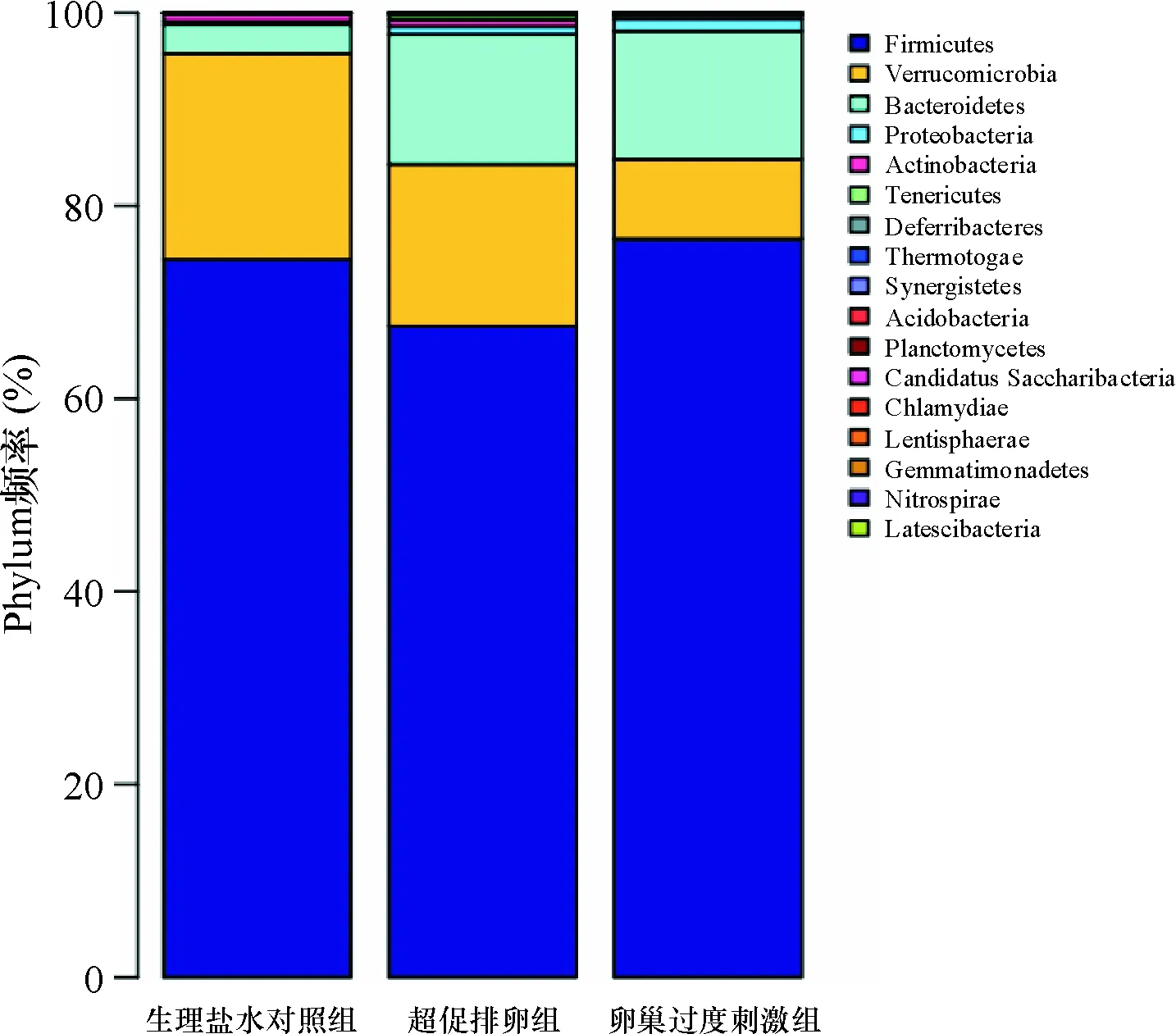
图2大鼠肠道菌群在门水平上的分布

图3 大鼠粪便菌群在属水平上的分布
3 讨论
动物肠道菌群中的有益微生物与有害微生物种类及数量长期处于一种动态平衡状态中,肠道微生态才能得以维持[4]。肠道正常菌群具有促进营养消化与吸收、抵御外来病原菌的入侵、产生重要代谢产物和生物活性成分等不可替代的作用[12]。若正常菌群的种类、数量和比例发生异常变化,则肠道菌群的平衡就会失调而对宿主肠道功能会产生不良影响[6-9]。在本研究中肠道菌群属水平,与生理盐水对照组相比较,随着外源激素用量的增加超促排卵组和卵巢过度刺激组的Shannon指数和ACE指数逐渐提高,而Simpson指数逐渐下降,说明在外源激素刺激下大鼠肠道菌群多样性的随之提高。3组大鼠的肠道微生物优势菌群的种类未见明显改变,以Firmicutes、 Verrucomicrobia和Bacteroidetes为主要菌门,但各菌群间的比例均发生了一定改变。此结果与刘冬恋等[13]的研究结果相似,肠道内微生物种类繁多, 其中包括Firmicutes、Bacteroides、变形菌门(Proteobacteria)和Verrucomicrobia等6个优势菌门,说明短时间的外源激素刺激并未改变大鼠肠道菌群的优势菌门。
外源激素的使用对大鼠肠道微生物的优势菌群会产生一定的影响。其中Akkermansia定植于动物肠道黏液层,特异性利用肠道黏蛋白进行生长,产生寡糖和短链脂肪酸,在宿主的免疫刺激和代谢信号传导过程中发挥重要作用;同时,黏蛋白降解刺激机体产生更多新的黏蛋白,使黏液层增厚,保护肠上皮细胞免受微生物的侵袭;促进宿主固有免疫和获得性免疫系统的发育,具有抗炎症作用。本研究中,Akkermansia的相对丰度随着外源激素用量增加呈现递减趋势,降低了其在大鼠肠道微生态中的有益作用,其相对丰度与炎性肠病、盲肠炎、肥胖和青少年自闭症等疾病呈负相关的结果[13]相似。
与Akkermansia的状态相反,大鼠肠道菌群中Enterococcus、Barnesiella和未定义分类菌等相对丰度随外源激素用量的提高呈现上升趋势。可能原因是宿主应激状态下,宿主与肠道菌群间的共生状态失衡,导致肠道内的致病菌增殖,影响宿主的健康状态。肠球菌是动物体内常见的共生菌,当宿主免疫机能下降时,会离开其正常寄居部位,并在特定组织局部聚集,然后黏附于宿主细胞的胞外矩阵蛋白,分泌细胞溶解素、明胶酶等毒力因子侵袭破坏宿主组织细胞,引发宿主的非特异性免疫应答,进而影响宿主感染性疾病的发生发展。研究证实肠球菌不仅可引起尿路感染、皮肤软组织感染,还可引起危及生命的腹腔感染、败血症、心内膜炎和脑膜炎等[14-15]。Barnesiella菌能够产生内毒素,而后者会损害肠道屏障、引起人体代谢和免疫失衡等不良反应[3,13]。
OHSS是辅助生殖技术应用领域中一个较为普遍的医源性疾病,外源激素的应用是其发病的主要诱因。本研究表明外源激素的应用,改变了大鼠的肠道菌群结构;随着激素剂量的增加,对于机体有益的菌群的相对丰度有所下降,而致病菌和未定义菌群的相对丰度则有所提高,进而诱发OHSS。特定菌种的发现,为日后靶向调节肠道菌群用以辅助OHSS治疗提供实验数据。但本研究每组的个体样品数量少,缺乏代表性作用,未来有可能时应行大样品高通量测序检测。
