益生菌改善尿毒症大鼠肠道巨噬细胞介导的细菌移位
2019-03-06孙凌霜梁珊珊薛瑾虹蒋红利
孙凌霜 刘 华 梁珊珊 薛瑾虹 魏 萌 蒋红利
尿毒症患者的不良预后与体内持续存在的微炎症状态密切相关[1]。我们团队前期的研究发现示踪大肠杆菌密度在尿毒症大鼠模型肠道组织中明显增加并且肠道外组织中大肠杆菌基因DNA增加[2-3],结合其他研究,提示肠道细菌和内毒素移位进入血循环可能是微炎症产生的原因[4]。促炎表型的巨噬细胞在很多肾脏疾病的进展中起到重要角色[5-6]。M细胞(microfold cell)吞噬肠出血性大肠杆菌(enterohemorrhagic escherichia coli,EHEC)并且之后被派伊尔淋巴结(Peyer’s patches)中的巨噬细胞吞噬可能是影响其感染效能的关键步骤[7]。脂多糖(LPS)是细菌的组成成分和Toll样受体的配体,表达在许多免疫细胞表面,包括巨噬细胞。Toll样受体4(TLR4)是动脉粥样硬化的中介,增强的LPS/TLR4信号可能是慢性肾脏疾病患者动脉粥样硬化加速启动因素[8]。LPS也诱导巨噬细胞表面的早期生长因子1(early growth response 1,EGR1)激活,并通过转录因子EGR1和核因子κB(NF-κB)诱导肿瘤坏死因子α(TNF-α)的表达[9]。因此,细菌产物可能激活巨噬细胞和其他免疫细胞以产生促炎介质并且触发炎症发生[10]。我们课题组前期的研究发现尿毒症大鼠存在肠道微生态失调,表现为益生菌的减少,病原菌和条件致病菌数量增加[11]。因此,补充益生菌可能会对尿毒症状态有益,减轻细菌移位和微炎症状态[3]。另外,乳酸杆菌减少黏膜微生态失调,并且在维持肠道屏障功能、改善局部肠道免疫、增强病原体的拮抗作用起到关键的角色[12-13]。因此,本研究旨在揭示肠道巨噬细胞在尿毒症大鼠细菌移位中的作用;通过评估细菌移位、巨噬细胞功能、尿毒症大鼠的微炎症状态调查乳酸杆菌的作用。
材料和方法
材料
示踪细菌 通过重组的绿色荧光蛋白质粒构建,以适应大肠杆菌DH5细胞。接种在含有100 μg/ml的氨苄青霉素Luria-Bertani培养基内,在37℃恒温培养摇床过夜,终浓度调整到108CFU/ml。
动物模型 SPF级成年健康雄性SD大鼠,体重200~250g,行5/6肾脏切除术造尿毒症模型。55只大鼠一期手术切除约2/3体积的左肾皮质;1w后,二期手术切除右侧肾脏。同时,20只大鼠进行两次打开肾包膜的手术操作。二期手术后10w,模型组存活且达到尿毒症诊断标准的有40只,随机的分成两组:尿毒症组(n=20)和尿毒症+益生菌组(n=20);假手术组存活20只。尿毒症+益生菌组每日灌胃益生菌1 ml(109CFU/ml),持续4周。研究方案被西安交通大学医学院实验动物伦理委员会批准。二期手术后14w,10%水合氯醛溶液0.5 ml/100g腹腔注射麻醉取材,每组随机选10只大鼠麻醉取材前2h灌胃绿色荧光蛋白(GFP)标记的示踪菌1 ml。
检测指标和方法
CD68和GFP共定位 低温恒温器切割肠道组织成5 μm厚的样本并在0.1%的胰蛋白酶(Difco Laboratories,Detroit,MI)中孵化,在37℃的PBS中浸泡30 min,加入10%羊血清37 ℃封闭60 min,滴加1∶ 200 小鼠抗大鼠-CD68的或者1∶ 200抗兔GFP 的 (Abcam,Cambridge,MA)一抗,切片平放于湿盒内4℃过夜;之后加二抗,滴加的1∶ 1 000 抗小鼠Dylight633 IgG和1∶ 1 000 抗兔异硫氰酸荧光素(FITC) IgG ( CWBio,武汉)二抗37℃孵育1h。
肠道形态 肠道组织标本修剪成0.1 cm×0.1 cm×0.1 cm,常规染色处理后H-7650电子显微镜(日立,东京)观察。
肠道通透性 二期手术后10w,随机选取每组10只大鼠,禁食8h,单独放入代谢笼。饮水自由,1ml水中含5 μCi的锝99标记的二乙烯三胺五乙酸(99mTc-DTPA)。检测24h尿液中99mTc-DTPA浓度。搜集总计500 μl的外周血和尿液使用γ射线计数器测放射性水平。计算肠道通透性。
EGR1和TLR4基因表达 二期手术后14w每组选取3只大鼠制备肠组织匀浆,Trizol法提取总RNA (CWbio,北京,中国)。引物序列如下:EGR1:forward:5′-AGCCTTCGCTCACTCCACTA-3′,reverse:5′-GACTCAACAGGGCAAGCATAC-3′; andTLR4:forward:5′-TGGCATCATCTTCATTGTCC-3′,reverse:5′-CAGAGCATTGTCCTCCCACT-3′。
EGR1、TLR4蛋白表达水平 二期手术后14周每组选取3只大鼠,取肠上皮组织进行匀浆,提取总蛋白,用BCA法测蛋白浓度(CWbio,北京)。加样40 μg/孔,10% SDS-PAGE电泳,转膜,5%脱脂奶粉37℃摇床封闭2h;加入1∶ 800 抗EGR1,1∶ 800 抗TLR4 (Abcam),和1∶ 1 000抗β-actin (CWbio,中国)一抗,4℃过夜,洗膜;加入HRP-共位的抗小鼠IgG(1∶ 3 000)或者抗兔IgG(1∶ 3 000) (Boster)二抗,室温下2h,洗膜,使用化学发光HRP试剂盒(Millipore,Billerica,MA)显色。
内毒素、血浆炎症指标 二期手术后14w每组随机选取10只大鼠,腹主动脉采血后分离出血清,检测肌酐、尿素氮、LPS、 C反应蛋白(CRP)、白细胞介素6(IL-6)、 TNF-α。
统计学方法采用IBM SPSS 19.0软件进行数据分析。结果表示为均值±标准差。连续变量用Student’s T检验。分类变量用卡方检验或者Fisher’s精确检验。P<0.05为差异有统计学意义。
结 果
三组大鼠一般资料尿毒症组和尿毒症+益生菌组的血尿素氮、肌酐浓度为假手术组的2~3倍(P<0.05)(表1)。
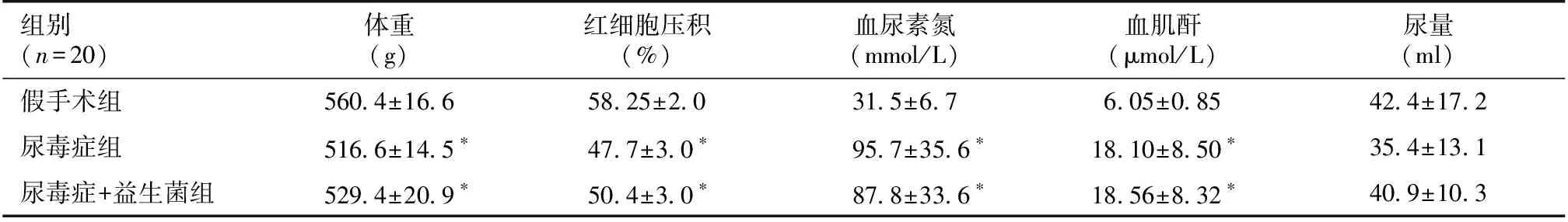
表1 三组大鼠的体重、红细胞压积、肌酐、尿素氮、尿量(均数±标准差)
*:与假手术组比较,P<0.05
肠道黏膜形态尿毒症组(D~F)较假手术组(A~C)的肠道上皮细胞之间的空隙增加并且紧密连接电子密度降低,桥粒连接模糊不清楚,上皮细胞内线粒体空泡形成(图1 C、F、I)。尿毒症+益生菌组(图1G~I)的可见损伤明显修复,微绒毛数量增加,固有层炎细胞浸润明显减轻,上皮细胞排列整齐,紧密连接结构较清晰、桥粒连接电子密度较高。尿毒症组中示踪菌黏附于绒毛少的上皮细胞上,并且通过坏死的上皮细胞进入黏膜层(图1E、F)。
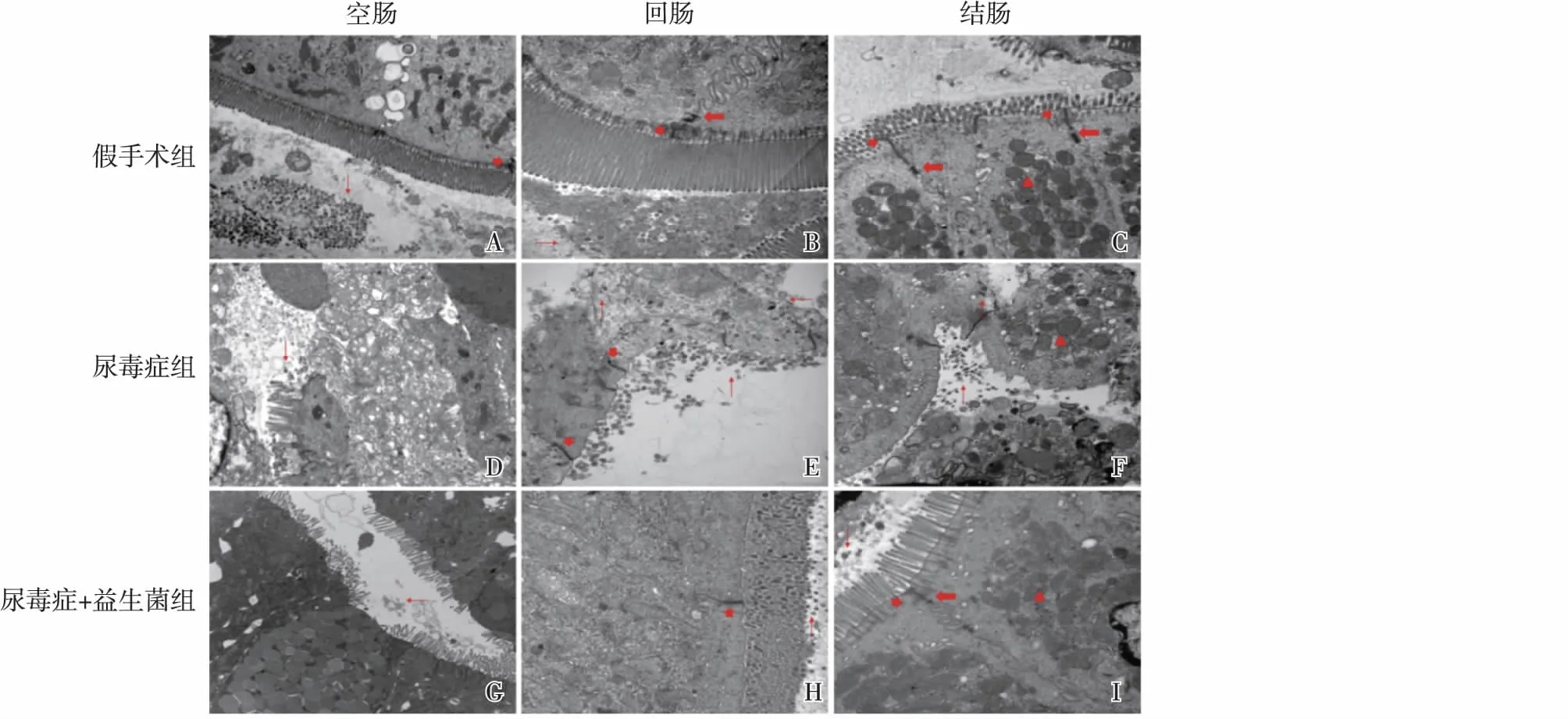
图1 透射电子显微镜观察的大鼠肠道黏膜(A,D,G)空肠,(B,E,H)回肠,(C,F,I)结肠;(A~C)假手术组,(D~F)尿毒症组,(G~I)尿毒症+益生菌组;↑指示示踪菌(A~I,除外);指示紧密连接(A,B,C,E,H,I);指示桥粒连接(B,C,I);△指示线粒体(C,F,I);尺标:2 μm(空肠);1 μm(回肠,结肠);尿毒症+益生菌组的肠道黏膜与尿毒症组比较可见微绒毛数量增加,固有层炎细胞浸润明显减轻,上皮细胞排列整齐,紧密连接结构较清晰、桥粒连接电子密度较高
尿毒症大鼠的细菌移位用抗GFP抗体(绿色)标记示踪菌,可以看到尿毒症组绿色荧光出现在回肠(图2E),肝脏、脾脏和肠系膜淋巴结(MLNs)用抗CD68 抗体(红色)标记肠道巨噬细胞,可以看到红色荧光在回肠(图2D),肝脏、脾脏和MLNs。尿毒症组中共定位巨噬细胞标记CD68和GFP标记的示踪菌,产生黄色荧光提示细菌与巨噬细胞在一起(图2F)。
假手术组只有回肠固有层可以看到很少数量的红色和绿色荧光(图2A、B)。巨噬细胞和GFP标记的示踪菌在尿毒症+益生菌组中是共定位的(图2G~I)。
益生菌对肠通透性、血浆内毒素和炎性因子的影响尿毒症+益生菌组比尿毒症组的肠道通透性明显下降(P<0.05),血中内毒素和IL-6、TNF-α、CRP明显减低(P<0.05)(图3)。
益生菌对巨噬细胞形态的影响尿毒症+益生菌组与尿毒症组比较巨噬细胞呈明显活化状态的表现,细胞体积增大并且细胞突出物和伪足也增多,内质网丰富,细胞内的初级和次级溶酶体明显增加(图4)。
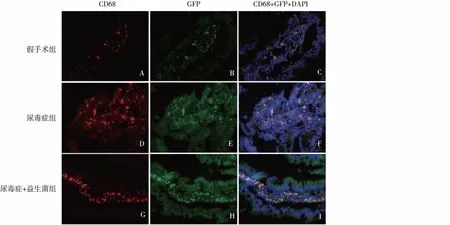
图2 三组大鼠回肠肠道切片标记CD68和GFPCD68(红色荧光小点)、GFP细菌(绿色荧光小点),DAPI(蓝色荧光小点)。尿毒症组可见显著的红色和绿色荧光,尺标:50 μm,CD68标记的巨噬细胞和GFP标记的示踪菌在尿毒症组中是共定位的GFP:绿色荧光蛋白;DAPI:4′,6-二脒基-2-苯基吲唑

图3 三组大鼠的肠通透性、内毒素、IL-6、CRP、TNF-α的水平IL-6:白细胞介素6;CRP:C反应蛋白;TNF-α:肿瘤坏死因子α;*与假手术组比较,P<0.05;#与尿毒症组比较,P<0.05
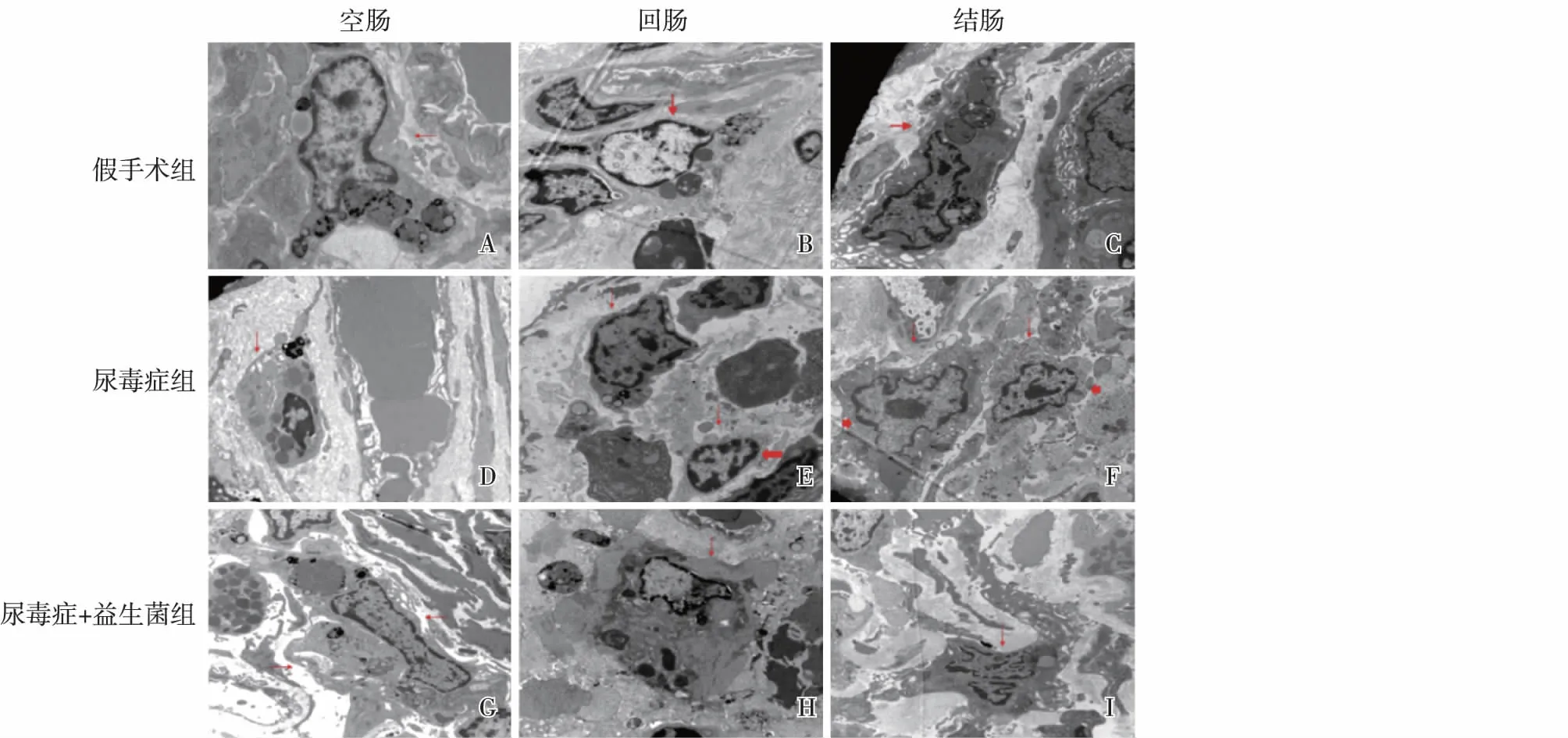
图4 透射电子显微镜观察的大鼠肠道巨噬细胞细箭头指示巨噬细胞(A~I),长厚箭头指示将要死亡的巨噬细胞(E),短厚箭头指示电子密度降低的巨噬细胞(F);尺标:2 μm;尿毒症+益生菌组与尿毒症组比较巨噬细胞呈明显活化状态的表现
Egr1和Tlr4表达尿毒症+益生菌组的所有肠段Egr1和Tlr4 mRNA平均倍数均显著低于尿毒症组(与尿毒症组比较P<0.05,图5A)。
免疫印迹结果中尿毒症+益生菌组的所有肠段TLR4蛋白条带与尿毒症组肠段比较,蛋白表达要显著地降低(图5B、C)。
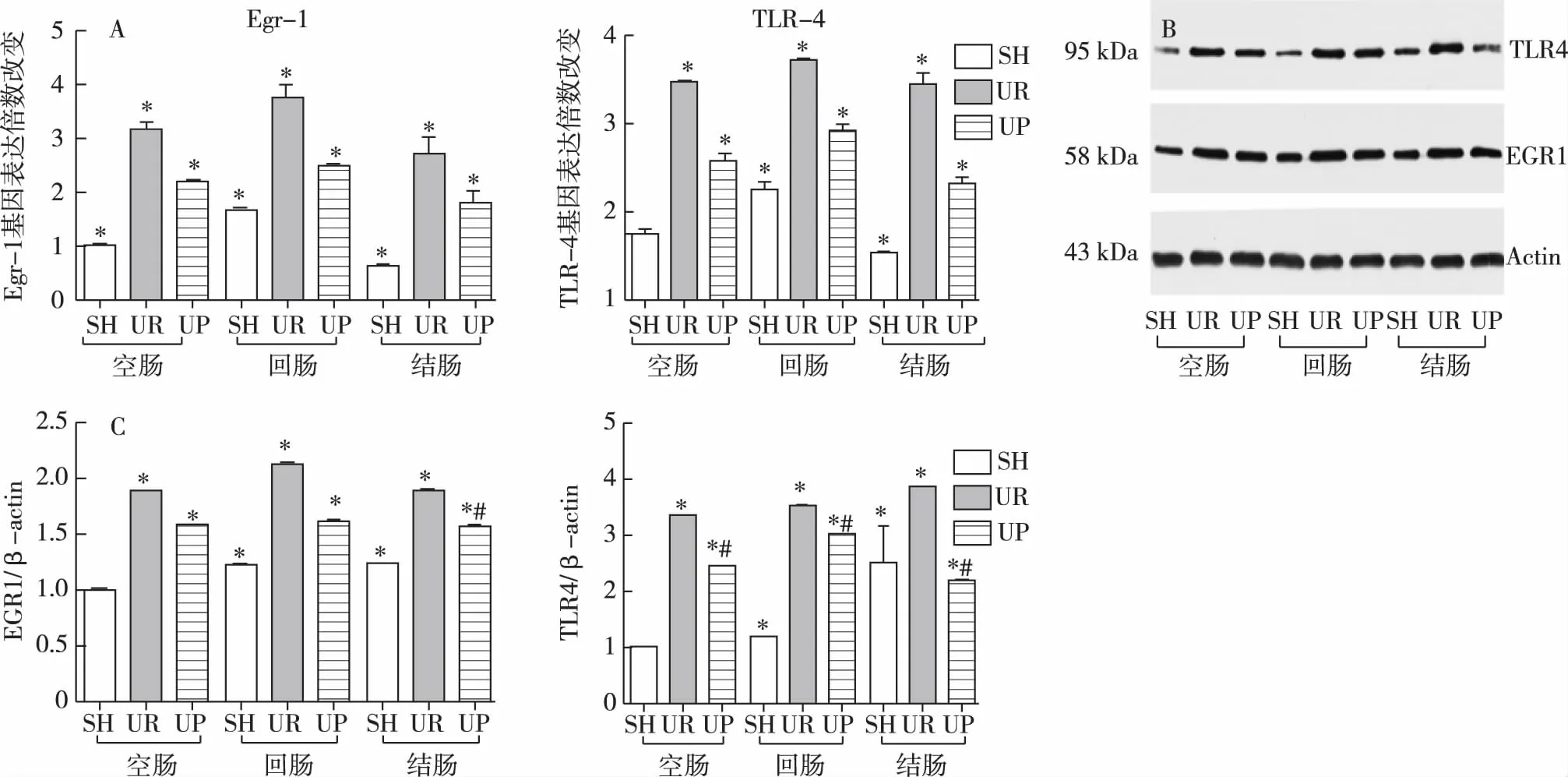
图5 三组各肠段的EGR1和TLR4表达SH:假手术组;UR:尿毒症组;UP:尿毒症+益生菌组。EGR1:早期生长因子1;TLR4:Toll样受体4;TLR4和EGR1基因表达的倍数变化。每个柱形图表示数据为均数±标准差。*与假手术组空肠比较,P<0.05;#与尿毒症组各个对应肠段比较,P<0.05
讨 论
本研究用GFP标记示踪菌,首次在尿毒症大鼠模型中直观观察到示踪菌出现在肠外组织(肝脏、脾脏、MLNs)。肠道巨噬细胞和示踪菌共定位,提示承载细菌的巨噬细胞穿过肠道黏膜帮助促进尿毒症时的细菌移位。尿毒症时肠道巨噬细胞向促炎症型分化,加重微炎症反应,肠道巨噬细胞吞噬功能障碍。尿毒症大鼠使用乳酸杆菌治疗后微炎症状态明显缓解,由于减轻了肠道巨噬细胞炎症激活和改善巨噬细胞吞噬功能、黏膜免疫屏障,因此细菌移位也有所减轻。
尿毒症时肠道细菌可以移位穿过不完整的肠道屏障,进入肠道、肠外组织及全身血循环内,并且对微炎症状态有贡献[14]。细菌可能经过M细胞或者不完整的肠上皮紧密连接穿过肠道屏障[15]。血中增加的内毒素水平也支持尿毒症时细菌移位的发生,并且有利于评估细菌移位的程度。由于肠道细菌过度生长和巨噬细胞的吞噬功能受损,肠道巨噬细胞不能及时清除细菌,并且未被杀灭的肠道细菌还利用巨噬细胞进入肠外组织和血循环。巨噬细胞被高水平的LPS刺激时会向促炎型转变[16]。巨噬细胞通过TLR4 被LPS激活,产生TNF-α[17]。本研究的结果表明,尿毒症组的肠道组织EGR1 mRNA增加,这与其他研究者发现LPS诱导刺激巨噬细胞产生EGR1一致[18]。换言之,LPS激活TLR4和EGR1,最终引起巨噬细胞迁移和活化,巨噬细胞释放促炎因子和炎症趋化因子(例如TNF-α 和IL-6)。尿毒症时某些革兰氏阴性细菌过度生长并且肠道屏障完整性被破坏,肠道巨噬细胞将细菌吞噬并通过其迁移转移,使内毒素进入血循环并刺激促炎细胞因子,导致持续性系统性炎症[10,19]。
本研究发现乳酸杆菌可以减少细菌移位,降低巨噬细胞激活标志物、内毒素、促炎因子水平。另外,乳酸杆菌修复肠道巨噬细胞微观形态。首先,乳酸杆菌增加益生菌数量同时减少条件致病菌数量,竞争性拮抗病原体黏附和定植肠道黏膜[20]。第二,乳酸杆菌通过正常化紧密连接蛋白帮助保持肠道黏膜的完整性[21]。第三,乳酸杆菌可能调节非特定的细胞免疫反应,改善肠道巨噬细胞吞噬功能,减少肠道巨噬细胞活化程度[22]。提示益生菌可能对尿毒症时改善肠道炎症反应以及减轻肠道巨噬细胞炎症反应和吞噬功能有帮助。
因此,本研究直接证实尿毒症时肠道细菌通过肠道巨噬细胞发生移位。尿毒症大鼠使用乳酸杆菌治疗后减轻了肠道巨噬细胞炎症激活、改善巨噬细胞吞噬功能、黏膜免疫屏障,因此微炎症状态和细菌移位明显减轻。
