双重血浆置换联合免疫抑制剂治疗重症狼疮性肾炎的疗效
2019-03-06章海涛周敏林王晶晶刘正钊龚德华胡伟新刘志红
章海涛 周敏林 代 敏 王晶晶 刘正钊 龚德华 胡伟新 刘志红
狼疮性肾炎(LN)是常见的自身免疫性疾病,占我国继发性肾小球肾炎的32.9%[1]。免疫抑制剂的应用极大地改善了LN的预后,20年肾存活率可达68.3%~89.7%[2-3]。多项指南中推荐了LN的治疗方案[4-6],但是对于一些重症LN,如病情快速进展、存在特殊合并症或合并血管病变,往往无法根据指南选择治疗方案,多依据研究者个人经验或多种治疗措施联合使用[7-9]。血浆置换(PE)在重症LN的治疗中取得显著疗效[10-11],但因血浆来源紧缺,导致该疗法应用受限。双重血浆置换(DFPP)是一种选择性血浆分离方法,可有效清除血浆中大分子物质,减少血浆用量[11-13]。我们的前期研究已经证实DFPP能有效清除LN患者自身抗体,改善肾功能,尤其对伴有血栓性微血管病(TMA)的LN患者,DFPP治疗能显著改善其远期肾存活率[14-15]。因此,本文回顾性观察了DFPP联合免疫抑制剂治疗重症LN的临床疗效及安全性,并分析影响远期肾存活的危险因素。
对象和方法
病例选择2009年7月~2017年9月在国家肾脏疾病临床医学研究中心住院的重症LN患者61例,系统性红斑狼疮(SLE)诊断符合美国风湿病协会1997的修订标准, SLE疾病活动指数(SLE-DAI>10分),所有患者均有肾脏损害并行肾活检。有以下症状之一即可采用DFPP治疗:(1)临床表现为急进性肾炎;(2)伴溶血尿毒综合征(HUS)或血栓性血小板减少性紫癜(TTP);(3)血清ANA或抗ds-DNA抗体高滴度阳性;(4)肾活检光镜下见大量新月体、肾组织内大量嗜复红物沉积,或者伴有TMA病变。
存在以下情况者不宜接受DFPP治疗:(1)凝血功能异常,伴有出血倾向或活动性出血;(2)合并感染;(3)生命体征不稳定。
肾组织病理所有患者均在B超引导下行经皮肾穿刺活检术,肾组织进行常规光镜、免疫荧光和电镜检查。病理分型参照2003年ISN/RPS分型标准,采用半定量方法评估活动性指数(AI)和慢性化指数(CI)。TMA 病变定义为肾间质小动脉内皮细胞肿胀、管腔狭窄或闭锁;腔内纤维素血栓和(或) 变形红细胞;管壁纤维素样坏死;袢内微血栓形成[16]。
DFPP治疗方法采用血浆分离器EC50W为一级滤器,EC20W为二级滤器(Asahi Kasei Kuraray Medical CO,Ltd,日本),低分子肝素联合枸橼酸抗凝。体外循环下,全血首先流经一级滤器(流量120~150 ml/min),再进入二级滤器(流量30~40 ml/min)滤过,滤出血浆回输至体内。被截留的血浆成分滞留在二级滤器中不断再循环(流量60 ml/min),当二级滤器前压力升高超过150~160 mmHg时,血浆分离停止,用生理盐水800 ml冲洗二级滤器,进一步滤过滞留的血浆成分。每次处理血浆量为1.5~2倍血浆容量,每次治疗后补充20~30g白蛋白及新鲜冰冻血浆200~400 ml。DFPP治疗2~3次/周[13,17]
免疫抑制剂治疗DFPP治疗同时静脉给予甲泼尼龙(0.5 g/d×3~6d),后续口服泼尼松[起始剂量0.6~0.8 mg/(kg·d)],4周后逐渐减量至10 mg/d维持;部分患者接受丙种球蛋白治疗;DFPP治疗2~4周后给予吗替麦考酚酯、他克莫司、多靶点疗法或间断静脉环磷酰胺诱导治疗6~12月,后续予小剂量泼尼松联合硫唑嘌呤、来氟米特或雷公藤多苷等药物治疗。
临床观察指标采集DFPP治疗前及治疗后血清进行相关检查。观察治疗后SLE-DAI、血清肌酐(SCr)、尿检及免疫学指标变化,治疗3个月摆脱透析患者比例,远期肾存活及其影响因素,以及DFPP治疗的不良反应。
疗效评估完全缓解(CR)定义为尿蛋白定量≤0.4 g/24h,无活动性尿沉渣,血清白蛋白≥3.5 g/dl,SCr正常,无肾外狼疮活动;部分缓解(PR)定义为尿蛋白定量下降超过基线值50%且<3.5 g/d,血清白蛋白≥30 g/L,SCr正常或上升不超过基础值的25%[4]。无效(NR)是指未达到CR或PR标准。终末期肾病(ESRD)定义为需要肾脏替代治疗(血透或腹透),或eGFR<15 ml/ (min·1.73m2) 持续>3个月,或SCr持续倍增。恶性高血压定义为:舒张压≥140 mmHg或收缩压≥220 mmHg,并伴有靶器官损害。肉眼血尿定义为尿沉渣红细胞计数≥600万/ml(多形型)。
统计学方法采用SAS 9.3统计软件进行处理,计量资料符合正态分布采用均数±标准差表示,非正态分布资料采用中位数(四分位数)表示,治疗前后比较采用配对t检验;计数资料采用病例数和(或)百分数描述,治疗前后比较采用配对精确概率法检验。采用Kaplan-Meier生存曲线方法描述肾存活率。采用Cox比例风险模型对影响肾脏预后的危险因素进行分析。P<0.05 为差异有统计学意义。
结 果
一般情况共纳入61例患者,女∶ 男=39∶ 22,平均年龄23.6(17.8,30.3)岁,33例(54.1%)初治患者,SLE病程14.0(1.7,62.6)月,LN病程2.9(0.8,40.1)月,SLE-DAI为18.3±5.0分。51例(83.6%)合并HUS或TTP,22例(36.1%)合并中枢神经系统病变(其中癫痫发作10例,脑梗塞9例,脑出血1例)。
肾损害临床表现37例(60.7%)表现为急进性肾炎(RPGN),34例(55.7%)需要即时肾脏替代治疗;SCr 315.6(209.5,534.0) μmol/L;35例(57.4%)尿蛋白定量≥3.5 g/d,30例(49.2%)肉眼血尿,37例(60.7%)合并恶性高血压。
其中Ⅳ型36例,Ⅴ+Ⅳ型17例,Ⅲ型1例,Ⅴ+Ⅲ型3例,Ⅴ型3例,Ⅱ型1例。29例合并TMA。AI 9.5±3.4分,CI 3.0±2.2分。
DFPP前后临床指标变化DFPP治疗2.6±0.7次(1~5次)后,SLE-DAI、SCr和ds-DNA阳性率显著下降,血清白蛋白明显上升。尿检改善不明显。
治疗3个月,SLE-DAI、SCr、ds-DNA和血清白蛋白阳性率进一步改善,肉眼血尿和尿蛋白定量较治疗前显著下降,补体C3/C4、血红蛋白和血小板较治疗前也显著升高。DFPP治疗前后及随访3个月的各项指标变化见表1。
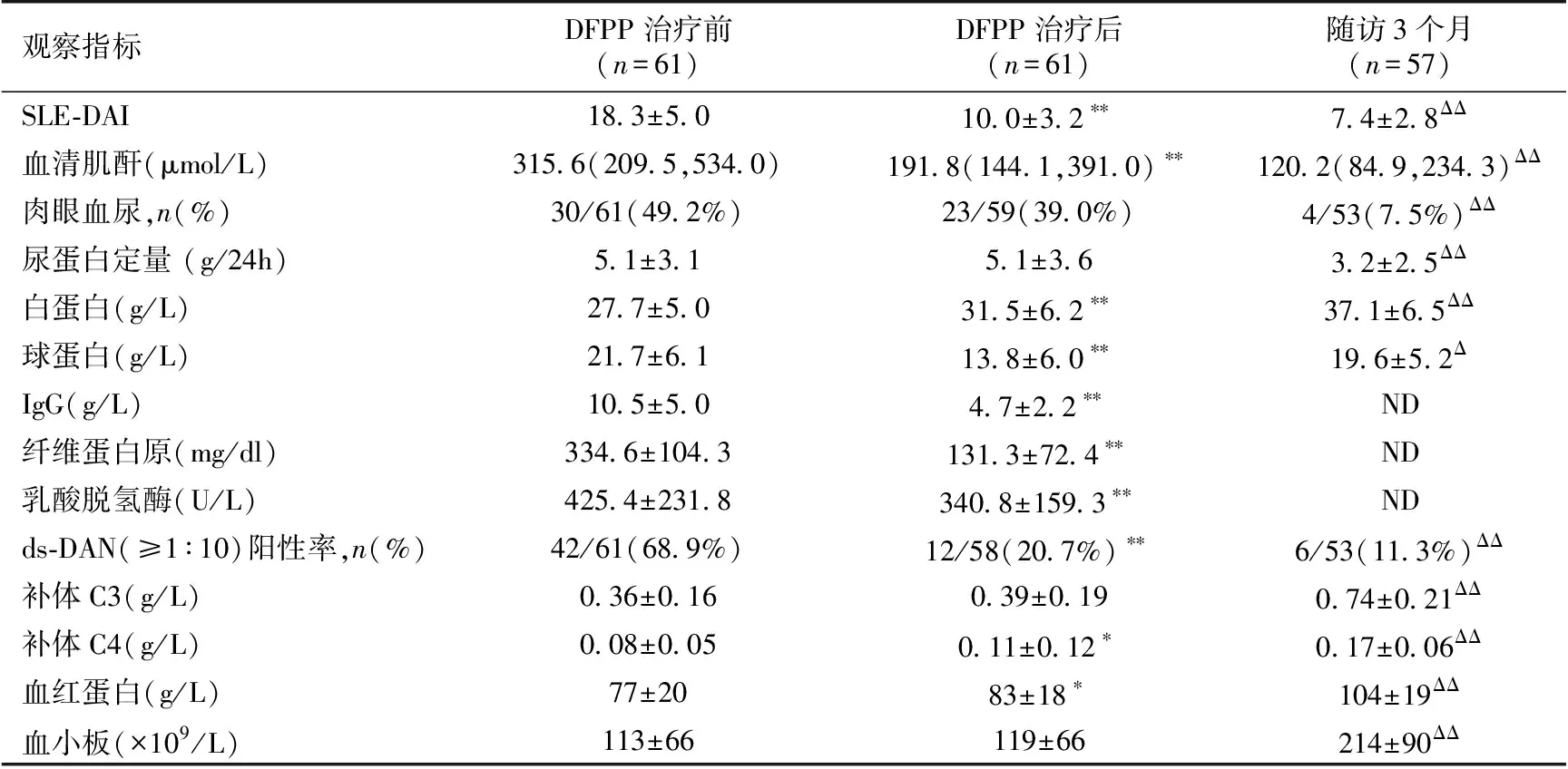
表1 DFPP治疗前后及随访3个月患者实验室指标变化
DFPP:双重血浆置换;SLE-DAI:系统性红斑狼疮疾病活动指数;DFPP治疗后与治疗前相比,**:P<0.01*:P<0.05;随访
3个月与DFPP治疗前相比,ΔΔ:P<0.01,Δ:P<0.05
近期临床疗效表2为治疗3个月和6个月的临床疗效。
34例需即时透析的患者,治疗3个月,有20例(58.8%)摆脱透析;治疗6个月,17例获得CR或PR,10例持续替代治疗。
61例患者治疗6个月有37例(60.7%)获得CR或PR,11例(18.0%)进入ESRD。
远期疗效及肾存活影响因素分析3例出院后即失访,3例死亡(2例分别于第2个月和第32个月死于肺部感染,1例于第12个月死于脑膜炎导致多脏器功能衰竭)。平均随访42.3(16.0,72.1)月,19例(31.1%)进入ESRD(14例肾脏替代治疗,5例SCr倍增),21例(34.4%)获得CR,15例(24.6%)获得PR。37.9%(11/29)伴TMA患者进入ESRD。

表2 DFPP联合免疫抑制剂治疗3个月和6个月的临床疗效
DFPP:双重血浆置换;SCr:血清肌酐;CR:完全缓解;PR:部分缓解;NR:无效
累计CR有25例,首次到达CR时间为15.9±10.6月。6例患者出现复发(5例肾脏,1例肾外复发)。死亡患者中有2例需即时肾脏替代治疗。
61例患者第3年、5年、8年的肾存活率分别为80.3%、77.0%和75.3%(图1)。
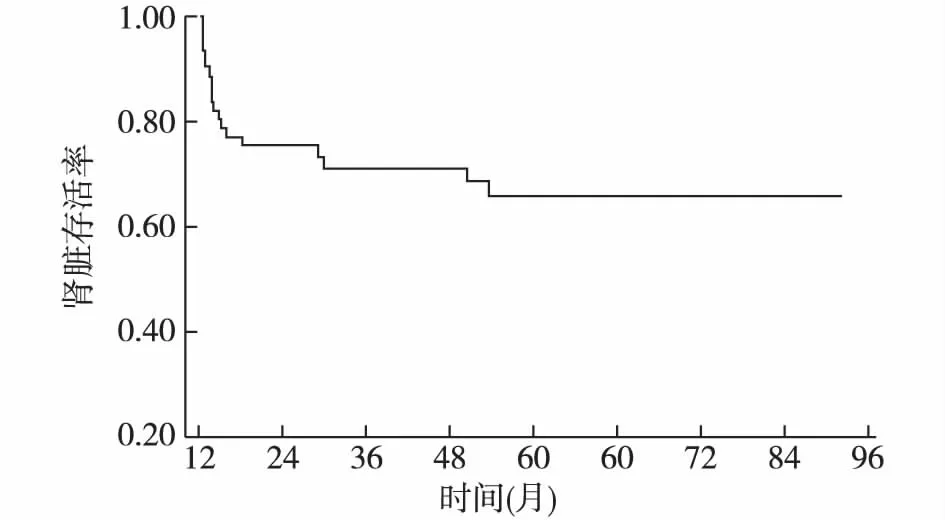
图1 61例重症狼疮性肾炎患者肾存活曲线
单因素COX分析显示,狼疮病程、是否初治、AI、CI、尿蛋白定量、起病时SCr水平、ds-DNA滴度、是否需要即时透析对肾脏存活有影响。多因素Cox回归分析仅发现CI(HR=1.31,95%CI 1.06~1.62,P=0.012)和起病时SCr水平(HR=26.65,95%CI 3.32~213.70,P=0.002)是影响肾脏存活的独立危险因素(表3)。
DFPP治疗的不良反应DFPP治疗后血清球蛋白、IgG、纤维蛋白原较治疗前显著下降。DFPP治疗期间,4例出现感染(3例导管感染,1例带状疱疹),2例凝血功能异常(1例咯血,1例凝血时间延长)。1例出现低血压反应,1例发热(考虑与滤器过敏有关),经对症治疗,症状消失。
讨 论
LN的治疗迄今取得了长足进步,指南推荐增殖性LN诱导期采用大剂量免疫抑制剂能改善病情,诱导缓解率高达56.2%~83.5%[18-19],有效的维持治疗可以防止复发,减少并发症,改善远期肾存活[20-22]。本文选择的重症狼疮患者,多合并RPGN,或伴有TMA或中枢神经系统、血液系统合并症,采用DFPP联合免疫抑制剂治疗,取得较好的临床疗效。
DFPP是在传统PE的基础上,通过第二个孔径较小的滤器,选择性清除血浆中大分子物质,如IgG、各种抗体、免疫复合物等,并将滤出的白蛋白、小分子物质重新输回患者体内。不仅高效清除大分子物质,更适用于血浆缺乏的情况下[11-13,17]。文献报道DFPP能够有效清除抗中性粒细胞胞质抗体、抗磷脂抗体及血脂、冷球蛋白等致病物质,从而达到改善病情的目的[17,23-24]。LN也有类似报道[25-26],Li等[27]报道12例LN患者采用DFPP联合激素治疗,水肿消退、肌酐恢复和白蛋白升高较对照组快,3个月的CR也高于对照组。
本文在前期研究的基础上,扩大了病例数,采用DFPP联合免疫抑制剂治疗后,SLE-DAI 和SCr明显下降,ds-DNA滴度下降或转阴;治疗3个月,58.8%需要即时透析的患者摆脱透析;治疗6个月,60.7%患者获得缓解。说明该疗法短期内能快速缓解狼疮活动,改善肾功能。

表3 采用COX回归模型分析影响肾存活的危险因素
RPGN:急进性肾小球肾炎;TMA:血栓性微血管病;DFPP:双重血浆置换
平均随访3.5年,36.1%进入ESRD或死亡,59.0%获得缓解。这类患者5年的肾存活率为77.0%,低于文献报道(93.1%~99.5%)[2-3],但是高于合并TMA(46.7%~38%)和新月体的患者(53.9%)[7,27-28]。远期肾存活与多种因素有关,如性别、狼疮病程、平均动脉压、SCr、血红蛋白、补体、CI、新月体、TMA及是否缓解等[2,16,28-30]。本文纳入的均为重症狼疮患者,虽然单因素分析发现多种因素对肾存活有影响,但是多因素分析仅提示CI和起病时SCr是肾存活的独立危险因素。因此,最终决定这类患者肾脏结局的仍然是慢性病变和起病初的肾功能状态。DFPP联合免疫抑制剂治疗6个月的疗效与随访终点疗效相似,复发率低,说明长期免疫抑制剂治疗,对预防复发、保护肾功能有益。
文献报道PE治疗隔日一次,至少7~14次[10-11],虽然DFPP清除抗体效率高于PE,但是其合适的治疗剂量和疗程仍不清楚。本文中每例患者平均接受2.6次DFPP治疗,无论是疗程、血浆用量还是药物经济学,均优于PE治疗。 虽然DFPP治疗后出现IgG和血浆纤维蛋白原降低,容易导致感染和出血等并发症,但是本文仅发现4例感染、2例凝血功能异常的患者。说明DFPP治疗的安全性较高。
本文为单中心回顾性研究,样本量较少并缺乏对照;DFPP治疗后的免疫抑制剂方案亦不统一,在一定程度上也影响了疗效分析。后续将开展随机对照研究,进一步评估DFPP的治疗作用。
小结:DFPP联合免疫抑制剂治疗能够快速清除自身抗体,缓解狼疮活动,改善肾功能;总缓解率和肾存活率相对较高,CI和起病时SCr是影响肾存活的独立危险因素。DFPP联合免疫抑制剂是治疗重症LN的一种有效手段。
