肾小球毛细血管内增生伴巨噬细胞浸润的IgA肾病
2019-03-06罗慧婷梁少姗梁丹丹张明超陈听雨刘志红曾彩虹
罗慧婷 梁少姗 梁丹丹 徐 峰 张明超 李 平 陈听雨 刘志红 曾彩虹
IgA肾病(IgAN)是我国最常见的原发性肾小球肾炎(PGN)[1],其发病机制尚未明确,多重打击学说是目前主流的观点。异常糖基化IgA1(Gd-IgA1)是最关键的致病因子,Gd-IgA1与其自身抗体结合形成的免疫复合物能够刺激系膜细胞分泌大量炎症细胞因子,引起炎症细胞募集导致肾脏的损伤[2]。IgAN肾小球内炎症细胞数普遍较少,且以巨噬细胞为主(多为0~3个/肾小球),肾小球内大量炎症细胞浸润者很罕见[3-4]。Soares等[5]研究发现伴毛细血管内增生(E)的IgAN患者,肾小球内巨噬细胞数明显较多,且与E病变程度呈正相关。东部战区总医院国家肾脏疾病临床医学研究中心观察到少数IgAN-E的患者肾小球内出现大量巨噬细胞浸润伴毛细血管内增生(EPGN)或膜增生(MPGN)样表现。有关这类患者的研究报道不多,其是否与疾病进展相关有待探究。本研究回顾性分析了这类患者的临床病理特征及预后,分析肾小球内浸润的炎细胞,并探究其可能的发病机制。
对象和方法
研究对象2009年8月至2010年10月在东部战区总医院国家肾脏疾病临床医学研究中心经肾活检确诊IgAN患者588例。均符合以下标准:(1)PAS染色下肾小球个数不少于8个;(2)肾活检时估算的肾小球滤过率(eGFR)≥30 ml/(min·1.73 m2);(3)具有完整的临床病理资料;(4)排除过敏性紫癜性肾炎、狼疮性肾炎(LN)等继发性IgAN;(5)排除合并其他疾病,如糖尿病肾病(DN)、间质性肾炎等;(6)排除肾活检前3个月内有使用过免疫抑制剂(ISs)治疗的患者。从中筛选出IgAN-E患者62例,计算其肾小球巨噬细胞平均数的第95百分位数,定义为大量巨噬细胞浸润的阈值,其中小于此阈值的59例作为对照组,从2009年~2017年经肾活检确诊且符合上述标准的IgAN-E患者中,筛选出肾小球巨噬细胞数大于此阈值的38例患者作为研究组。
观察指标
临床资料及实验室检查 收集患者性别、肾活检时年龄、肾脏病病程、收缩压、舒张压、24h尿蛋白定量、尿沉渣红细胞计数、血清白蛋白( Alb) 、血清肌酐(SCr) 、尿酸(UA) 、总胆固醇(CH) 、三酰甘油(TG),随访时间和肾脏生存情况。对研究组患者肾活检时的血清标本行免疫固定电泳和游离轻链检测。
相关指标定义 eGFR的计算方法:采用CKD-EPI公式。ESRD定义为eGFR<15 mL/(min·1.73 m2)或肾脏替代治疗。ISs包括糖皮质激素、环磷酰胺、来氟米特、吗替麦考酚酯。主要终点事件定义为ESRD,次要终点事件定义为eGFR下降50%以上。
肾脏病理 常规送光镜、免疫荧光及电镜检查。病理评分由2名肾脏病理医师参照最新IgAN牛津分型[6]完成,包括系膜增生(M)、E、肾小球节段硬化(S)、肾小管萎缩间质纤维化(TAIF)、新月体(C)、肾小球球性硬化(GS)和袢坏死(N),动脉病变(动脉硬化及透明变性)。免疫荧光IgG、IgA、IgM、C3、C1q,κ、λ轻链染色。电镜观察有无电子致密物沉积、沉积部位,足细胞足突融合程度(节段<50%,广泛≥50%)。
肾组织免疫组织化学染色及阳性细胞计数CD68(Clone BU63,Dako,1∶ 100)作为巨噬细胞标记物,CD163(Clone ab156769,Abcam,1∶ 200)作为M2型巨噬细胞标记物,诱生型一氧化氮合酶(iNOS) (Clone3523,Abcam,1∶ 200)作为M1型巨噬细胞标记物,CD3(Clone 565,Newcastle,1∶ 100)作为T细胞标记物,CD20(Clone L26,Dako,1∶ 100)作为B细胞标记物;通过免疫组化标准自动染色机(Leica BOND,the United States)对患者肾组织连续切片进行染色。对正切且非硬化的肾小球进行阳性细胞计数。
免疫荧光双套染单克隆抗体KM55(100 mg/ml,IBL,Japan)能够特异性结合血清及肾组织中Gd-IgA1[7]。对两组患者肾组织进行KM55及IgA1免疫荧光套染,在共聚焦显微镜(Zeiss LSM710)下观察。
统计学方法采用SPSS 19.0统计软件进行数据分析。正态分布数据以均值±标准差表示,组间比较采用Student’st检验或单因素方差分析。非正态分布数据以中位数(范围)表示,组间比较采用Man-Whitney、Kruskal-Wallis 检验。分类变量以百分数表示,组间比较采用Pearsonχ2检验或Fisher精确检验。Kaplan-Meier方法用于生存率分析。正态分布数据相关性用Pearson’s相关性分析,非正态分布数据使用Spearman’s相关性分析。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
两组IgAN-E患者临床病理特征62例IgAN-E患者肾小球CD68+细胞的中位数为4.2(2.3~6.1)个/肾小球,其第95百分位数即大量巨噬细胞浸润阈值为14个/肾小球。
两组IgAN-E患者的临床特征见表1。研究组患者相比于对照组,疾病病程更短、血压更高、水肿更常见;蛋白尿更多,Alb更低,CH、TG更高(P值均<0.05);两组SCr、eGFR、血尿无显著差异。研究组患者的血清免疫固定电泳及轻链比值也均未见异常。
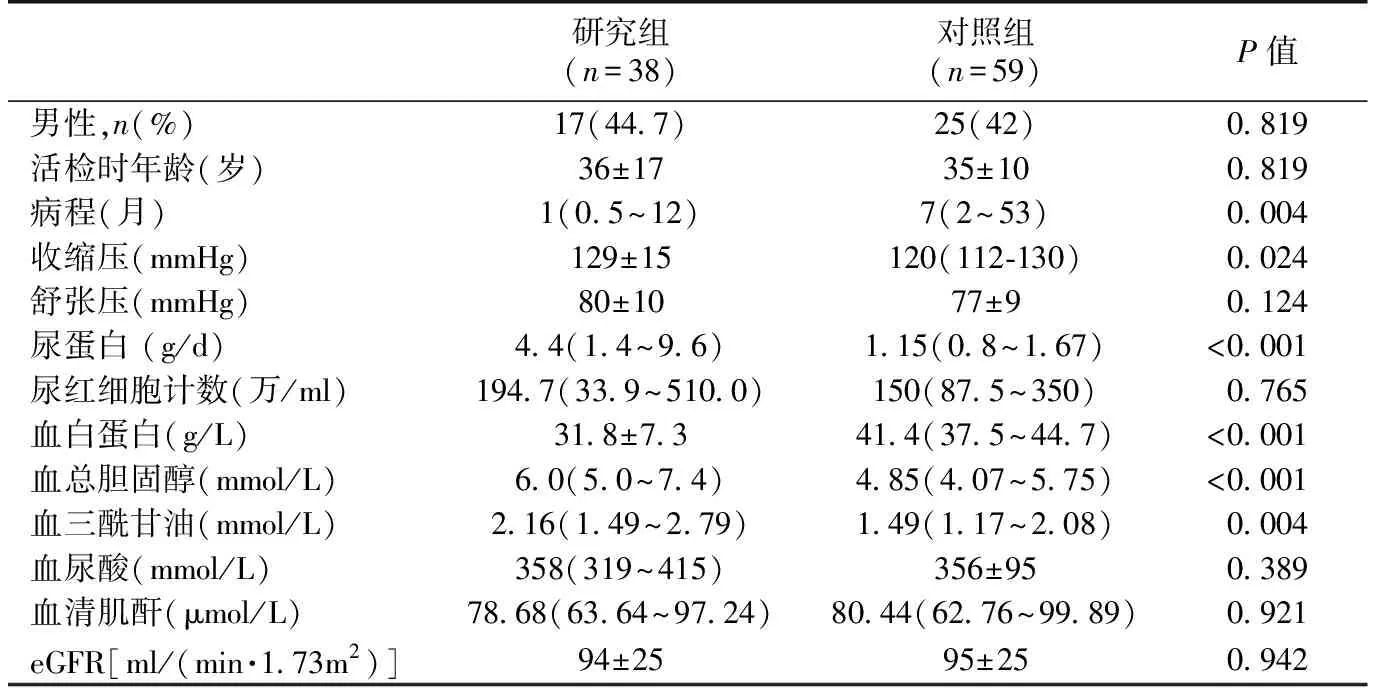
表1 两组患者肾活检时临床基线特征
eGFR:估算的肾小球滤过率;计量资料以中位数(25%分位数~75%分位数)或均值±标准差表示; 分类资料以百分数表示
两组患者的病理特征见表2。毛细血管内细胞增生伴袢腔内大量单个核细胞浸润是研究组患者典型的病理改变(图1A),所有患者肾组织κ、λ染色均为阳性。与对照组相比较,研究组患者活动性病变更明显(E,M评分),慢性病变较轻(GS,S,TAIF),而C、N病变在两者间无显著差异。免疫荧光结果显示伴IgG、IgM、C1q沉积比例两组间未见明显差别;研究组患者的IgA以系膜区及血管袢沉积为主(82%)(图1B),而对照组则以系膜区沉积为主(80%)。84%研究组患者伴有内皮下电子致密物沉积(图1C),21.6%患者伴有上皮侧的沉积,且都显著高于对照组的54%和0%。足突广泛融合的比例在两组间无差异。研究组动脉透明变性比例低于对照组(39%vs68%,P<0.006),两组动脉硬化无差异(P=0.085)。
肾小球内浸润细胞数量与临床病理的相关性研究组患者肾小球巨噬细胞及M1、M2型巨噬细胞免疫组化染色见图1D~F,肾小球内CD68+,CD163+,iNOS+,CD3+细胞数依次为18.9(15.6~25.6)个/肾小球,13.4±4.4个/肾小球,1.5(0.6~2.0)个/肾小球和 1.1(0.0~2.0)个/肾小球,CD20+细胞未见。肾小球内浸润细胞数间相关性分析显示:肾小球CD68+细胞与CD163+细胞数间呈正相关(r=0.601,P<0.001),与iNOS+细胞数间无相关性(r=0.303,P=0.065);肾小球炎细胞数与临床病理指标相关性分析表明:肾小球内CD68+与CD163+细胞数都与E病变程度呈正相关(r=0.477,P=0.002;r=0.368,P=0.023),iNOS+细胞则与蛋白尿呈正相关(r=0.558,P<0.001)和白蛋白、S%、TAIF%呈负相关(r=-0.464,P=0.003;r=-0.468,P=0.003;r=-0.332,P=0.041)。
随访及预后特征研究组、对照组中位随访时间分别为42个月和88个月,前者90%的患者接受过ISs治疗,后者为42% (P<0.001)。在随访末,研究组患者的eGFR高于对照组患者的,但前者ESRD发生率却高于后者,其他实验室指标未见明显差异。生存分析结果表明两组患者的肾脏存活率有显著的统计学差异,研究组患者的肾脏预后更差(图2)。

表2 两组患者肾活检病理特征
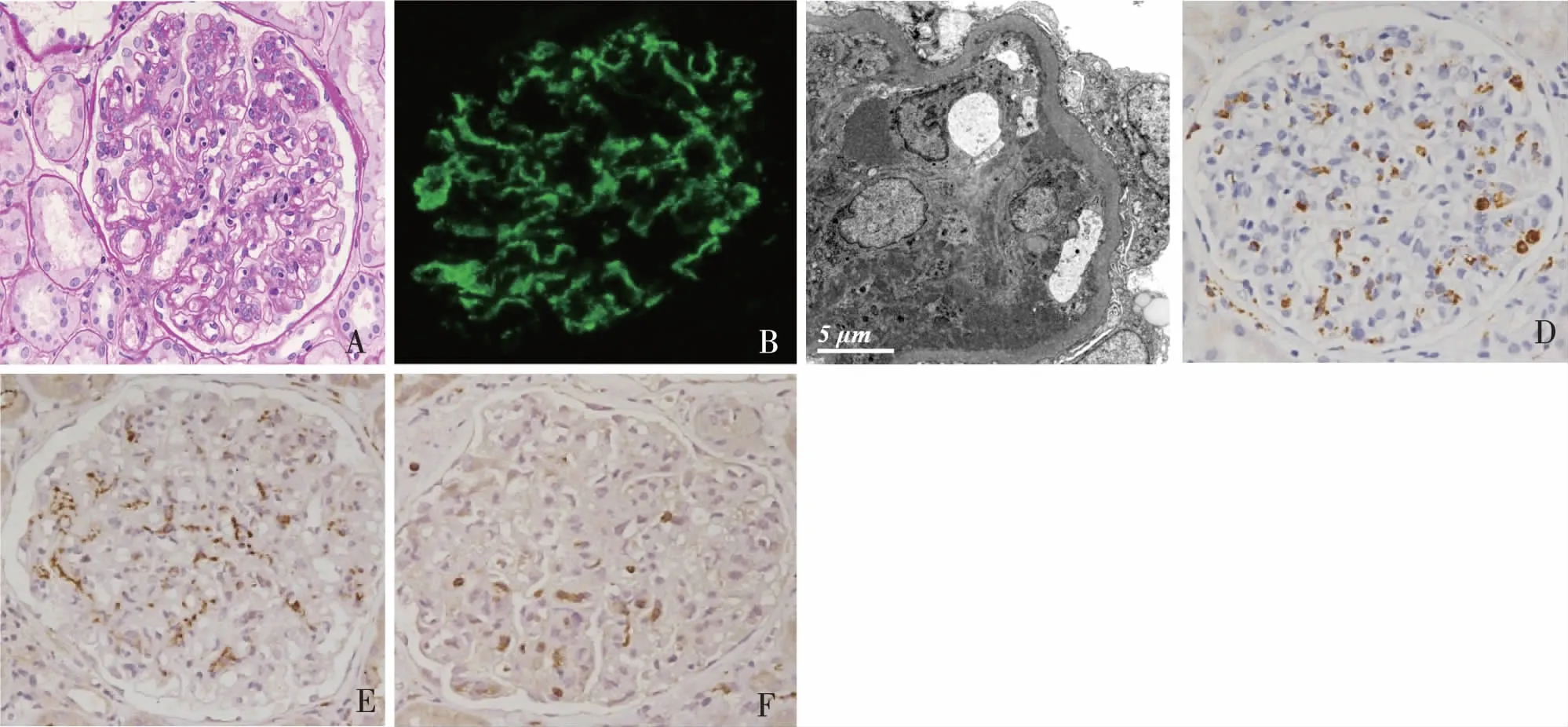
图1 研究组患者肾活检病理改变A:肾小球弥漫毛细血管内增生伴大量单个核细胞浸润(PAS,×400);B:IgA沉积于肾小球系膜区及毛细血管袢(IF,×400);C:肾小球节段内皮下电子致密物沉积(EM);D~F:肾组织免疫组化,分别为CD68+ 、CD163+ 和iNOS+ 细胞(IH,×400)
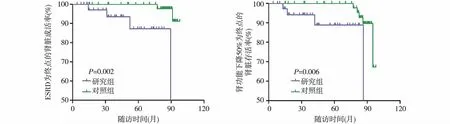
图2 两组患者分别以终末期肾病(ESRD)及肾功能下降50%为终点的肾脏生存率曲线
KM55与pIgA1免疫荧光共定位为了探究研究组肾小球内沉积的IgA是否为Gd-IgA1,我们对研究组和对照组患者均行KM55与IgA1免疫荧光套染。结果显示所有患者肾小球KM55均为阳性,并很好地与IgA1重叠(图3)。
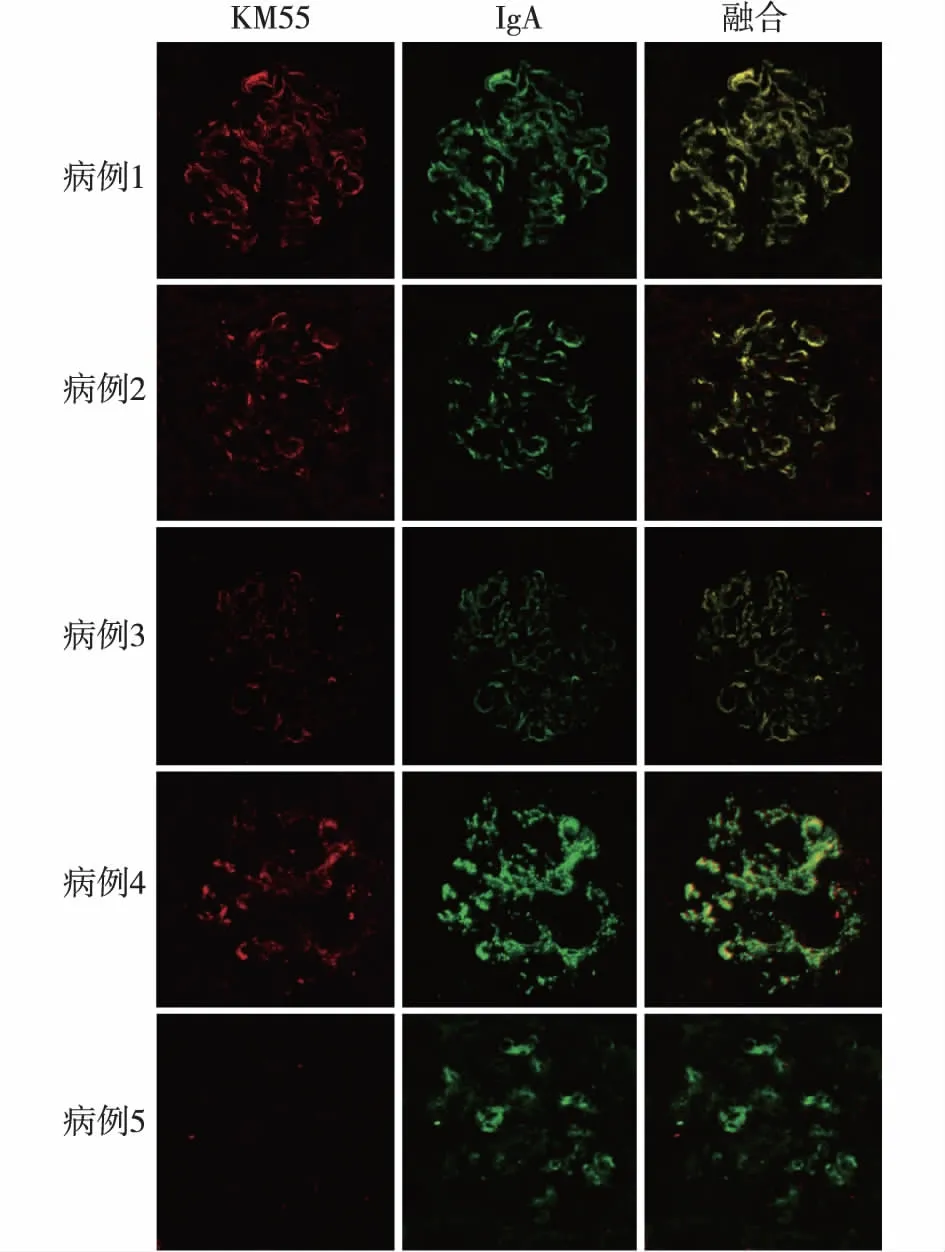
图3 KM55和IgA免疫荧光套染(IF,×400)病例1~3来自研究组,病例4来自对照组,病例5为狼疮性肾炎患者。病例1~4肾小球KM55均为阳性,并与IgA重叠;病例5肾小球KM55阴性,IgA阳性
讨 论
IgAN患者的治疗反应及肾脏结局存在高度的异质性,认识、理解与疾病进展相关的危险因素具有重要意义。基于病理改变提出的MEST-C牛津分型也是为了更准确的预测疾病预后。但其中E病变并非独立的预后预测因子,即使在伴E病变而未使用ISs的患者中肾功能下降更快[8];且后续的验证研究表明在未使用过ISs的IgAN患者中,E能够独立预测疾病预后[9]。推测是由于伴E病变时ISs使用率更高导致的治疗偏倚掩盖了其预测价值。IgAN肾小球内巨噬细胞数较少,且与E病变程度呈正相关;既往有研究对弥漫毛细血管内增生性IgAN患者进行探究,但均未涉及浸润的巨噬细胞[10-11]。然而我们偶能在IgAN-E中见伴肾小球内大量巨噬细胞浸润的患者,其与一般IgAN-E患者相比较有何异同尚未被探讨。本文遂对这类患者展开研究,并定义肾小球巨噬细胞平均数14个/肾小球为大量巨噬细胞浸润的阈值。
两组患者的临床表现有显著差异。首先,研究组患者多为肾病综合征样表现,并以肾病范围蛋白尿为特征。而这在IgAN并不常,多见于因足细胞足突融合所致的微小病变性IgAN中,但这类患者肾小球和肾小管间质病变轻[12]。研究组只有32%的患者存在足突广泛融合,因此推测患者内皮细胞损伤可能也是导致大量蛋白尿产生的原因[13]。其次,研究组患者ISs使用率高和肾脏预后差。因本研究属于回顾性研究,不能排除治疗偏倚或其他混杂因素对预后的影响,所以需大样本前瞻性研究进一步的验证。
病理形态学方面,相比于以系膜细胞增生、基质增多为特征的对照组,研究组则主要为EPGN或MPGN样改变。此外,研究组患者肾小球IgA多沉积在系膜区及外周毛细血管袢(PWC)。有研究表明,IgA在PWC的沉积与M评分和E病变更高相关,与肾脏存活率无关[14]。但Alvarado等[15]指出,IgA系膜区及PWC的沉积不仅与肾脏预后差相关,还与蛋白尿、新月体及袢坏死相关,并且猜测是由于PWC的沉积使炎症趋化因子更易进入血液循环,从而引起更多的白细胞募集浸润导致了损伤的加重。由此我们猜想这类患者IgA在PWC的广泛沉积可能是导致临床病理改变特殊的直接原因。
巨噬细胞能够根据组织微环境的变化,激活极化为不同的细胞亚型;促炎症细胞因子(IFN -γ,LPS等) 能够诱导其极化为M1型并分泌促炎因子,导致炎症反应和抗菌作用;而抗炎症细胞因子(IL-4,IL-13等)能够诱导其极化为M2型从而分泌胰岛素生长因子、甘露糖受体1等促进损伤修复和炎症缓解[16]。本研究结果表明M1、M2型巨噬细胞均存在于患者肾小球中,且以M2型为主。可能因为肾活检多在损伤发生的一段时间后进行,所以难以观察到以M1型为主的疾病损伤起始阶段。LN、DN的类似研究也表明,肾小球内浸润的巨噬细胞主要为M2型[17-18]。M2型巨噬细胞可能是导致毛细血管内皮细胞增生的原因,也可能两者互为因果。
IgAN患者血清中Gd-IgA1的浓度显著高于健康人及其他肾小球疾病患者,且与疾病进展相关[19]。而且Suzuki等[7]研究表明除IgA血管炎外其他的继发性IgA沉积的肾小球疾病(如LN、MPGN)的肾小球内均未能检测到Gd-IgA1。于是我们曾假设,研究组患者肾小球沉积的IgA1不是Gd-IgA1,这或许是导致他们表现不同的根本原因。但研究结果显示IgA仍为Gd-IgA1,提示该类IgAN可能只是IgAN的一种少见的特殊类型。
小结:IgAN-E伴大量肾小球巨噬细胞浸润是IgAN少见且特殊的组织学改变,其临床病理表现活动性更高及肾脏预后更差,肾小球内浸润的巨噬细胞以M2型为主,并以Gd-IgA1沉积为主。
