番茄灰霉病菌拮抗稀有放线菌的分离及其抑菌物质分析
2019-03-06,,,
,,,
(沈阳农业大学 植物保护学院,辽宁 沈阳 110866)
番茄灰霉病是由灰葡萄孢菌(Botrytiscinerea)引起的一类重要的植物病害,可导致番茄果实腐烂和减产[1-2]。生物防治及抗生素防治是遏制番茄灰霉病的有效手段。作为有效防治番茄灰霉病的生防菌剂,多株商业化的芽孢杆菌已被登记注册并投入市场[3]。木霉菌[4]和唐菖蒲伯克霍尔德菌[5]是防治番茄灰霉病的有效菌株。此外,放线菌也是一类有效抑制番茄灰霉病的生防菌来源。徐大勇等[6]从土壤中分离到1株吸水链霉菌HNU-1,其发酵滤液6.67倍稀释液对番茄灰霉病的预防和治疗效果分别为87.8%和77.9%。王美琴等[7]从番茄植株根茎接合部分离到1株酒红链霉菌菌株St24,其对番茄灰霉病菌具有显著的抑菌活性。
因为放线菌可以合成丰富多样的抑菌活性产物,所以抑菌活性放线菌的分离也是生防研究的焦点[8]。沈玲[9]从土壤、水和煤样品中分离出409株放线菌,其中有2株抑菌活性较强的链霉菌;宋洪允等[10]分析了从土壤中分离的94株放线菌,获得了4株具有较高抑菌活性的放线菌;朱正兵等[11]从土壤中筛选出4株对油菜菌核病菌有显著抑制活性的放线菌;张志斌等[12]从野生稻根中分离的链霉菌FRo2对小麦赤霉菌、立枯丝核菌等均有较好的抑菌效果;BOUKAEW等[13]为防治辣椒根腐、茎腐和青枯病,从265株候选链霉菌菌株中筛选出14株有抑菌活性的菌株。但是针对番茄灰霉病分离的放线菌较少,且主要研究内容集中于生防活性测定。生防菌在田间应用往往存在效果不理想、活性稳定性差等缺点。为此,从辽宁省各地不同生境采集的土样中分离筛选新型放线菌,通过分析菌株合成产物的稳定性及化学成分,发掘新型拮抗灰葡萄孢菌的天然产物,为进一步开发新颖、高生防活性的生物源农药提供菌种资源。
1 材料和方法
1.1 材料
1.1.1 供试放线菌菌株 分离自辽宁省各地所采集的110份土壤样品,共44株。
1.1.2 供试病原菌 灰葡萄孢菌(Botrytiscinerea,分离自番茄灰霉病样品)、禾旋孢腔菌(Cochliobolussativus,分离自小麦根腐病样品)、辣椒疫霉菌(PhytophthoracapsiciLeonian,分离自辣椒疫病样品)、串珠镰孢菌(FusariummoniliformeSheld.,分离自水稻恶苗病样品)、大斑凸脐蠕孢(Exserohiumturcicum,分离自玉米大斑病样品)、禾谷镰孢菌(Fusariumgraminearum,分离自小麦赤霉病样品)、核盘菌(Sclerotiniasclerotiorum,分离自向日葵菌核病样品)由沈阳农业大学植物保护学院植物病理教研室分离并提供。
1.1.3 培养基 ①保存及繁殖培养基:高氏一号培养基,含可溶性淀粉20 g/L、KNO31 g/L、K2HPO40.5 g/L、MgSO4·7H2O 0.5 g/L、NaCl 0.5 g/L、FeSO4·7H2O 0.01 g/L、琼脂粉18 g/L。②产孢培养基:绿豆汤培养基,质量浓度30 g/L(煮沸去渣)。③生测及病原菌保藏培养基:PDA培养基,含葡萄糖20 g/L、马铃薯200 g/L、琼脂粉18 g/L。④孢子萌发培养基:RPMI1640培养基(沈阳和君生物科技有限公司)。
1.1.4 供试药剂 百菌清药剂(99.97%,百灵威科技有限公司)原药以少量DMSO加水配制成250 μg/mL母液。
1.2 活性放线菌的筛选和抑菌活性测定
1.2.1 放线菌抑菌活性初筛 采用平板对峙法。用5 mm打孔器打取病原真菌菌饼,接于PDA平板中央,在四周分别等距离接入5 mm的放线菌菌饼,对照(CK)用5 mm的琼脂块代替,每个处理重复3次。于28 ℃恒温培养箱培养,待CK中真菌长满平板时,观察有无抑菌环出现,若有则记录抑菌环直径。
1.2.2 放线菌抑菌活性复筛 复筛采用菌丝生长速率法。取初筛后抑菌活性较好的放线菌,用接种环挑取少量菌丝接种于装有10 mL高氏一号培养液的试管中,在150 r/min摇床上培养3~5 d,将发酵液经滤膜过滤后与熔化的PDA培养基按照1∶9的比例混合,制成发酵液培养基,对照(CK)用PDA培养基代替。用5 mm的打孔器打取供试病原真菌的菌饼,接种于发酵液培养基和PDA培养基平板上,于28 ℃恒温培养箱中培养,待CK中真菌长满平板时,记录发酵液平板中真菌的直径大小,并计算抑制率。每个处理重复3次。抑制率=[(对照菌落直径-菌饼直径)-(处理菌落直径-菌饼直径)]/(对照菌落直径-菌饼直径)×100%。
1.2.3 放线菌发酵液的制备 取保存于试管中的放线菌,挑取菌丝划线于高氏一号平板上,28 ℃恒温培养4 d,用直径8 mm打孔器打取菌饼,接种8块于装有100 mL高氏一号液体培养基的三角瓶中,28 ℃、180 r/min振荡培养7 d,在无菌条件下以无菌注射器吸取发酵液利用细菌滤器过滤掉菌丝体备用。
1.2.4 孢子萌发抑制试验 取培养好的灰葡萄孢菌(紫外处理产孢[14])、禾旋孢腔菌(大于72 h高氏一号平板培养产孢)、禾谷镰孢菌(绿豆汤培养基培养产孢[15])、大斑凸脐蠕孢(大于72 h高氏一号平板培养产孢)的孢子,配成适当浓度的悬浮液(10×10低倍镜下,每视野30~40个孢子为宜),以发酵液∶孢子悬浮液∶孢子萌发培养基RPMI1640=1∶1∶2的体积比混合,每孔200 μL分装入96孔板,以百菌清(50 μg/mL)+高氏一号和ddH2O分别替代发酵液加入培养体系作为对照,每个试验重复3次,分别于0、48、72 h以酶标仪(Multiskan GO,美国Thermo)测定每个处理OD600。计算孢子萌发抑制率,抑制率=(对照吸光度差-处理吸光度差)/对照吸光度差×100%[16]。
1.3 活性放线菌的分子生物学鉴定
采用高盐法提取放线菌总DNA,以细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′) 采用PCR扩增菌株的16S rRNA基因。反应体系为20 μL:10 μLTaqBuffer Mix,正、反向引物各1 μL,1 μL DNA模板,7 μL ddH2O。PCR 扩增条件为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,共31个循环;72 ℃ 10 min。将PCR产物送交华大北京测序技术服务公司完成测序,利用Ezbiocloud在线比对软件(https://www.ezbiocloud.net/)进行序列相似性搜索,利用Clustal X进行序列同源性比对,再用MEGA 5.0软件以最大似然法(Maximum likehood,ML)构建系统发育进化树,初步确定菌株的系统发育地位。
1.4 活性放线菌代谢产物的稳定性测定
将以下方法制备的无菌发酵液按照1.2.2中描述方法进行试验,并计算抑制率。
1.4.1 温度稳定性 取发酵液3 mL放入5 mL的EP管内,分别在-20、4、30、50、70、100、120 ℃下处理30 min, 每个温度重复3次。
1.4.2 酸碱稳定性 将发酵液用1 mol/L HCl和1 mol/L NaOH分别调整pH值至1、2、3、4、5、6、7、8、9、10、11、12、13、14, 静置12 h, 再分别将各发酵液的pH值慢慢调至原发酵液初始值(7.5), 每个pH值重复3次。
1.4.3 蛋白酶稳定性 取发酵液6 mL 放入10 mL的EP管内,分别加入终质量浓度为1.5 g/L的蛋白酶K、胰蛋白酶、胃蛋白酶,在37 ℃下处理60 min, 阳性对照(CK)不添加酶,均重复3次。
1.5 活性放线菌抑菌产物的初步分离与鉴定
挑取纯化的活性菌株单菌落接种至5 mL高氏一号液体培养基中,28 ℃摇菌培养48 h,之后以5%接种量转接至100 mL高氏一号培养基3瓶,以220 r/min继续摇菌72 h。其中2瓶发酵完毕收集菌液并离心,产物为菌饼及发酵上清液,以甲醇和丙酮-水(7∶3)浸泡菌饼过夜,随后分离的甲醇浸泡液和丙酮-水浸泡液分别与相应发酵上清液混合。另一瓶调节pH值至10,以200 mL乙酸乙酯抽提2遍。分别减压蒸馏以清除甲醇、丙酮、乙酸乙酯和水,得到的提取产物以1 mL甲醇溶解,过0.22 μm滤膜后,以安捷伦1290 Infinity Ⅱ+6460 Triple Quad LC/MS液相色谱质谱联用仪检测。
2 结果与分析
2.1 活性放线菌的筛选
采用平板对峙法对44株土壤放线菌进行抑菌活性初筛,获得13株有抑菌活性的放线菌,占所分离放线菌总数的29.5%。其中,SA32、SA33、SA35、SA37、SA38、SA39、SA47、SA49、SA51这9株放线菌对多种病原真菌均有抑制作用,而SA36、SA42、SA45、SA46只对1种真菌有抑制作用,但抑制率明显较前9种高(数据未展示)。挑选抑菌活性较高的SA32、SA33、SA37、SA39、SA45、SA51等6株放线菌和5株被抑制的病原真菌做进一步的无菌发酵液抑菌试验。
从表1可以看出,除SA45和SA51外其他4株放线菌均对灰葡萄孢菌、禾旋孢腔菌、禾谷镰孢菌、核盘菌和大斑凸脐蠕孢有非常好的抑制作用。其中SA37的抑菌作用最好,对5种病原菌的抑制率均在70%以上,其对灰葡萄孢菌的抑制率为75.13%。SA45虽只有单一活性,但是对灰葡萄孢菌的抑制率高达79.27%。
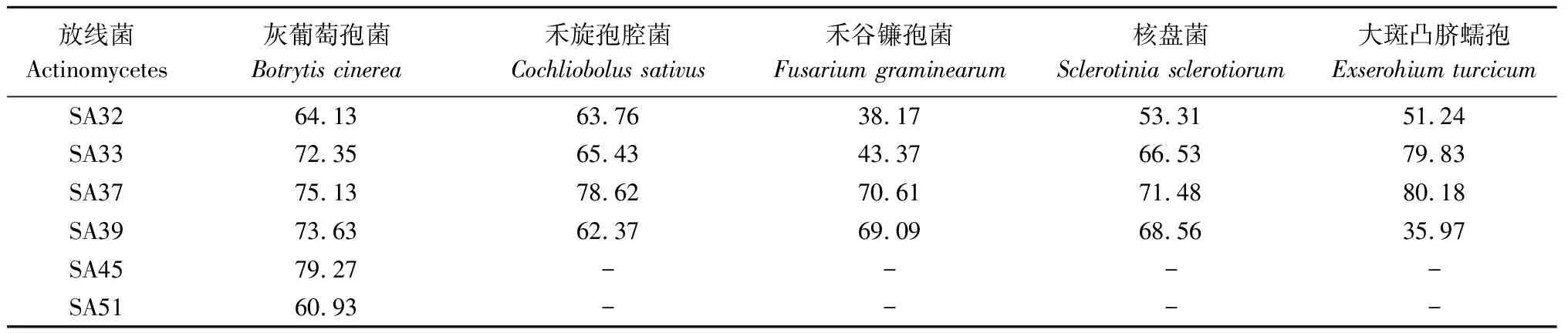
表1 放线菌无菌发酵液对病原真菌的抑制率
2.2 活性放线菌对病原真菌孢子萌发的抑制作用
采用96孔板法测定SA32、SA33、SA37、SA39、SA45、SA51等6株放线菌发酵液对灰葡萄孢菌、禾旋孢腔菌、禾谷镰孢菌和大斑凸脐蠕孢菌孢子萌发的抑制作用。因核盘菌的萌发和繁殖方式以菌核为主,孢子生长存在芽管限制等问题[17],因此未研究对其孢子萌发的抑制作用。
从表2可以看出,所测试的6株放线菌对灰葡萄孢菌的孢子萌发均有一定的抑制作用。其中,SA33、SA37、SA39、SA45菌株的发酵液对灰葡萄孢菌孢子萌发的抑制率高于百菌清。SA37在72 h对灰葡萄孢菌、禾旋孢腔菌和禾谷镰孢菌的孢子萌发均有一定的抑制效果,其中对灰葡萄孢菌孢子萌发的抑制率为86.25%。而SA45在48 h和72 h对灰葡萄孢菌孢子萌发的抑制率高达70.03%和93.43%。
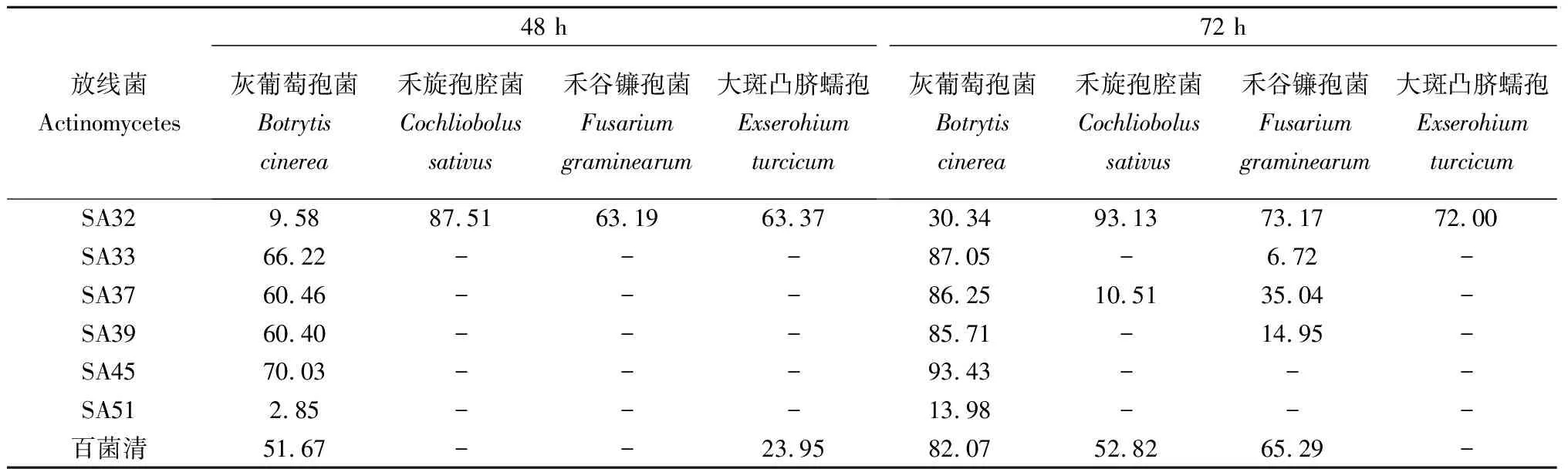
表2 6株放线菌对病原真菌孢子萌发的抑制率
2.3 活性放线菌的分子生物学鉴定
测定6株生防放线菌的16S rRNA基因序列,并构建系统发育树,结果如图1所示。SA32、SA33、SA37、SA39、SA51 五株菌在进化关系上较为接近,均聚类于链霉菌属(Streptomyces)。SA32、SA33与娄彻链霉菌(Streptomycesrochei)的16S rRNA基因序列同源性最高,分别为99.2%和98.81%,SA37和SA39与淡紫褐链霉菌(Streptomycesenissocaesilis)的16S rRNA基因序列同源性最高,均为100%,SA51与亲和素链霉菌(Streptomycesavidinii)的16S rRNA基因序列同源性最高,为99.93%。而SA45较为特别,聚类于北里孢菌属(Kitasatospora),其16S rRNA基因序列与Kitasatosporaphosalacinea同源性最高,为99.35%,属于稀有放线菌类群。将16S rRNA基因序列提交至GenBank,注册号分别为SA32 MH725558、SA33 MG847143、SA37 MG847153、SA39 MG847154、SA45 MG847155、SA51 MG847156。
2.4 活性放线菌代谢产物的稳定性
2.4.1 温度稳定性 由图2可知,在4 ℃、30 ℃及50 ℃,SA37、SA45发酵液的抑菌活性最高。随着处理温度的进一步升高,发酵液的抑菌活性下降。当温度达到70~120 ℃时,2株放线菌发酵液的抑菌活性严重丧失。在-20 ℃的低温中,菌株发酵液的抑菌活性稍有降低。结果表明,SA37、SA45发酵液抑菌活性在中低温具有良好的稳定性。
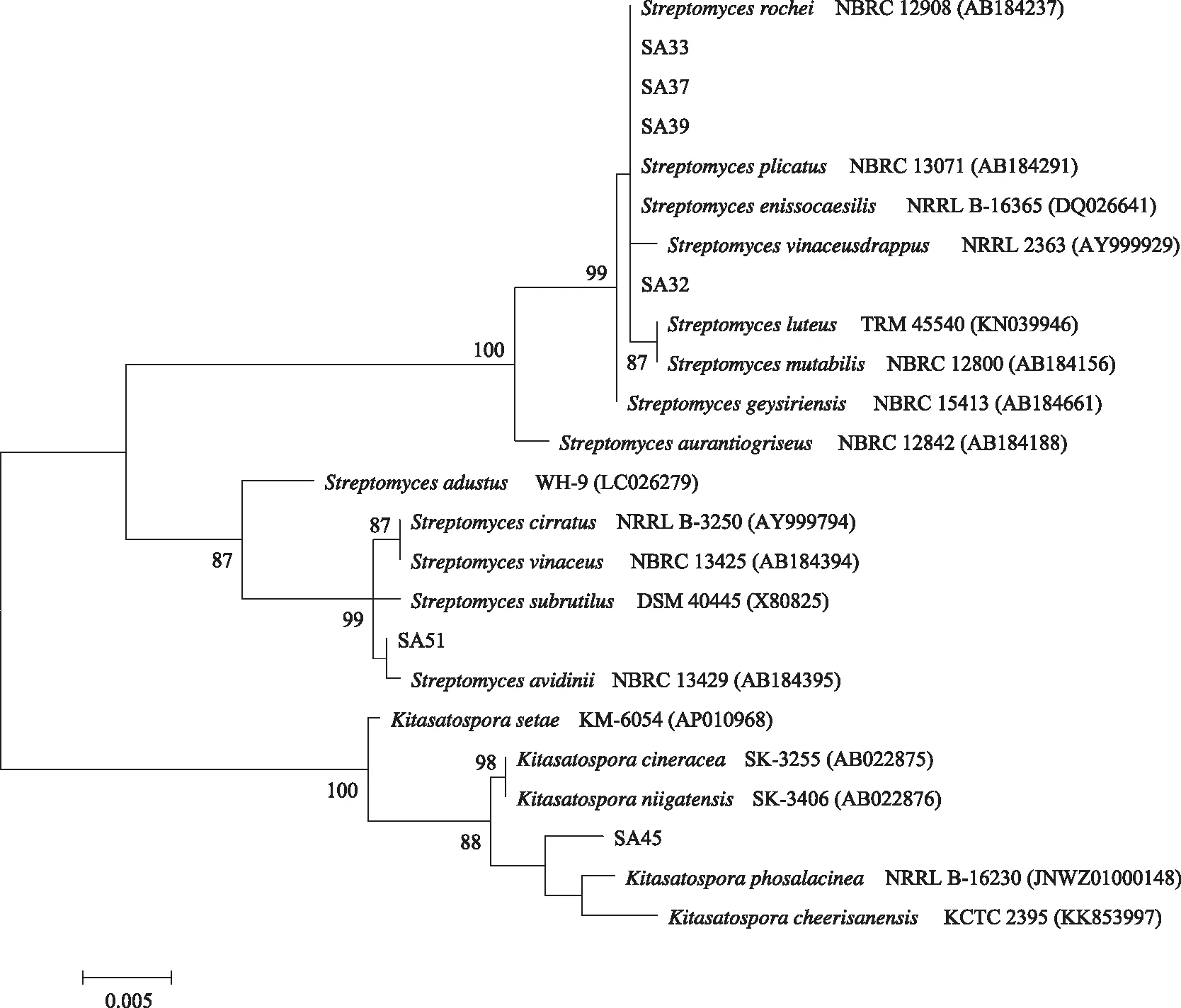
泊松校验1 200次,>70%的值在分支节点处标出
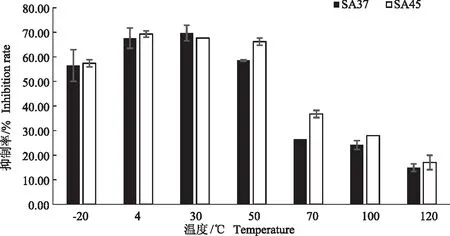
图2 温度对无菌发酵液抑菌活性的影响Fig.2 Effect of temperature on the antimicrobial activity of axenic fermentation broth
2.4.2 酸碱稳定性 由图3可知,菌株SA37、SA45发酵液在pH值7~9的中性环境中抑菌活性保持正常,在酸性环境和碱性环境下均不稳定,但SA45抑菌活性始终高于SA37,且相对于SA37在强酸强碱条件下低于10%的抑制活性,SA45在pH值为1和14时的活性能保持在20%~30%,说明SA45在酸碱条件下的稳定性相对较高。为了分离有效化合物,在后续试验中应保持中性pH值范围。
2.4.3 蛋白酶稳定性 由图4可知,采用蛋白酶K、胰蛋白酶和胃蛋白酶处理后,菌株SA37抑菌活性下降了21.7%~30.9%,说明发酵液中可能存在部分蛋白质类抑菌物质,而SA45发酵液抑菌活性并无明显变化,说明不存在蛋白质或者肽类抑菌物质。
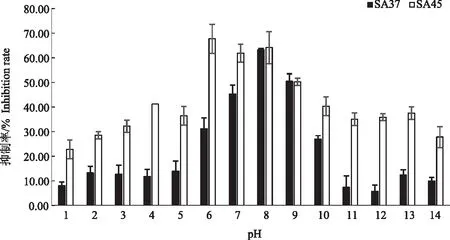
图3 pH值对无菌发酵液抑菌活性的影响Fig.3 Effect of pH on the antimicrobial activity of axenic fermentation broth
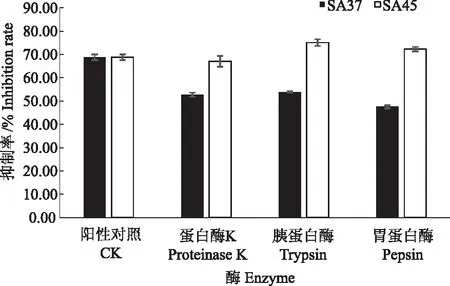
图4 蛋白酶对无菌发酵液抑菌活性的影响Fig.4 Effect of proteases on the antimicrobial activity of axenic fermentation broth
2.5 活性放线菌抑菌产物的初步鉴定
因为SA45为稀有放线菌北里孢菌,合成新颖抑菌化合物的概率较高,所以检测了SA45菌株的天然发酵产物,以期发现新型化合物。利用丙酮[18-19]、甲醇及乙酸乙酯[20]作为有机溶剂分别抽提SA45发酵液,浓缩后以高分辨率飞行质谱检测,结果如图5所示。与已知的北里孢菌相比较,发酵液中无相同抑菌活性物质的质谱信息,说明北里孢菌SA45没有合成已知的灰葡萄孢菌抑菌产物。

A.甲醇浸提化合物;B.丙酮-水浸提化合物;C.乙酸乙酯浸提化合物
3 结论与讨论
番茄灰霉病是由灰葡萄孢菌引起的一类重要的农业植物病害,而放线菌是一类有效的农用抗生素来源菌株,筛选新型有效的抗番茄灰霉病菌放线菌及其天然产物是一项具有前景和实际意义的工作。本研究针对多种植物病原菌筛选到6株灰葡萄孢菌拮抗放线菌,这6株菌对禾旋孢腔菌、禾谷镰孢菌和大斑凸脐蠕孢菌等也有良好的抑制效果。菌株SA37和SA45发酵液在-20~120 ℃、pH值1~14和3种酶(蛋白酶K、胰蛋白酶和胃蛋白酶)处理条件下的抑菌稳定性试验结果表明,过高或过低的温度和pH值均会对放线菌发酵液的抑菌活性造成不可逆的影响,该结果类似于张孟等[21]对海洋放线菌的研究。
北里孢菌(Kitasatosporasp.)是一类稀有放线菌,是由OMURA等[22]在1982年建立的属。自发现并建立北里孢菌属以来,研究者从该属菌株中分离到了种类丰富的天然产物。该类菌最初多被作为生防活性菌株进行分离,分离的菌株及其合成的次生代谢产物均具有优良的生防活性[18,23]。王云等[24]从腐木及枯枝落叶样品中分离到1株对林业害虫松材线虫杀灭活性较高的北里孢菌C620,并初步鉴定其活性化合物为1-苯基-3-(2-吡啶)-5-吡唑啉酮。MOMOSE等[25]分离得到的蛋白酶抑制剂Tyropeptin甚至具有抗肿瘤活性。从北里孢菌分离的天然产物还包括Kitasatatin 1[26]等缩环肽类和Fuzanins[27]等吡啶类化合物。其中抗真菌活性天然产物以大环内酯类化合物Setamycin[28]与Bafilomycin[29]为主,2种化合物的结构相同或相似于WERNER等[20]在Streptomycesgriseussp.SulphurusTÜ 1922中发现的Bafilomycin系列化合物。另外,北里孢菌属菌株还合成了Cystargin[18]和Kimorexins[19]2类高分子化合物。SA45发酵液粗提物高分辨率质谱分析结果表明,粗提物中并不存在已报道的这几种化合物,意味着SA45中可能存在新型结构的抗真菌次生代谢产物,值得进一步研究。SA45产生的活性物质具有良好的抑菌活性,较为稳定,而且不同于已报道的抑菌化合物,具有潜在的应用和研究价值。
本研究从分离的44株放线菌库中筛选出6株对灰葡萄孢菌具有抑菌效果的放线菌,除SA45和SA51外,其余4株放线菌对多种农业病原菌具有广泛的抑菌谱。番茄灰霉病、小麦根腐病、小麦赤霉病和玉米大斑病均为农业上重要的病害[30-33],平板试验和孢子抑制试验均表明,链霉菌SA32发酵液对灰葡萄孢菌、禾旋孢腔菌、禾谷镰孢菌和大斑凸脐蠕孢菌的菌落、孢子和菌丝生长有优良的抑制效果,72 h时SA32发酵液对禾旋孢腔菌孢子萌发的抑制活性高达93.13%,其优良广谱的生防活性使SA32的发酵液成为潜在的天然产物来源。72 h时SA33、SA37和SA39发酵液对灰葡萄孢菌的抑菌活性虽然低于北里孢菌SA45,但是高于百菌清对照,其代谢产物成分值得进一步研究。
致谢:感谢沈阳农业大学植物保护学院植物病理教研室提供的植物病原菌,感谢沈阳农业大学应用生物科学教研室提供试验及相关仪器设备支持。
