小麦VP基因的克隆、生物信息学分析及功能初探
2019-03-06,,,
,, ,
(河北科技大学 生物科学与工程学院,河北 石家庄 050018)
小麦是世界上重要的粮食作物之一,盐碱、干旱等环境胁迫严重影响其产量[1]。小麦在非生物胁迫条件下会启动一系列相应的耐逆机制来抵御环境胁迫[2-5]。研究小麦逆境胁迫相关基因,对小麦的遗传改良具有重要意义[6]。液泡膜H+转运无机焦磷酸酶(Vacuolar H+-pyrophosphatase,VP)是一种区别于H+-ATPase的H+转运酶,广泛存在于植物、少数藻类、原生动物、细菌以及原始细菌中[7]。在液泡膜上,VP能够把无机焦磷酸水解产生自由能的过程和H+跨膜转运相耦联,在将焦磷酸水解为2个磷酸并释放自由能的同时,帮助细胞质中的H+经液泡膜进入液泡内,与液泡膜H+-ATPase一起形成H+跨液泡膜电化学梯度,为各种溶质(如阳离子、阴离子、氨基酸和糖类等)分子跨液泡膜的次级主动运输提供驱动力[8]。由此促进的Na+在液泡中的区隔化,不仅使细胞避免离子毒害,还有助于细胞的渗透调节。因此,研究VP基因对于深入了解植物抗逆机制具有重要意义。目前,已经从大麦、烟草、水稻等植物中克隆得到VP基因[9-11]。然而关于小麦VP基因的研究报道较少。为此,从耐盐小麦品种德抗961中克隆小麦VP基因,对其进行生物信息学分析,然后构建植物表达载体,转化拟南芥,并对转基因拟南芥的纯合体后代进行耐盐性鉴定,为后续研究小麦VP基因在植物耐盐胁迫中的作用奠定基础。
1 材料和方法
1.1 试验材料
耐盐小麦品种德抗961,由中国科学院遗传与发育生物研究所王道文博士惠赠。拟南芥Columbia 生态型、植物表达载体pCAMBIA1380、大肠杆菌DH5α 菌株及根癌农杆菌GV3101菌株均由河南科技大学生物科学与工程学院生物技术实验室提供。
1.2 试验方法
1.2.1 小麦VP基因的克隆
1.2.1.1 3′-RACE法获得小麦VP基因3′末端序列 将小麦幼苗用Hoagland’s营养液培养到两叶一心期,用150 mmol/L NaCl处理1 h取全植株,按照Trizol试剂盒(北京赛百盛基因技术有限公司)说明书提取小麦总RNA。取1 μg总RNA,按照Promega公司反转录酶M-MLV操作说明书合成cDNA,反转录引物为RACERT:5′-AAGCAGTGGTAACAACGCAGAGTAC(T)30-3′。
根据已报道的大麦、玉米、水稻的VP基因保守区设计简并引物,引物为TVP3RACE-S:5′-GCYGAYCTTGTYGGCAARGTT-3′和TVP3RACE-A:5′-GCAGTGGTAACAACGCAGAGT-3′。以获得的小麦cDNA为模板,使用引物TVP3RACE-S和TVP3RACE-A进行PCR扩增。PCR反应条件为:98 ℃ 30 s;98 ℃ 10 s、50 ℃ 30 s、72 ℃ 80 s,15个循环;98 ℃ 10 s、55 ℃ 30 s、72 ℃ 80 s,20个循环;72 ℃ 10 min。PCR产物回收后测序。
1.2.1.2 5′-RACE法获得小麦VP基因5′末端序列 以小麦cDNA为模板,使用上游外侧特异性引物GSP1:TVP-5-OUT(5′-GCTTCTTCAGAGCAGGTTCA-3′)和5′RACE外侧引物(5′-CATGGCTACATGCTGACAGCCTA-3′)进行第一轮PCR扩增。PCR反应条件为:98 ℃ 30 s;98 ℃ 10 s、55 ℃ 30 s、72 ℃ 1 min,35个循环;72 ℃ 10 min。将第一轮PCR产物进行50倍稀释,再使用上游内侧引物GSP2:TVP-5-IN(5′-GCAAAGAGCGTGGTGAGCAA-3′)和5′RACE内侧引物(5′-CGCGGATCCACAGCCTACTGATGATCAGTCGATG-3′)进行第二轮PCR扩增。PCR反应条件为:98 ℃ 30 s;98 ℃ 10 s、60 ℃ 30 s、72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物回收后测序。
1.2.1.3 小麦VP基因全长序列的获得 对获得的3′和5′端小麦VP基因序列进行分析,利用DNAMAN 5.2.2软件拼接小麦VP基因的全长cDNA序列,然后设计引物扩增VP基因全长cDNA。引物序列为TVPQC-S:5′-CGGGATCCATGGCGATCCTCGGGGAG-3′和TVPQC-A:5′-CCCAAGCTTCTAGATGTACCTGAACAGCACGC-3′。以小麦cDNA为模板,利用SuperStar高保真DNA聚合酶(GenStar公司)进行PCR扩增。PCR反应体系如下:10×反应缓冲液 2.5 μL,10 mmol/L dNTPs 0.5 μL,2.5 U/μLTaq酶 0.3 μL,模板1.0 μL,正、反向引物(10 μmol/L)各0.5 μL,加去离子无菌水至总体积25 μL。PCR反应条件为:98 ℃ 30 s;98 ℃ 10 s、68 ℃ 30 s、72 ℃ 100 s,35个循环;72 ℃ 10 min。PCR产物回收后测序,测序正确后连接到T-EASY载体,得到小麦VP基因克隆。
1.2.2 数据分析 使用ProtParam(http://web.expasy.org/protparam/) 分析小麦VP蛋白理化性质;通过ProtScale 软件,采用默认算法,对小麦VP蛋白进行亲水性/疏水性分析;通过SignalP(http://www.cbs.dtu.dk/services/SignalP/)预测肽链N 端的切割位点,来预测小麦VP蛋白的信号肽;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/) 对小麦VP蛋白进行跨膜结构域分析;通过https://www.genscript.com/wolf-psort.html 在线预测小麦VP蛋白的亚细胞定位;采用SMOPA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl) 对小麦VP蛋白二级结构进行预测;采用SWISS-MODEL(https://www.swissmodel.expasy.org/interactive) 对小麦VP蛋白三级结构进行预测。
1.2.3 小麦VP基因表达载体的构建 PCR扩增pCAMBIA1380的35S启动子,所用的引物为5′-CCGAATTCCCCAACATGGTGGAGC-3′和5′-CGGGATCCGCGAAAGCTCGAGAGAG-3′,扩增出的35S启动子长度为0.8 kb。将该片段用EcoRⅠ和BamHⅠ酶切后插入到pCAMBIA1380载体的EcoR Ⅰ 和BamHⅠ酶切位点之间得到重组载体pCAMBIA1380-35S。将克隆载体T-VP用BamHⅠ和HindⅢ双酶切后,回收VP片段,将其以正向方式插入载体pCAMBIA1380-35S的BamHⅠ和HindⅢ酶切位点之间,得到重组载体pCAMBIA1380-35S-VP。用HindⅢ和BglⅡ切割已经构建的GFP-T载体,将切下的GFP片段连接到pCAMBIA1380-35S-VP上,最终构建成pCAMBIA1380-35S-VP-GFP载体。
1.2.4 转VP基因拟南芥植株VP基因表达分析 将Columbia生态型拟南芥种子春化3 d后消毒铺种,之后放入光照培养箱中培养。2~4片真叶时移栽,待其主薹抽薹至10~15 cm时可作为农杆菌转化的受体材料。将pCAMBIA1380-35S-VP-GFP转化农杆菌菌株GV3101,然后采用浸花法转化拟南芥。待成熟后收获种子,对后代进行纯合体筛选。挑选6个纯合体转基因株系和野生型拟南芥,正常培养。按照Trizol试剂盒(北京赛百盛基因技术有限公司)说明书提取叶片总RNA,取2 μg总RNA,按照Promega公司反转录酶M-MLV操作说明书合成cDNA。以获得的野生型拟南芥和转VP基因拟南芥纯合体植株的cDNA为模板,进行半定量PCR扩增。
以已报道的拟南芥ACTIN基因为内参,设计其PCR扩增引物,正向引物为ACTIN-S:5′-AGGCACCTCTTAACCCTAAAGC-3′,反向引物为ACTIN-A:5′-GGACAACGGAATCTCTCAGC-3′。PCR反应体系如下:10×反应缓冲液 2.5 μL,10 mmol/LdNTPs 0.5 μL,2.5 U/μLTaq酶0.3 μL,模板1.0 μL,正、反向引物(10 μmol/L)各 0.5 μL,加去离子无菌水至总体积25 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。根据扩增结果调节cDNA模板浓度,使野生型拟南芥和转基因拟南芥扩增片段亮度一致。设计小麦VP基因扩增引物,正向引物为BDL-S:5′-GAGCCACAGAATCCGTGAGA-3′,反向引物为BDL-A:5′-CACCAGCCAGAACACCAGA-3′。PCR反应体系如下:10×反应缓冲液 2.5 μL,10 mmol/L dNTPs 0.5 μL,2.5 U/μLTaq酶 0.3 μL,模板 1.0 μL,正、反向引物(10 μmol/L)各0.5 μL,加去离子无菌水至总体积25 μL。PCR反应程序为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,28个循环;72 ℃延伸5 min。
1.2.5 转VP基因拟南芥盐胁迫处理试验 将野生型和经过表达鉴定的6个转VP基因拟南芥纯合体株系(9、14、15、16、20、24)的种子,消毒后播种于含有不同浓度NaCl(125、150、175 mmol/L)的MS培养基上,每皿不少于50粒,3个重复。4 d后统计萌发率,6 d后统计绿苗率。
同时,将在不含NaCl的MS培养基上培养10 d的野生型和经过表达鉴定的6个转VP基因拟南芥纯合体株系(9、14、15、16、20、24)的幼苗移植到装有定量营养土的营养钵中,每个株系3钵,每钵移植4株,在室温下缓苗7 d,用300 mmol/L NaCl 溶液浇灌,温室中继续培养5 d,观察转VP基因拟南芥植株的表型变化。
2 结果与分析
2.1 小麦VP基因的克隆
采用3′-RACE法扩增小麦cDNA,得到约1 800 bp的片段(图1 A),将该产物进行测序,按照测序结果设计引物,然后采用5′-RACE法进行扩增,得到1 053 bp的片段(图1 B)。根据2次扩增测序结果设计引物进行小麦VP基因全长序列扩增,得到的产物为2 286 bp(图1 C)。将PCR扩增产物连接到T-EASY载体,进行菌液PCR鉴定(图1 D)和酶切鉴定(图1 E ),结果表明成功克隆小麦VP基因。
将VP基因编码的氨基酸序列在NCBI数据库进行同源性搜索,结果表明,小麦VP基因编码蛋白质与大麦中2个VP蛋白的氨基酸序列同源性分别达86%(AB032839.1)和98%(D13472.2);与水稻中4个VP蛋白的氨基酸序列同源性分别达85%(D45384.1)、92%(D45384.1)、89%(AB126350.1)和87%(AB126351.1);与小麦已知VP基因编码蛋白质(EU255237.1)的氨基酸序列同源性达85%。因此,推断本研究克隆的小麦VP基因是1个新的未曾报道过的VP基因。对小麦VP基因编码的氨基酸序列进行分析发现,自氨基端第248位至258位为VP的保守区,推测该蛋白质可能具有水解焦磷酸的活性。
2.2 小麦VP蛋白的生物信息学分析
2.2.1 小麦VP蛋白理化性质分析 使用ProtParam分析发现,小麦VP蛋白共有761个氨基酸残基,分子式为C3 618H5 673N885O1 041S36,分子质量为79 379.31 u,理论等电点为5.17,在761 个氨基酸残基中Asp 和Glu 总数为58个,Arg 和Lys 总数为47个,原子总数为11 253个,不稳定系数为24.41,属于稳定蛋白。

A:3′-RACE扩增产物; B:5′-RACE扩增产物; C:VP基因全长序列扩增产物; D:菌液PCR鉴定; E:酶切鉴定。M:Marker; S:小麦样品; S1:VP基因阳性克隆质粒; P:空载体质粒; 1—4:4个不同的克隆
2.2.2 小麦VP蛋白的亲水性/疏水性预测 根据氨基酸分值越低亲水性越强、分值越高疏水性越强的规律,通过ProtScale 软件,采用默认算法,对小麦VP蛋白进行亲水性/疏水性分析。如图2所示,分值介于-0.5~0.5的主要为两性氨基酸,在整条多肽链中,大多数氨基酸分值在0~3,分布均匀。对761个氨基酸进行分析发现,VP蛋白平均亲水性值为0.621,为疏水性蛋白。

图2 小麦VP蛋白亲水性/疏水性分析Fig.2 Analysis of hydrophilicity/hydrophobicity of wheat VP protein
2.2.3 小麦VP 蛋白信号肽、跨膜结构及亚细胞定位预测 本研究通过SignalP预测肽链N 端的切割位点来预测信号肽,因此,该程序只分析整个蛋白质序列的前70 个氨基酸。由图3可知,最大C、Y、S 值分别为0.127、0.160、0.305,由此得知小麦VP蛋白无信号肽。
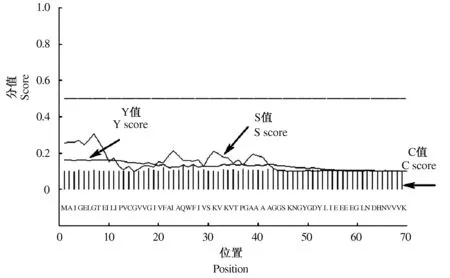
图3 小麦VP 蛋白信号肽分析Fig.3 Signal peptide analysis of wheat VP protein
利用TMHMM (http://www.cbs.dtu.dk/services/TMHMM/) 对VP蛋白跨膜结构进行分析(图4)发现, VP蛋白具有14个跨膜区域,为跨膜蛋白。
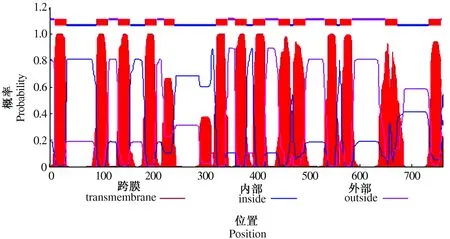
图4 小麦VP蛋白跨膜结构预测Fig.4 Transmembrane structure prediction of wheat VP protein
通过https://www.genscript.com/wolf-psort.html在线预测发现,小麦VP 蛋白在分泌通路中存在的概率为0.48,在质膜上存在的概率为0.36,而在其他位置的概率为0.16。因此,推测该蛋白质为分泌蛋白。
2.2.4 小麦VP蛋白二级、三级结构预测 采用SMOPA对VP蛋白二级结构进行预测(图5)发现,α 螺旋占43.10%,无规则卷曲占23.39%,β折叠占23.39%,β转角占10.12%。
采用SWISS-MODEL预测VP蛋白三级结构(图6)发现,VP蛋白三级结构主要由α 螺旋、无规则卷曲和延伸链等组成,α 螺旋在小麦VP 蛋白结构中占主要地位。
2.3 小麦VP基因表达载体的构建及转基因拟南芥中VP基因的表达分析
小麦VP基因表达载体pCAMBIA1380-35S-VP-GFP结构如图7所示。该载体含有潮霉素抗性基因,小麦VP基因由35S启动子驱动。
由图8可知,小麦VP基因在6个转基因拟南芥纯合体植株中均表达,且在不同株系中表达量略有不同。
2.4 转VP基因拟南芥耐盐性鉴定
2.4.1 萌发率和绿苗率分析 由图9—10可知,随着NaCl浓度增加,各转VP基因株系的萌发率均呈下降趋势。在低浓度NaCl胁迫下,转VP基因拟南芥的萌发率与野生型植株相比并无明显差别,野生型拟南芥的萌发率为84%,而转VP基因拟南芥的萌发率介于84%~92%。随着NaCl胁迫浓度增加,转VP基因拟南芥与野生型拟南芥萌发率的差距增大,NaCl浓度增加到150 mmol/L时,野生型拟南芥的萌发率为68%,所有转VP基因株系的萌发率均高于野生型植株,尤其是转VP基因拟南芥株系9、15、20,其萌发率均超过80%;NaCl浓度增加到175 mmol/L时,野生型拟南芥的萌发率仅为42%,所有转VP基因株系的萌发率均高于野生型植株,其中转VP基因拟南芥株系9、14、15、20差异极显著,尤其是株系9、20,其萌发率均超过60%。

h:α螺旋; e:β折叠; t:β转角; c:无规卷曲
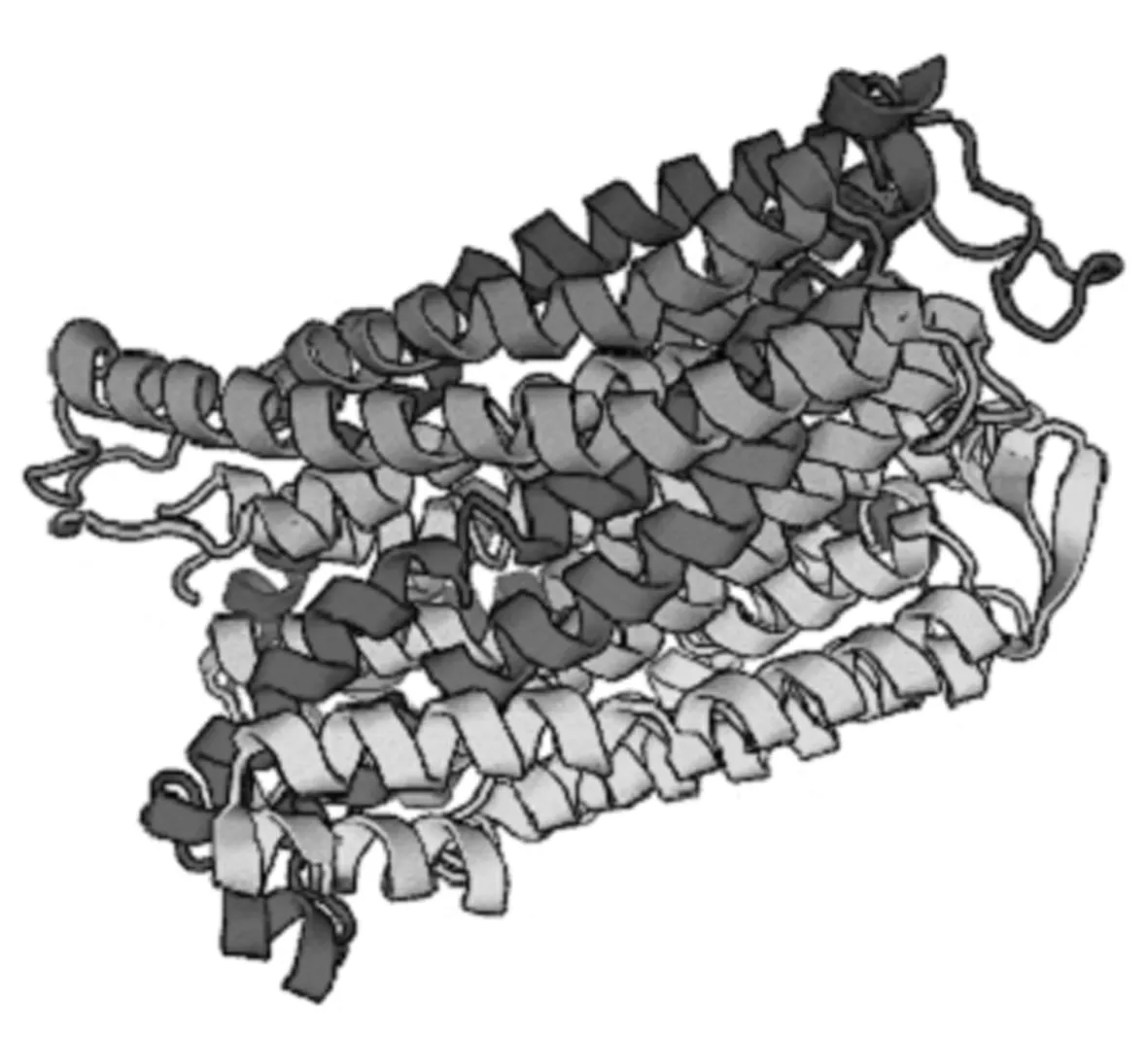
图6 小麦VP 蛋白三级结构预测Fig.6 Tertiary structure prediction of wheat VP protein
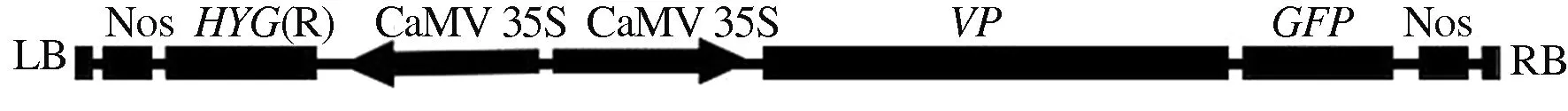
RB和LB分别代表T-DNA区的右边界和左边界,HYG是潮霉素磷酸转移酶基因, CaMV 35S为花椰菜花叶病毒启动子, Nos为根癌农杆菌终止子
RB and LB represent the right and left bounds of the T-DNA region, respectively.HYGis the gene encoding hygromycin phosphotransferase.CaMV 35S is the promoter of cauliflower mosaic virus. Nos is the terminator ofAgrobacteriumtumefaciens
图7pCAMBIA1380-35S-VP-GFP表达载体的构建
Fig.7TheconstructionofpCAMBIA1380-35S-VP-GFPexpressionvector

M为DNA Marker DL2000; 1—6分别为转基因株系9、14、15、16、20、24的扩增结果

A:150 mmol/L NaCl; B:175 mmol/L NaCl。
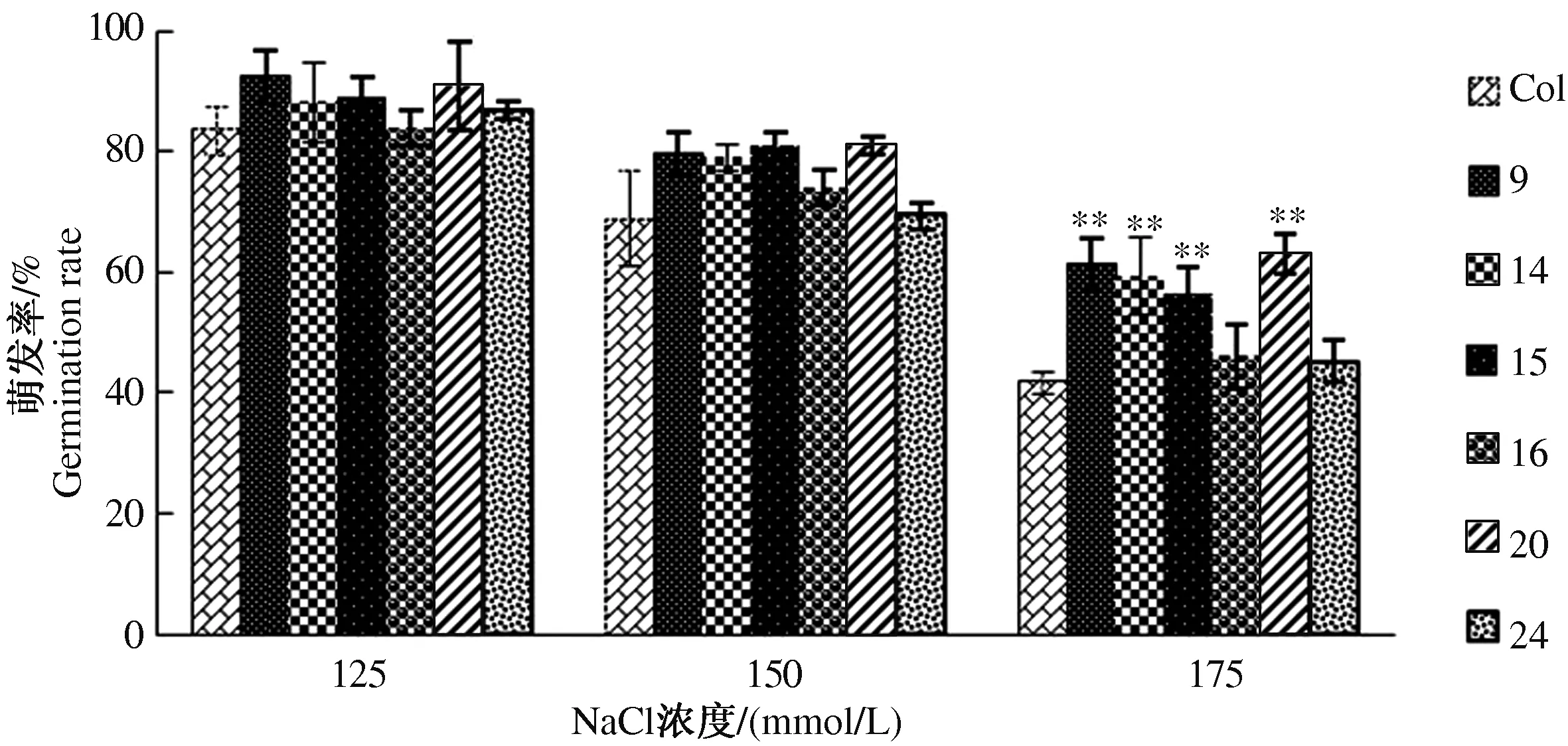
*、**表示转基因植株与野生型植株差异显著(P<0.05)、极显著(P<0.01),下同
由统计结果可以看出,随着NaCl浓度的增加,各株系的绿苗率呈下降趋势(图11)。其中,转VP基因株系20在3个不同浓度的NaCl胁迫下,绿苗率均极显著高于野生型植株;转VP基因株系14、15、16在125、150 mmol/L NaCl胁迫下,绿苗率均极显著高于野生型植株;株系9在150、175 mmol/L NaCl胁迫下,绿苗率均极显著高于野生型植株;株系24在不同浓度的NaCl胁迫下,绿苗率均显著高于野生型植株。说明VP基因的转入提高了拟南芥在NaCl胁迫下的绿苗率。
2.4.2 盆栽表型鉴定 由图12可以看出,野生型拟南芥在NaCl胁迫下生长缓慢甚至停止生长,部分植株死亡,而转VP基因拟南芥对NaCl具有不同程度的抗性,其中14、15、20三个株系对NaCl具有较好的抗性。

图11 不同浓度NaCl胁迫下转VP基因和野生型拟南芥的绿苗率分析Fig.11 Green seedling rate of transgenic Arabidopsis thaliana overexpressing VP and wild Arabidopsis thaliana under different concentrations of NaCl
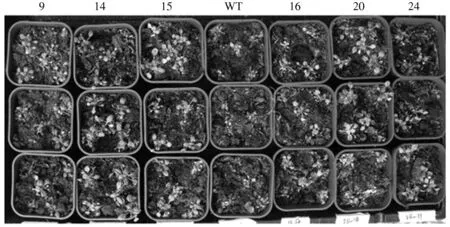
WT为野生型拟南芥,9、14、15、16、20、24为6个转基因株系
3 结论与讨论
大量试验证明,VP基因在提高植物耐盐能力方面具有明显的作用[12-23]。2001年,GAXIOLA等[24]研究表明,拟南芥液泡膜H+转运无机焦磷酸酶基因AVP1具有抗逆作用,过表达AVP1基因拟南芥的耐盐性明显增强。PARK等[25]将拟南芥的AVP1基因转入番茄中,转基因番茄耐盐性增强。之后,研究人员从不同植物中克隆得到VP基因,转化不同植物后发现受体植物的耐盐性均得到了提高[26-33]。本研究结果表明,125、150 mmol/L NaCl胁迫下,转VP基因拟南芥株系的萌发率与野生型拟南芥无显著差异,随着NaCl浓度增加(175 mmol/L NaCl),部分转VP基因拟南芥株系的萌发率极显著高于野生型拟南芥。总体上,在不同浓度NaCl胁迫下,6个转VP基因拟南芥株系的绿苗率均极显著高于野生型拟南芥。盆栽表型鉴定试验表明,野生型拟南芥在NaCl胁迫下生长缓慢甚至停止生长,部分植株死亡,而转VP基因拟南芥对NaCl呈现出不同程度的抗性。由此可见,小麦VP基因提高了转基因拟南芥的耐盐性。VP基因的研究可以加速优质抗逆作物育种的进程,对于深入了解植物抗逆机制具有重要的意义。
