前体物和诱导子对内生真菌CH1产乙基长春胺的影响
2019-03-06任娜刘佳佳杨栋梁徐士杰栾明宝赵娜娜彭樱子吴义强袁光明
任娜,刘佳佳,杨栋梁,徐士杰,栾明宝,赵娜娜,彭樱子,吴义强,袁光明
前体物和诱导子对内生真菌CH1产乙基长春胺的影响
任娜1, 2,刘佳佳1,杨栋梁1,徐士杰1,栾明宝3,赵娜娜1,彭樱子1,吴义强4,袁光明4
(1. 中南大学 化学化工学院,湖南 长沙,410083; 2. 湖南科技职业学院 药学院,湖南 长沙,410118; 3. 中国农业科学院 麻类研究所,湖南 长沙,410205; 4. “木竹资源高效利用”湖南省高校2011协同创新中心,湖南 长沙,410004)
为了提高内生真菌CH1.次级代谢产物乙基长春胺的产量,首先采用单因素试验法考查环氧合酶抑制剂萘普生、羟化酶诱导子过氧化氢、前体物色氨酸、色胺、马钱子苷及裂环马钱子苷对内生真菌CH1产乙基长春胺的影响;在单因素试验的基础上,采用SPSS(统计产品与服务解决方案)19.0设计L18(36)正交试验,进一步优化各前体物和诱导子的质量浓度,并在最优条件下进行试验验证。研究结果表明:在内生真菌CH1发酵液中添加前体物和诱导子均对内生真产乙基长春胺有显著影响(显著性概率小于0.05);当萘普生、色氨酸、色胺、马钱子苷和裂环马钱子苷质量浓度分别为8,100,95,105和25 mg/L,过氧化氢质量浓度为20 μg/L时,能有效提高乙基长春胺的产量,在此条件下进行验证试验,乙基长春胺产量可达5.09 mg/L,与不加前体物质相比提高2.63倍。
前体;诱导子;内生真菌;乙基长春胺
长春胺(vincamine)是从小蔓长春花(L.)中分离得到的一种吲哚生物碱。长春胺类生物碱如长春胺、半合成的长春西汀、乙基长春胺等具有增加脑血流、促进脑部氧的利用及保护神经元等多种有益于脑、心血管、血液循环等系统的药理作用[1−3],在临床上常用于治疗脑梗塞后遗症、脑出血后遗症、脑动脉硬化症,已成为治疗老年痴呆的重要药物。随着我国进入老龄化社会,具有治疗老年痴呆功能的长春胺类药物具有巨大市场潜力和社会效益。但由于小蔓长春花中长春胺含量低,长春胺的化学全合成法不具备应用价值;而半合成法所需的马铃果()种子供应不稳定,使得长春胺类生物碱的产量有限,限制了它们的广泛应用[4−6],因此,寻求解决长春胺类药物供应问题的新方法很有必要。1993年,STIERLE等[7]从短叶红豆杉()中分离出1株产紫杉醇内生真菌(),促进了内生真菌合成药物分子和药物先导化合物的研究[8−11]。目前,从内生真菌中筛选产长春胺类生物碱菌株的研究已取得一些进展。YIN等[12]从小蔓长春花的茎、叶片和根中筛选得到1株具有产长春胺类生物碱能力的内生真菌,产率约为0.1 mg/L。杨显志等[13]也进行了关于产长春新碱的长春花内生真菌的研究。REN等[14]从夹竹桃植物的根、茎、叶中分离得到11株内生真菌,经TLC,HPLC和LC-MS分析,发现其中1株内生真菌CH1()的代谢产物中含有长春胺、乙基长春胺、它波宁等多种长春胺类生物碱,其中它波宁和乙基长春胺从内生真菌中获得,这成为获得它波宁和乙基长春胺的新途径。但由于其含量不高,产长春胺类生物碱内生真菌用于工业化生产还需进一步提高产量才能实现。在培养基中添加前体物质是一种提高长春胺类生物碱产量的有效方法[15−17]。MCCOY等[18]通过在长春花细胞培养体系中添加不同的色氨酸衍生物获得了不同于原长春花中生物碱的新型吲哚生物碱。在长春花细胞培养体系中添加色胺、色氨酸,马钱子苷等前体物质,对长春胺类生物碱的合成均有显著影响[17, 19−23]。目前,还没有在长春胺类生物碱内生真菌中生物碱合成前体调控的报道,为此,本文作者根据植物细胞培养体系中长春胺类生物碱合成的生物途径相关报道,采用单因素和SPSS正交试验设计,以乙基长春胺产量为优化目标,探究环氧合酶抑制剂萘普生、羟化酶诱导子过氧化氢、前体物质色胺、色氨酸、马钱子苷、裂环马钱子苷等对实验室分离得到的内生真菌CH1.发酵生产乙基长春胺的影响,以便为进一步研究产乙基长春胺内生真菌的生物合成途径提供参考,同时为工业化大规模生产提供技术基础。
1 试验
1.1 菌株与试剂
试验用菌株为本课题组从夹竹桃科植物中分离得到的产乙基长春胺内生真菌CH1(.)[14],其菌株保存号为CCTCCM 2014676。试验用色氨酸和萘普生为生化试剂、过氧化氢、色胺、马钱子苷、裂环马钱子苷,均为分析纯。
1.2 培养基
固体培养基(potato dextrose agar,PDA):土豆,质量分数为20%(去皮切块,煮沸20 min后,过滤取汁);葡萄糖质量分数为2%;琼脂质量分数为2%。
发酵培养基:土豆,质量分数为20%;葡萄糖、蔗糖、牛肉膏、无水硫酸镁质量分数分别为1%,1%,1%和0.05%;水;pH为7。
1.3 菌株发酵培养及代谢产物的提取
将实验室保存的内生真菌菌种CH1接种到PDA培养基上,于27 ℃条件下活化3 d,然后接种到装有100 mL发酵培养基的250 mL锥形瓶中,于温度为 27 ℃、转速为170 r/min条件下培养3 d后,移至洁净工作台上,根据实验需求往其中添加相关的前体物质(孔径为0.22 μm的微孔滤膜过滤),再置于27 ℃恒温培养箱中静置培养4~5 d。待发酵完成后,采用4层纱布将发酵液和菌丝体分离。将菌丝体置于60 ℃干燥后捣碎,用10倍体积的二氯甲烷浸泡过夜、抽滤,收集二氯甲烷,反复进行3次。将发酵液于旋转蒸发仪(温度为45 ℃)减压浓缩至约100 mL,用等体积的二氯甲烷重复萃取3次,合并所有二氯甲烷,并在旋转蒸发仪上于30 ℃时减压浓缩至体积为10 mL,用直径为0.22 μm的微孔滤膜过滤除菌,置于温度为4 ℃的冰箱保存,备用。
1.4 乙基长春胺含量测定
采用高效液相色谱(high performance liquid chromatography,HPLC)法进行测定。色谱条件如下:色谱柱为C18柱(4.6 mm×250 mm,5 μm);流动相为乙腈、水(两者体积比为2:1);流速为1 mL/min;检测波长为240 nm;柱温为室温;进样量为20 μL;以实验室自制乙基长春胺为对照品。
1.5 试验设计
为了提高乙基长春胺的含量,首先采用单因素试验法考查不同配比的环氧合酶抑制剂萘普生(4,6,8,10和12 mg/L)、前体物质(色氨酸(40,60,80,100和120 mg/L)、色胺(40,60,80,100和120 mg/L)、马钱子苷(40,60,80,100和120 mg/L)、裂环马钱子苷(10,20,30,40和50 mg/L))和羟化酶诱导子过氧化氢(10,15,20,25和30 μg/L)对内生真菌CH1产乙基长春胺的影响。在单因素试验的基础上,采用SPSS 19.0设计L18(36)正交试验进一步优化前体物质及诱导子。
1.6 数据分析
结果采用SPSS 19.0 进行数据统计和分析,作图软件为Origin 7.5。
2 结果与讨论
2.1 环氧合酶抑制剂萘普生质量浓度对乙基长春胺产量的影响
图1所示为萘普生质量浓度对内生真菌CH1产乙基长春胺产量的影响。由图1可知:较低质量浓度的萘普生能快速促进乙基长春胺的累积;随着萘普生质量浓度增大,乙基长春胺的产量也随之提高,当萘普生质量浓度达到8 mg/L以后,乙基长春胺含量又逐渐趋于稳定,这可能与内生真菌体内环氧合酶的活性有关。在长春胺类生物碱的合成途径中,环氧合酶为蛇根碱生物合成途径中的关键酶,而萘普生为环氧合酶抑制剂,可特异性阻断蛇根碱的生物合成路径,使得流向长春胺支路的中间代谢物增多,从而使乙基长春胺的合成能力增强。VERMA等[17]发现萘普生的加入可促进长春胺类生物碱的合成,这与本试验结果基本一致。

图1 环氧合酶抑制剂萘普生质量浓度对内生真菌CH1乙基长春胺产量的影响
2.2 羟化酶诱导子过氧化氢质量浓度对乙基长春胺产量的影响
图2所示为羟化酶诱导子过氧化氢质量浓度对乙基长春胺产量的影响。由图2可知:首先增加过氧化氢质量浓度,乙基长春胺产量也随之增加;而当过氧化氢质量浓度大于20 μg/L时,乙基长春胺产量呈下降趋势,这可能是因为高质量浓度的过氧化氢对内生真菌CH1有毒害作用,从而使其乙基长春胺的产量下降,因此,可以认为乙基长春胺产量在过氧化氢质量浓度为20 μg/L达到最大值。过氧化氢为强氧化剂,可以增强还原型辅酶Ⅱ(NADPH)氧化酶、细胞氧化酶和羟化酶的活性。在长春胺类生物碱生物合成过程中,过氧化氢作为羟化酶诱导子,可以起到抑制长春质碱、使它波宁的合成量增加的作用。它波宁在生物体内将进一步转化为乙基长春胺[17, 20],因此,为了提高羟化酶和过氧化酶的活性,可以通过向发酵液中加入羟化酶诱导子过氧化氢,进而达到提高乙基长春胺产量的目的。
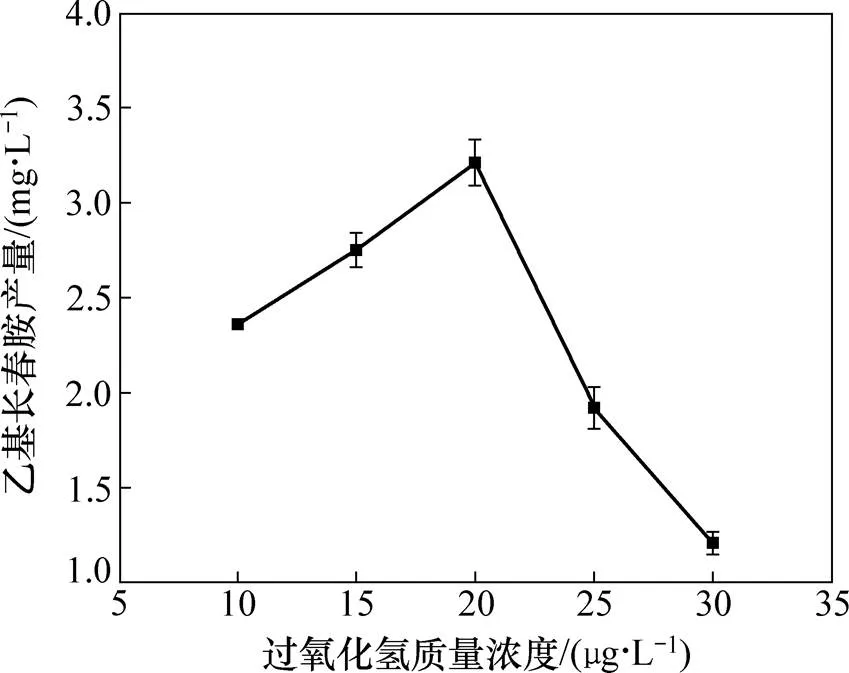
图2 羟化酶诱导子过氧化氢质量浓度对内生真菌CH1乙基长春胺产量的影响
2.3 不同前体物对乙基长春胺产量的影响
图3所示为不同前体物对乙基长春胺产量的影响。由图3可知:当色氨酸、色胺、马钱子苷和裂环马钱子苷的质量浓度分别低于100,100,100和30 mg/L时,随着前体物质量浓度的增大,乙基长春胺的产量也随之提高。当色氨酸、色胺、马钱子苷和裂环马钱子苷的质量浓度分别超过100,100,100和30 mg/L时,乙基长春胺的产量呈下降趋势,这可能是因为前体物过高的质量浓度不利于菌丝体的生长,进而影响次级代谢产物的累积。所以,当前体物质量浓度增加到一定程度时,乙基长春胺的产量呈下降趋势。综上可知:当色胺酸、色胺、马钱子苷、裂环马钱子苷质量浓度分别为100,100,100和30 mg/L时,可获得较高产量的乙基长春胺。马钱子苷为非甲羟戊酸途径(MEP)途径的中间产物,裂环马钱子苷为MEP途径的终产物,色胺和色氨酸为莽草酸途径的中间产物,色氨酸在色氨酸脱羧酶(TDC)的作用下脱羧产生色胺。长春胺类生物碱的生物合成途径起始于裂环马钱子苷与色胺缩合形成的异胡豆苷[19, 23],因此,这4种物质均相当于长春胺类生物碱生物合成的前体物质。添加适当质量浓度的该类前体,可提高乙基长春胺的产量。
2.4 正交试验设计及结果
为了考查各因素之间的关系,进一步优化各前体物及诱导子对内生真菌CH1产乙基长春胺的影响,应用SPSS 19.0软件,设计萘普生、色氨酸、色胺、马钱子苷、裂环马钱子苷、过氧化氢这6种因素的3水平正交试验L18(36)。表1所示为正交试验结果及极差分析结果,根据极差分析法原理可知,极差越大,对乙基长春胺产量的影响程度越大。因此,由表1中判断6个因素对乙基长春胺产量的影响程度从大至小依次为过氧化氢、裂环马钱子苷、色胺、萘普生、马钱子苷和色氨酸。表2所示为正交试验方差分析结果。由表2可知,萘普生、色氨酸、色胺、马钱子苷、裂环马钱子苷、过氧化氢的分别为0.004,0.030,0.002,0.014,1.173×10−5和3.941×10−8,表明各前体物及诱导子对内生真菌CH1发酵产乙基长春胺的影响均显著(显著性概率<0.05),其中以过氧化氢的影响最为显著,萘普生次之。综合表1和表2中结果确定适合内生真菌CH1产乙基长春胺的最佳前体物及诱导子组合的质量浓度为:萘普生8 mg/L,色氨酸100 mg/L,色胺95 mg/L,马钱子苷105 mg/L,裂环马钱子苷25 mg/L,过氧化氢20 μg/L。可以推断内生真菌CH1产长春胺类生物碱的前体物质与长春花植物细胞中的前体物质非常相似[17, 20]。在该试验中,研究了1种羟化酶诱导子、1种环氧合酶抑制剂和4种前体物质对菌株CH1产乙基长春胺的影响,结果表明其产量有一定程度提高,但仍不能用于工业大规模生产,需对其进行进一步研究,如对内生真菌CH1菌株进行诱变育种和原生质体融合研究,以筛选出遗传稳定的高产菌株;研究内生真菌CH1中乙基长春胺的生物合成途径,通过其生物合成途径,选择有效的前体物及诱导子等,以提高乙基长春胺产量。
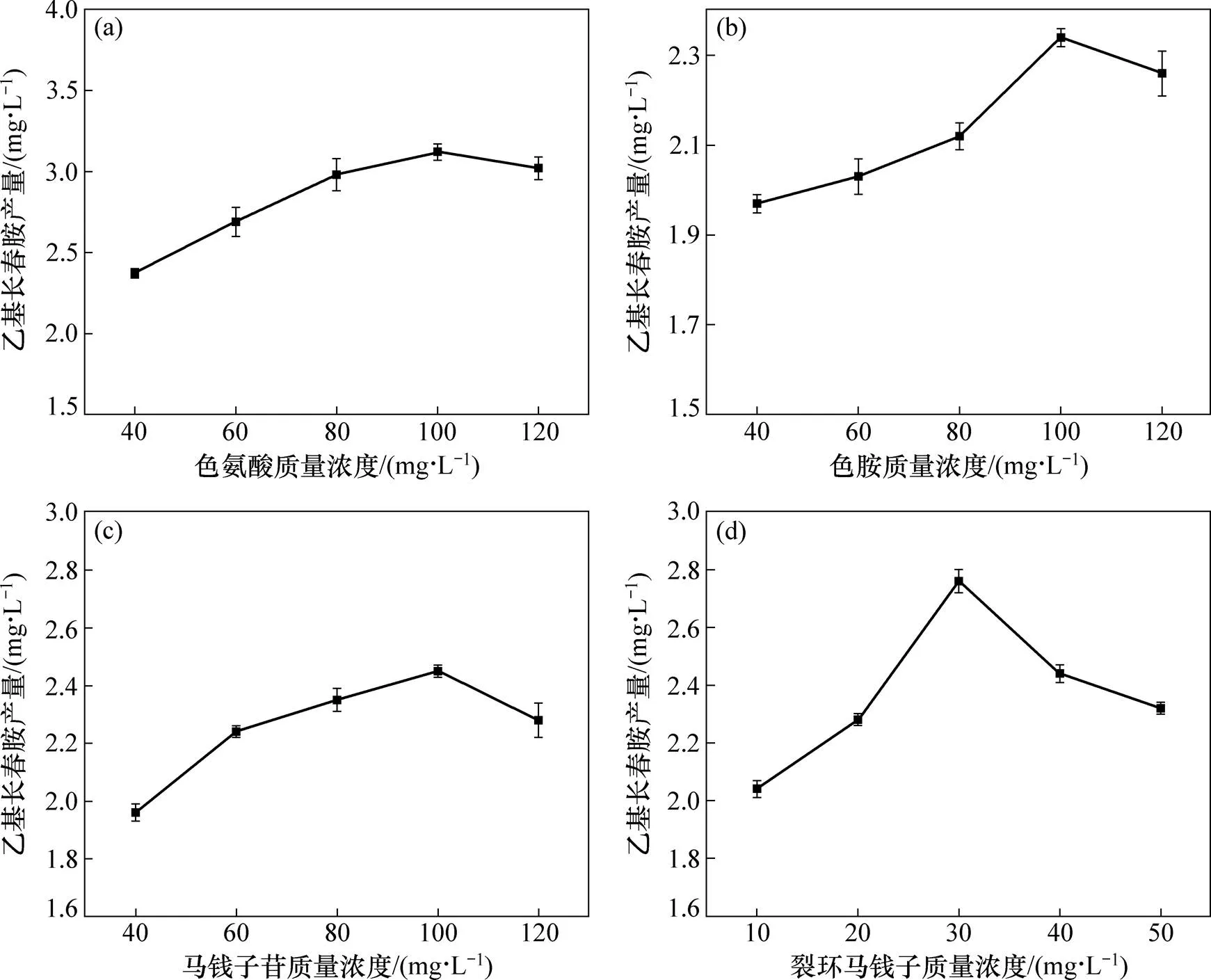
(a) 色氨酸;(b) 色胺;(c) 马钱子苷;(d) 裂环马钱子苷
注:1,2和3分别代表每个因素不同水平下的乙基长春胺产量的平均值;为极差。
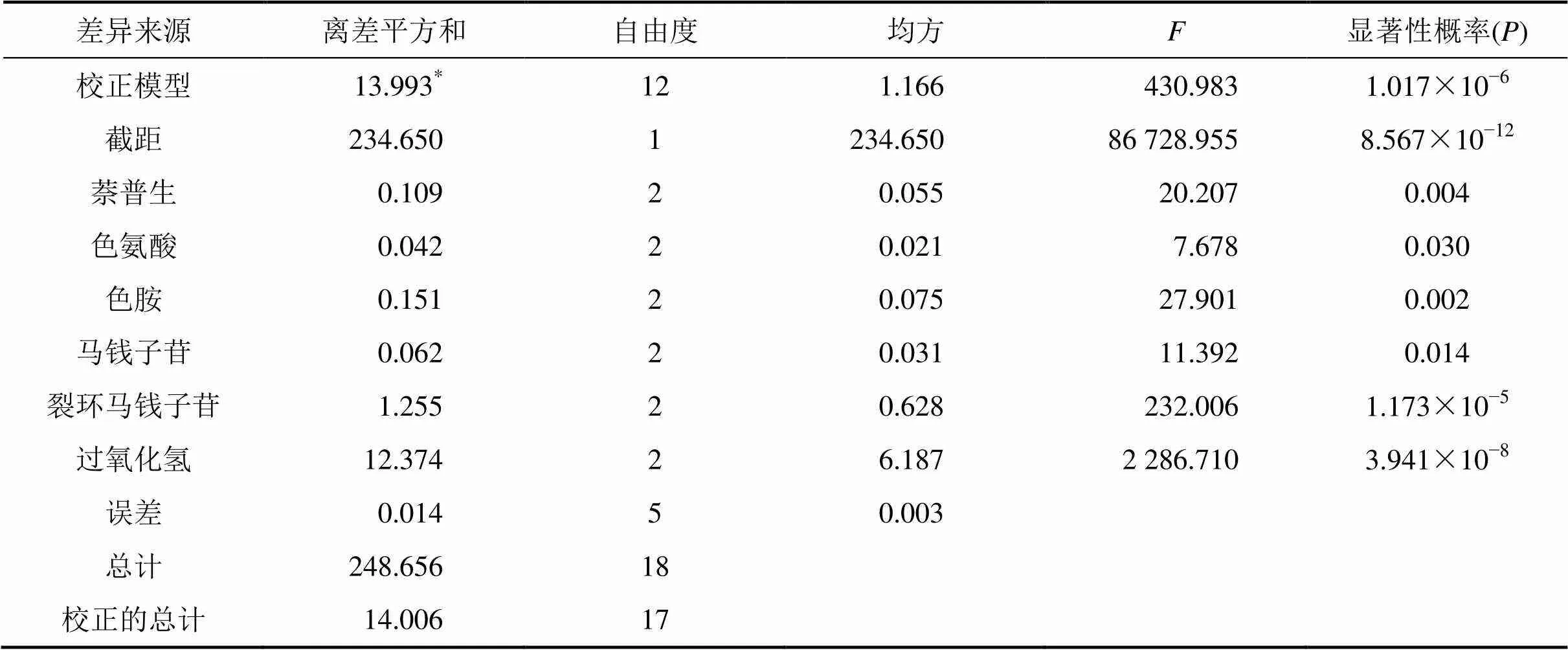
表2 正交试验方差分析
*:2为判定系数,2=0.999(调整2=0.997);为各因素均方与随机误差均方的比值。
2.5 验证试验
在优化后的条件下,对内生真菌CH1进行发酵培养,其代谢产物中乙基长春胺的产量为5.090 mg/L,与不添加前体物时乙基长春胺产量(1.932 mg/L)[14]相比提高了2.63倍,表明优化后的前体物质及诱导子对内生真菌CH1中乙基长春胺的生物合成有促进作用。
3 结论
1) 在内生真菌CH1sp.发酵液中添加前体物和诱导子,有利于提高乙基长春胺的产量。
2) 在单因素试验的基础上进行SPSS L18(36)正交试验设计,当环氧酶抑制剂萘普生、前体物质色氨酸、色胺、马钱子苷和裂环马钱子苷质量浓度分别为8,100,95,105和25 mg/L、诱导子过氧化氢质量浓度为20 μg/L时,可得到最大乙基长春胺产量5.12 mg/L,在此条件下进行验证试验,得到乙基长春胺产量为5.09 mg/L,较不加前体物和诱导子时提高2.63倍,乙基长春胺产量显著提高。因此,寻找对内生真菌合成乙基长春胺具有重要影响的前体物质,对提高菌株CH1产乙基产春胺的能力具有重要意义,同时可为后续的发酵工艺研究提供参考。
[1] BAGOLY E, FEHÉR G, SZAPÁRY L. The role of vinpocetine in the treatment of cerebrovascular diseases based in human studies[J]. Orvosi Hetilap, 2007, 148(29): 1353−1358.
[2] SABRY S M, BELAL T S, BARARY M H, et al. A validated HPLC method for the simultaneous determination of vincamine and its potential degradant (metabolite), vincaminic acid:applications to pharmaceutical formulations and pharmacokinetic studies[J]. J Food Drug Ana, 2010, 18(6): 447−457.
[3] SAURABH C V, KISHOR N G. Vinpocetine:hype,hope and hurdles towards neuroprotection[J]. Asian J Pharm Res Dev, 2013, 1(4): 17−23.
[4] ALVES J C F, SIMAS A B C, COSTA P R R. Formal enantioselective synthesis of (+)-vincamine. The first enantioselective route to (+)-3, 14-epivincamine and its enantiomer[J]. Tetrahedron: Asymmetry, 1999, 10(2): 297−306.
[5] NEMES A, SZANTAY C J, CZIBULA L, et al. Synthesis of 18-hydroxyvincamines and epoxy-1,14-secovincamine: A new proof for the aspidospermane-eburnane rearrangement[J]. Heterocycles, 2007, 71(11): 2347−2362.
[6] ELES J, KALAUS G, LEVAI A, et al. Synthesis of vinca alkaloids and related compounds 98. oxidation with dimethyldioxirane of compounds containing the aspidospermane and quebrachamine ring system: a simple synthesis of (7S, 20S)-(+)-rhazidigenine and (2R, 7S, 20S)-(+)-rhazidine[J]. Journal of Heterocyclic Chemistry, 2002, 39(4): 767−771.
[7] STIERLE A, STROBLE G, STIERLE D. Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of Pacific yew[J]. Science, 1993, 260(5105): 214−216.
[8] 陈建华, 刘佳佳, 臧巩固, 等. 紫杉醇产生菌的筛选与发酵条件的调控[J]. 中南大学学报(自然科学版), 2004, 35(1): 65−69.CHEN Jianhua, LIU Jiajia, ZANG Gonggu, et al. Screening of taxol-producing endophytic fungi and regulation of fermentation conditions[J]. Journal of Central South University(Science and Technology), 2004, 35(1): 65−69.
[9] REN Na, LIU Jiajia, YANG Dongliang, et al. Sequence-related amplified polymorphism(SRAP) maker as a new method for identification of endophytic fungi from Taxus[J]. World Journal of Microbiology and Biotechnology, 2012, 28(1): 215−221.
[10] GARYALI S, KUMAR A, REDDY M S. Taxol production by an endophytic fungus, Fusarium redolens, isolated from Himalayan Yew[J]. J Microbiol Biotechnol, 2013, 23(10): 1372−1380.
[11] KUMAR V, RAI S, GAUR P, et al. Endophytic Fungi: Novel Sources of anticancer molecules[C]//VERMA V, GANGE A, eds. Advances in Endophytic Research. New Delhi: Springer, 2014: 389−422.
[12] YIN Hong, SUN Yuhong. Vincamine-producing endophytic fungus isolated from Vinca minor[J]. Phytomedicine, 2011, 18(8): 802−805.
[13] 杨显志, 张玲琪, 郭波, 等. 一株产长春新碱内生真菌的初步研究[J]. 中草药, 2004, 35(1): 79−81.et al[J]2004, 35(1): 79−81.
[14] REN Na, LIU Jiajia, YANG Dongliang, et al. Indentification of vincamine indole alkaloids producing endophyticfungi isolated from Nerium indicum, Apocynaceae[J]. Microbiological Research, 2016, 192: 114−121.
[15] 苟莉, 唐春强, 杨淑慎. 前体及诱导子和发酵条件对烟曲霉TMS-26产紫杉醇发酵体系优化[J]. 菌物学报, 2015, 34(6): 1165−1175. GOU Li, TANG Chunqiang, YANG Shushen. Optimization of Aspergillus fumigatus TMS-26 taxol production fermentation system by precursors, elicitors and fermentation conditions[J]. Mycosystema, 2015, 34(6): 1165−1175.
[16] 代文亮, 程龙, 陶文沂. 响应面法在紫杉醇产生菌发酵前体优化中的应用[J]. 中国生物工程杂志, 2007, 27(11): 66−72. DAI Wenliang, CHENG Long, TAO Wenyi. Application of response surface methodology in optimization of precursors for taxol production by Fusarium mairei K178[J]. China Biotechnology, 2007, 27(11): 66−72.
[17] VERMA P, KHAN S A, MATHUR A K, et al. Regulation of vincamine biosynthesis and associated growth promoting effects through abiotic elicitation, cyclooxygenase inhibition, and precursor feeding of bioreactor grown Vinca minor hairy roots[J]. Applied Biochemistry and Biotechnology, 2014, 173(3): 663−672.
[18] MCCOY E, O’CONNOR S E. Directed biosynthesis of alkaloid analogs in the medicinal plant Catharanthus roseus[J]. J Am Chem Soc, 2006, 128(44): 14276−14277.
[19] GUO Zhigang, LIU Yun, GONG Meizhen, et al. Regulation of vinblastine biosynthesis in cell suspension cultures of catharanthus roseus[J]. Plant Cell Tiss Organ Cult, 2013, 112(1): 43−54.
[20] 邢世海, 王荃, 潘琪芳, 等. 长春花萜类吲哚生物碱的生物合成途径[J]. 西北植物学报, 2012, 32(9): 1917−1927.XING Shihai, WANG Quan, PAN Qifang, et al. Research progress of terpenoid indole alkaloids (TIAs) biosynthetic pathway of Catharanthus roseus[J]. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(9): 1917−1927.
[21] MOLCHAN O, ROMASHKO S, YURIN V. L-tryptophan decarboxylase activity and tryptamine accumulation in callus cultures of Vinca minor, L[J]. Plant Cell Tissue and Organ Culture, 2012, 108(3): 535−539.
[22] NIVISON-SMITH L, ACOSTA M L, MISRA S, et al. Vinpocetine regulates cation channel permeability of inner retinal neurons in the ischaemic retina[J]. Neurochemistry International, 2014, 66: 1−44.
[23] KUMAR K, KUMAR S R, DWIVEDI V, et al. Precursor feeding studies and molecular characterization of geraniolsynthase establish the limiting role of geraniol in monoterpene indolealkaloid biosynthesis in Catharanthus roseus leaves[J]. Plant Science, 2015, 239: 55−66.
Effects of precursors and elicitors on production of ethyl vincamine by endophytic fungus CH1
REN Na1, 2, LIU Jiajia1, YANG Dongliang1, XU Shijie1, LUAN Mingbao3, ZHAO Nana1, PENG Yinzi1, WU Yiqiang4, YUAN Guangming4
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China; 2. School of Pharmaceutical Sciences, Hunan Vocational College of Science and Technology, Changsha 410118, China; 3. Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha 410205, China; 4. Hunan Collaborative Innovation Center for Effective Utilization of Wood & Bamboo Resources, Changsha 410004, China)
In order to increase the yield of ethyl vincamine produced by endophytic fungus CH1, the effect of cyclooxygenase inhibitor and hydroxylase elicitor along with various precursors for the production of ethyl vincamine were researched. Firstly, the effects of naproxen, tryptophan, tryptamine, loganin, secologanin and hydrogen peroxide on ethyl vincamine production of endophytic fungus CH1 were investigated by single factor experiment. In addition, orthogonal experiment design was used to optimize the concentration by statistical software SPSS(statistical package for the social sciences) 19.0.The results show that the optimum mass concentrations for ethyl vincamine produced by endophytic fungus CH1 are as follows: naproxen 8 mg/L, tryptophan 100 mg/L,tryptamine 95 mg/L,loganin 105 mg/L, secologanin 25 mg/L, hydrogen peroxide 20 μg/L. Under the conditions, the highest ethyl vincamine production is up to 5.09 mg/L, which is 2.63 times higher than that before optimization. The addition of elicitors and precursors in the fermentation medium of endophytic fungus CH1 can significantly increase the production of ethyl vincamine (significance probability is less than 0.05), which lays foundation for the biosynthesis research of ethyl vincamine produced by endophytic fungus CH1.
precursor; elicitor; endophytic fungus; ethyl vincamine
10.11817/j.issn.1672−7207.2019.02.005
Q939.9
A
1672−7207(2019)02−0279−07
2018−06−10;
2018−08−08
国家自然科学基金资助项目(31671744);湖南省高校2011协同创新项目(422190011)(Project(31671744) supported by the National Natural Science Foundation of China; Project(422190011) supported by Collaborative Innovation Center Program for Effective Utilization of Wood & Bamboo Resources of Hunan Province)
刘佳佳,博士,教授,从事天然活性产物开发研究;E-mail:liujj0903@163.net
(编辑 陈灿华)
