Rab26对小细胞肺癌H446细胞增殖和迁移的影响
2019-03-06唐心蔚刘雪萍
陈 伟 李 华 唐心蔚 刘雪萍
支气管肺癌是严重威胁人类健康的常见疾病,在恶性肿瘤中,发病率和死亡率占居首位[1]。目前经过手术和传统的化疗及放疗肺癌仍难以控制,且副作用大,五年生存率仅为15%~20%[2]。小细胞肺癌(small cell lung cancer, SCLC)是肺癌中重要的病理类型,占肺癌的15%~20%,恶性程度较高,虽然其对化疗敏感性较高,但是由于分化差、增殖快且极易发生转移,导致对药物易产生耐药性[3]。因此,寻找新的治疗途径和靶标,是小细胞肺癌治疗的关键。Rab26是Rab家族近年来新发现的成员,主要参与细胞的黏附、运动、分裂和基因转录[4]。既往研究表明,Rab26可以促进肿瘤细胞凋亡,并抑制其迁移[5],在对抗肿瘤的生长发展中有着重要作用,但是在小细胞肺癌中的研究尚无报道。因此,本文以Rab26过表达质粒载体和siRNA序列作用小细胞肺癌H446细胞,观察Rab26对H446细胞增殖及细胞迁移的影响,旨在为小细胞肺癌的防治提供新的治疗靶点。
材料与方法
一、实验材料
Rab26过表达质粒(pDsRed monomer C1载体)和siRNA(序列:GUGUUA- CCCAUGCCUACUATT UAGUAGGCAUGGGUAACACTT,Cy3标记)由生工构建,1649完全培养基、OptiMEM、胰蛋白酶购自HyClone公司(美国),转染试剂购自罗氏公司,RNA提取试剂、RT-PCR试剂盒、质粒提取试剂盒购自北京天根生物技术公司,Rab26、GAPDH抗体购于艾博抗贸易有限公司。
二、实验方法
1. H446细胞的培养: H446细胞置于37 ℃、含5% CO2的1 640培养基(含5%标准胎牛血清)的培养箱中培养。每次实验所需细胞均选择对数生长期的细胞。
2. 细胞转染: 实验分为对照细胞组、Rab26质粒过表达组、Rab26siRNA组。接种H446细胞接种于6孔板了培养1 d(1×105个/孔),显微镜下观察肿瘤细胞生长融合情况,待肿瘤细胞达60%的融合率时进行转染,且在进行细胞转染时先用PBS洗涤6孔板,更换培养基为Opti-MEM,同时分别将质粒、siRNA与转染试剂按照比例稀释(参照说明书),对照组则加入等量稀释液培养液。6 h后更换为完全培养基,置于细胞培养箱中继续培养。
3. 流式细胞仪检测转染效率: 0.25%的胰酶处理转染后的H446细胞,以离心半径8 cm,2 000 r/min 离心10 min,弃上清,PBS洗涤细胞2次,加入300 μl PBS重悬细胞,混匀,待流式细胞仪检测。
4. RT-PCR检测Rab26 mRNA的表达: Trizol提取总RNA,Rab26引物上游: 5′-TCAAGGGCGGCAGCAGGA-3′,下游: 5′-GAGTACGCCCAGCACGAC-3′;GAPDH引物上游: 5′-GCAAATTCCAC GGCACAGTCA-3′,引物下游: 5′-TCACGCCACAGTTTCCCAGAG-3′。按照RT-PCR 试剂盒进行逆转录,其中Rab26 扩增长度为298 bp,GAPDH扩增长度为450 bp,条件参照既往文献[5]。
5. Western blot 检测Rab26蛋白的表达: 提取总蛋白,4 ℃,以离心半径8 cm,12 000 r/min 离心10 min,检测总蛋白浓度,按需要调蛋白浓度,向蛋白液中加入Loading buffer,煮沸8 min变性。配制分离胶、浓缩胶,SDS-PAGE凝胶电泳,80 V 40 min,120 V 1.0 h后,350 mA转膜45 min,将PVDF膜封闭2 h后,加入一抗4 ℃孵育过夜;第二天TBST漂洗至少3次,每次10 min,孵二抗1 h,TBST漂洗后显色。
6. MTT检测H446细胞增殖: H446细胞接种于96孔板内(1×103/孔),加入200 μl培养液,各组设4个复孔,置于培养箱内培养24 h,再进行细胞转染,分别于转染后24 h和48 h后,向每孔加入20 μl MTT溶液(5 mg/ml),再培养4 h后,弃上清液,加入150 μl 二甲基亚砜(DMSO),混匀。490 nm波长下测定细胞生长活力,计算光密度值。细胞生长活力=[实验组光密度值/对照组48 h光密度值]× 100%。
7. 划痕实验检测H446细胞迁移: H446细胞接种于6孔板内(1×105/孔),待细胞在孔内融合率达100%后,用tip头在6孔板中央画直线。并用PBS洗涤1次,继续加入10%FBS的1 640完全培养基,同时显微镜下照相记录0 h位置;24 h后,更换培养基后照相,观察各组肿瘤细胞迁移情况;48 h,重复观察。
常用的混合材有:火山灰、粉煤灰、粒化高炉矿渣、煤矸石、沸石、石灰石、石英岩、炉渣、硅锰渣、硫酸铝渣等。有些材料的内比表面积大,如沸石、硫酸铝渣吸水量大,炉渣、矿渣呈多孔结构,这些材料与外加剂的相容性均较差。
三、统计学方法
使用SPSS 15.0 for windows 和Image-Pro Plus 10.0对数据和图像进行分析,每组别至少重复3次实验,两组间比较采用t检验方法,P<0.05表示差异有统计学意义。
结 果
一、Rab26过表达质粒和siRNA转染H446细胞转染效率
各组转染48 h后,Rab26质粒过表达组转染效率达(76.8±4.3)%;siRNA组转染效率为(79.5±3.57)%,见图1,结果表明转染效率较高,为后续实验提供较好的数据支撑。
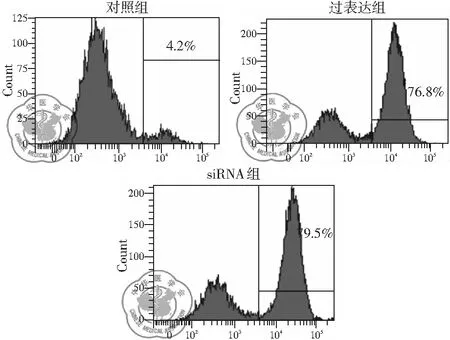
图1 各组转染H446细胞的转染效率
二、Rab26在基因和蛋白水平的改变
转染48 h后,检测每组Rab26在mRNA和蛋白水平的表达情况,发现质粒过表达组Rab26 mRNA和蛋白表达较对照组显著增加(P<0.05),而Rab26 siRNA组在mRNA和蛋白水平表达较对照组表达均显著减少(P<0.05),见图2。结果表明为有效转染,在基因和蛋白水平都发挥效应。
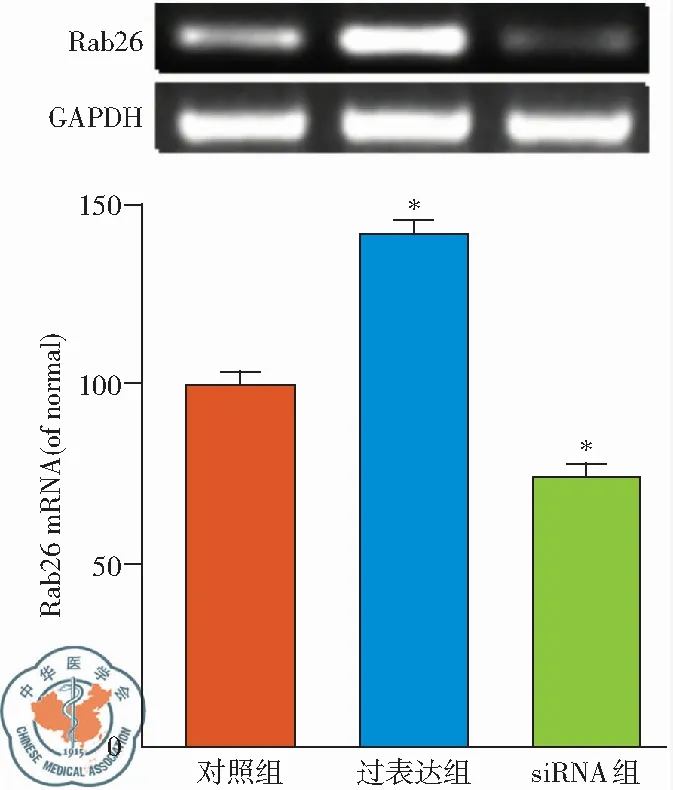
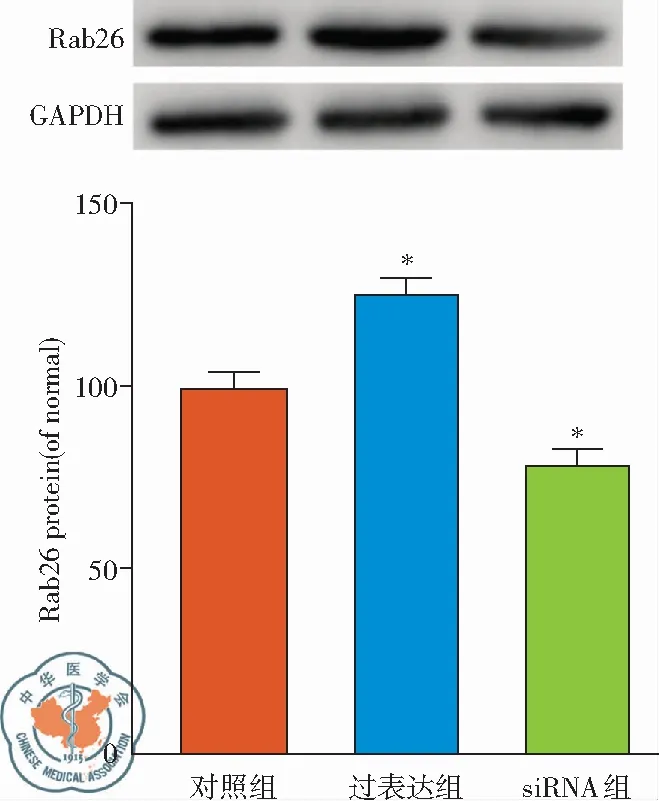
图2 各组间Rab26mRNA和蛋白表达;注: *:P<0.05,与正常组比较
三、Rab26对H446细胞增殖的影响

图3 各组细胞存活率;注:*:P<0.05,与对照24 h比较;#:P<0.05,与对照48 h比较
四、Rab26对H446细胞迁移的影响
划痕实验结果显示对照组、质粒过表达组、siRNA组转染24 h后,迁移速度分别为(0.53±0.03)μm/min、(0.21±0.04)μm/min、(0.61±0.02)μm/min;转染48 h后各组迁移速度分别为(0.32±0.04)μm/min、(0.22±0.04)μm/min、(0.42±0.03)μm/min,在24、48 h时过表达组细胞迁移速度显著低于对照组(P<0.05),siRNA组在24、48 h时迁移速度则显著高于对照组,见图4。
讨论
近年来肺癌的发生呈逐年上升趋势,且呈年轻化,严重影响人们的生活质量。尤其是随着我国经济的快速发展,环境污染导致的雾霾天气在全国各地出现的频率亦越来越高,也引发肺癌的发病率和死亡率日趋增加,约2/3的患者在诊断时发现已出现远处转移。目前小细胞肺癌的治疗手段主要是化疗及放疗,尽管近年来其治疗策略也处于不断探索和发展中,一定程度上提高了小细胞肺癌治疗的缓解率,但是对改善患者的生存期仍是极为有限。据统计,广泛期和局限期小细胞肺癌的5年生存率仅有2%和10%,且局限期患者的中位生存时间仅为18~20个月,广泛期患者的中位生存时间则仅有8~12个月[6-7]。因此,亟待探索新的治疗策略以提高肺癌患者的生存期和生活质量。
研究表明肺癌的发生发展受多因子、多因素、多阶段控制,其中癌细胞的增殖和凋亡失衡,以及早期的转移是癌症发生的重要原因[8],其中增殖和转移为恶性肿瘤的最主要特征。已知肿瘤细胞的增殖能力增强主要由于细胞的增殖失控所致,因此抑制肿瘤细胞的生长和繁殖是控制肿瘤增殖的关键; 而肿瘤迁移的过程主要包括肿瘤细胞的极化以及伪足生成,进而伪足与细胞外基质的黏附,导致细胞体收缩、周期基质和细胞尾端解离,最终引起肿瘤细胞向前运动,同时肿瘤侵袭和转移亦是导致肺癌患者预后不良,5年生存率低的主要原因[9-11]。Rab26属于Ras超家族,首次被发现于小鼠胰腺细胞中,其调控胰腺细胞中溶酶体的释放[12-14]。后期研究又发现其可以通过激活MIST1调节溶酶体的转运,并参与细胞内的囊泡运输,在细胞囊泡内顺式转运中发挥重要作用[15-17]。既往研究表明Rab26除了参与细胞的囊泡运输,介导细胞内受体的转运之外,在细胞的凋亡、自噬、迁移等生命进程也扮演了重要角色[18-22]。

图4 各组细胞迁移情况
本文结果发现Rab26在H446细胞中有表达,且通过转染过表达质粒、siRNA的作用可调控Rab26 在mRNA和蛋白水平的表达变化,提示Rab26可能在肺癌细胞的发展进程中有重要作用。在进一步的实验中发现转染Rab26过表达质粒后H446细胞的增殖减弱,而转染Rab26 siRNA后则促进了H446细胞的增殖,表明Rab26可以抑制H446细胞的增殖;本实验结果还显示Rab26过表达质粒组细胞的迁移也显著受到抑制,Rab26 siRNA组则加速了H446细胞的迁移能力,表明Rab26可有效抑制H446细胞的迁移,提示Rab26在调控H446细胞的增殖和迁移能力中有重要作用,其有望作为小细胞肺癌细胞的一个潜在靶点。
鉴于细胞增殖和转移在肿瘤的发生、发展中的重要作用,因此通过抑制肿瘤细胞的增殖和迁移则成为肿瘤治疗的重要方向。我们的实验证实了Rab26在小细胞肺癌中伴有重要角色,早期的研究表明,Rab家族其他成员与肿瘤的迁移和侵袭有密切关系。目前已发现Rab5参与肺癌的侵袭和转移,可降低肿瘤细胞分化性并促进侵袭转移的能力[23-25];Rab39和Rab21参与肿瘤细胞中胞内定位及内涵体的转运,同时促使肿瘤的侵袭和黏附[26-27];Rab25和Rab8与胃癌细胞的迁移、侵袭密切相关[28-29];Rab11和Rab13参与肿瘤细胞伪足的形成,进而调控肿瘤的转移侵袭[30-31]。可见,除Rab26 以外,其他Rab蛋白在肿瘤的发生发展中也发挥了重要作用,并进一步影响细胞的增殖、分化、凋亡,进而决定细胞的生命进程[32]。因此,结合Rab蛋白的囊泡转运作用,研究Rab蛋白在肿瘤中的作用和机制可为肺癌患者的治疗提供新的思路。
