白藜芦醇诱导小细胞肺癌H446细胞凋亡机制的研究
2019-03-06李王平马李杰金发光
李王平 马李杰 潘 蕾 金发光
白藜芦醇是广泛存在于自然界的一种多酚类化合物,具有很强的生物活性[1-4]。多项研究发现,白藜芦醇对多种恶性肿瘤细胞均有明显的抑制作用,主要机制为抑制蛋白质-酪氨酸激酶的活性、抑制癌细胞增殖,诱导癌细胞分化、凋亡等[5-8]。小细胞肺癌恶性程度高,倍增时间短,转移早而广泛,虽然对化疗、放疗敏感,初治缓解率高,但极易发生继发性耐药,容易复发,截止目前,小细胞肺癌的治疗方法仍以放化疗为主。小细胞肺癌的治疗效果在过去的几十年中没有明显改善,对于小细胞肺癌靶向治疗及免疫治疗的相关研究较为滞后[9-13]。虽然已有一些针对小细胞肺癌靶向治疗的临床实验,但目前尚未有明确的疗效报道,部分患者使用免疫调节剂,但疗效欠佳[14-15]。本文拟探讨白藜芦醇对人小细胞肺癌H446细胞增殖的抑制作用及诱导H446细胞凋亡的作用及可能的机制,旨在为小细胞肺癌化疗治疗提供理论基础。
材料和方法
一、实验材料
人小细胞肺癌H446细胞由第四军医大学唐都医院呼吸内科实验室提供。FBS培养基、RPMI1640培养基、RPMI1640培养基购自美国Hyclone公司,MTT、白藜芦醇购自Sigma 公司,DMSO 购自Invitrogen 公司,胎牛血清、胰蛋白酶购自Gibco公司,AV/PI染料购自碧云天生物技术公司,Annexin V-FITC细胞凋亡检测试剂盒(BD)。主要仪器设备:细胞培养箱(美国热电公司),光学显微镜、倒置拍摄显微镜(蔡司公司),低速离心机(湘仪),酶标检测仪(赛默飞),流式细胞仪(BD),DHE荧光探针(碧云天生物技术公司),JC-10膜电位探针(ab112133)。
二、研究方法
1. 细胞培养: 观察细胞生长情况,进行传代扩增。观察细胞状态良好,细胞生长密度80%~90%,可以进行传代;将培养皿中原有培养液弃去,用PBS洗2次; 加入0.25%的胰酶消化细胞,在显微镜下观察细胞消化情况,待细胞变圆后吸去胰酶; 加入完全培养基终止消化,将细胞吹打为单细胞悬液;将细胞按照一定比例进行分离,加入适量的完全培养液培养,37 ℃,5% CO2培养箱中;每天观察细胞状态,扩增到足够的细胞量后开始实验,一般2 d可传一代。
2. MTT检测
(1)白藜芦醇的细胞毒性观察及实验浓度筛选: 将处于对数生长期时的细胞,以5×104cells/ml密度接种到96孔细胞培养板,每孔150 μl,每个浓度梯度3个复孔,37 ℃,5% CO2培养;将白藜芦醇分别用完全培养基稀释至20 μg/ml,30 μg/ml,40 μg/ml,50 μg/ml,60 μg/ml,70 μg/ml,80 μg/ml,90 μg/ml,100 μg/ml,110 μg/ml和120 μg/ml按照实验分组给药处理,以CK、DMSO作为对照;培养24 h后在每孔加入15 μl的MTT,37 ℃,5% CO2培养箱内避光孵育3~4 h;弃上清,加入200 μl的DMSO,室温摇床震荡10 min;酶标仪492 nm波长测出同一时间点OD值,用测得的OD值进行细胞增殖影响的分析。
(2) 根据前期浓度筛选结果进一步观察白藜芦醇的细胞毒性作用特点: 将处于对数生长期时的细胞,以5×104cells/ml密度接种到96孔细胞培养板,每孔150 μl,每个浓度梯度3个复孔,37 ℃,5% CO2培养;实验分组1:将白藜芦醇分别用完全培养基稀释至20 μg/ml,30 μg/ml,40 μg/ml,给药处理,设空白对照,孵育24 h;实验分组2:将白藜芦醇用完全培养基稀释至30 μg/ml,给药处理,分别培养12 h,24 h和48 h,设空白对照;每孔加入15 μl的MTT,37 ℃,5% CO2培养箱内避光孵育3~4 h;弃上清,加入200 μl的DMSO,室温摇床震荡10 min;酶标仪492 nm波长测出同一时间点OD值,用测得的OD值进行细胞增殖影响的分析。
3. 流式检测细胞凋亡、细胞内ROS及线粒体膜电位: 取对数生长期细胞,以细胞密度为1×105个/ml接种于6孔板中,每孔3 ml,于37 ℃,5% CO2培养箱中培养;实验分组1:将白藜芦醇分别用完全培养基稀释至20 μg/ml,30 μg/ml,40 μg/ml,设空白对照,给药处理24 h;实验分组2:将白藜芦醇用完全培养基稀释至30 μg/ml,给药处理,分别培养12 h,24 h和48 h,设空白对照;实验分组:分别用不含EDTA的胰酶消化收集细胞后,以离心半径8 cm,1 500 r/min离心5 min,然后收集细胞;用预冷的1×PBS(4 ℃)重悬细胞,以离心半径8 cm,1 500 r/min离心5 min,洗涤细胞,然后加入300 μl的1×Binding Buffer悬浮细胞;加入5 μl的Annexin V-FITC并混匀,避光室温孵育15 min。加入10 μl的PI染色,混匀细胞,继续避光孵育10 min;用PBS重悬细胞,上流式细胞仪检测。
4. 流式检测ROS: 取对数生长期细胞,以细胞密度为1×105个/ml接种于6孔板中,每孔3 ml,于37 ℃,5% CO2培养箱中培养;实验分组1:将白藜芦醇分别用完全培养基稀释至20 μg/ml,30 μg/ml,40 μg/ml,设空白对照,给药处理24 h;实验分组2:将白藜芦醇用完全培养基稀释至30 μg/ml,给药处理,分别培养3、6、12、24 h,设空白对照;分别用胰酶消化收集以上各实验组细胞后,以离心半径8 cm,1 500 r/min离心5 min;用PBS清洗细胞,加入DHE荧光染料,37 ℃下避光孵育30 min;PBS重悬细胞后上流式细胞仪进行ROS检测。
5. 流式检测线粒体膜电位: 取对数生长期细胞,以细胞密度为1×105个/ml接种于6孔板中,每孔3 ml,于37 ℃,5% CO2培养箱中培养;实验分组1:将白藜芦醇分别用完全培养基稀释至20 μg/ml,30 μg/ml,40 μg/ml,设空白对照,给药处理24 h;实验分组2:将白藜芦醇用完全培养基稀释至30 μg/ml,给药处理。分别培养3、6、12、24 h,设空白对照;用胰酶消化收集以上各实验组细胞后,以离心半径8 cm,1 500 r/min离心5 min;用PBS清洗细胞,加入JC-10荧光染料,37 ℃避光孵育45 min;PBS重悬细胞后上流式细胞仪进行JC-10检测。
三、统计学方法
结 果
一、白藜芦醇对H446细胞的毒性观察及MTT检测结果
1. 白藜芦醇作用于H446细胞后形态学变化: 白藜芦醇给药后,观察发现不同浓度的白藜芦醇可造成不同比例的细胞死亡,随着药物浓度增加,细胞死亡增多。细胞死亡后,出现细胞圆缩,失去原有形态,细胞不贴壁。在光镜下(100×)可以观察到细胞变得不透亮,失去活性,随着浓度增加,异常细胞明显增多。而对照组细胞形态正常,表现为细胞形态展开,细胞透亮,细胞状态良好,细胞活性高,见图1。
2. MTT检测不同浓度白藜芦醇对H446细胞增殖的抑制作用: MTT检测发现,白藜芦醇从30 μg/ml浓度开始,H446细胞增殖出现明显抑制,40 μg/ml时细胞抑制率迅速上升,且随着给药浓度增加,其抑制率增加,到达一定浓度后其细胞抑制率不再上升,与对照组相比差异均有统计学意义,P<0.01,见图2。
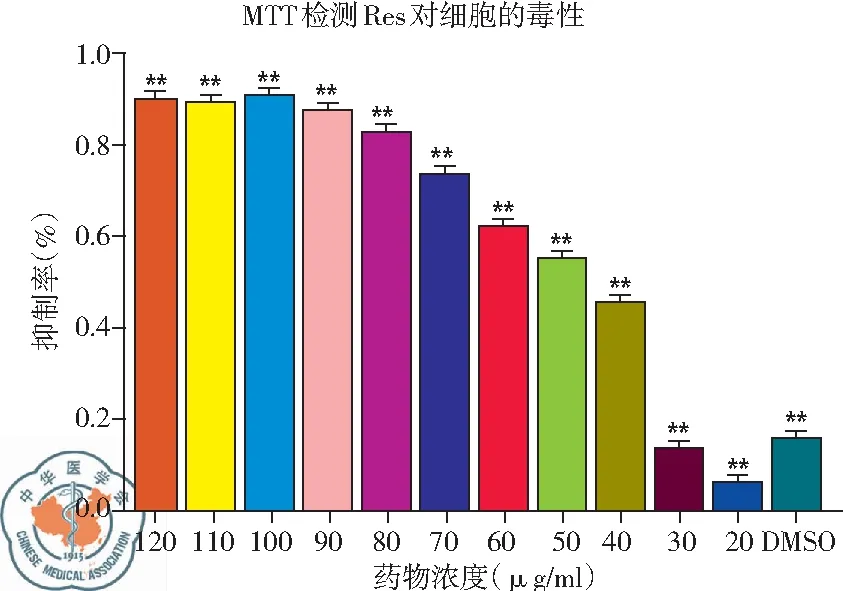
图2 不同浓度白藜芦醇对H446细胞的抑制率
3. 白藜芦醇对H446细胞增殖抑制作用的特点观察
(1)白藜芦醇不同浓度下及作用不同时间后细胞形态变化:从形态学变化可以看出,随着白藜芦醇浓度增加和白藜芦醇作用时间的延长,受损细胞数增多,受损程度变重,光镜下可观察到细胞形态不贴壁,圆缩,透亮度变低,异常细胞数目随着作用浓度和作用时间的增加而增多,见图3、4。
(2)MTT检测白藜芦醇不同浓度下及作用不同时间后对H446细胞增殖的抑制作用: 实验结果表明,与CK相比较,Res在30 μg/ml时开始产生细胞抑制,40 μg/ml时其抑制率显著上升,差异有统计学意义(P<0.01),说明Res的细胞毒性作用有浓度依赖的特点;而作用不同时间细胞抑制率结果显示,随着作用时间的延长,细胞抑制率增加,在作用24 h时产生明显抑制,作用48 h时抑制率接近70 %,差异有统计学意义,P<0.01,说明Res的细胞抑制有时间依赖的特点,见图5。
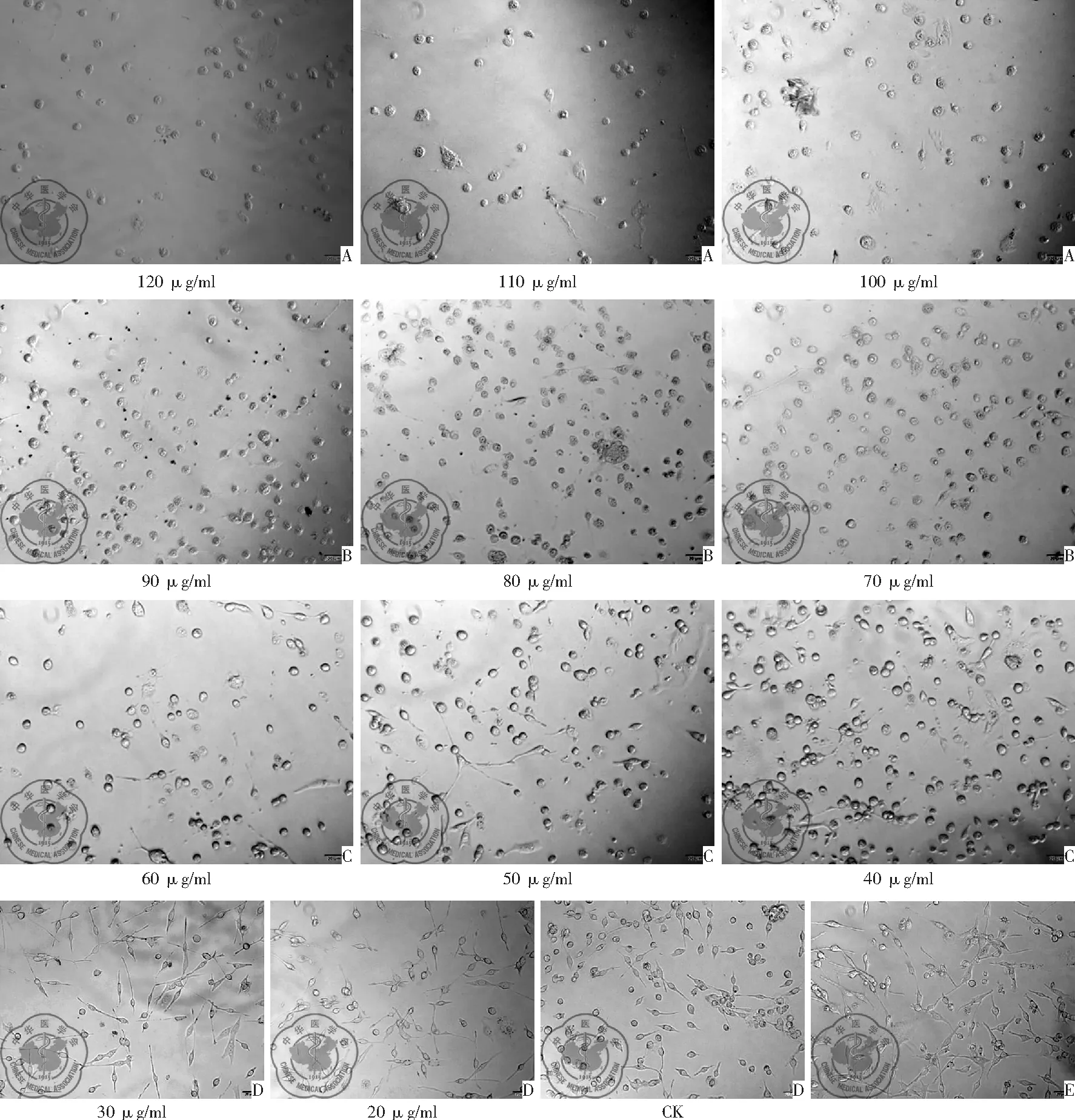
图1 白藜芦醇作用于H446细胞后的形态学变化(100×);注:A:100~120 μg/ml浓度,细胞完全死亡;B:70~90 μg/ml浓度,大部分细胞出现圆缩,失去原有形态,细胞不贴壁;C:40~60 μg/ml浓度,50%以上细胞不透亮,失去活性;D:20~30 μg/ml大部分细胞状态良好,CK组细胞形态展开,透亮,细胞状态良好,活性高;E:DSMO组大部分细胞状态良好

图3 不同浓度白藜芦醇作用时细胞形态变化(100×)
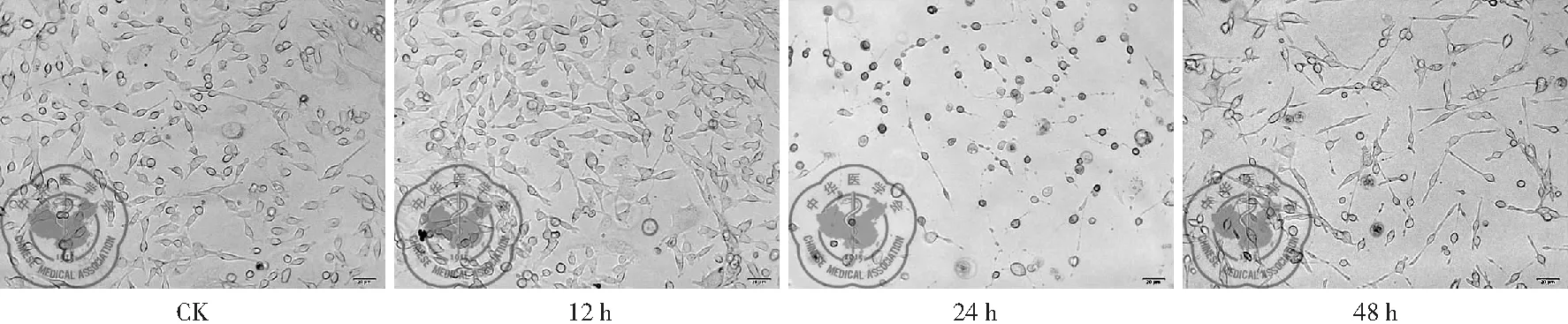
图4 30 μg/ml白藜芦醇作用不同时间后细胞形态变化(100×)
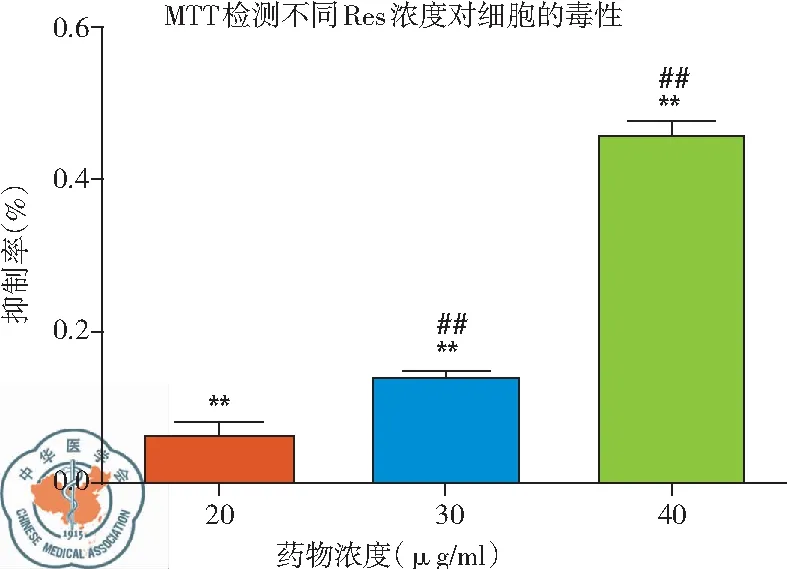

图5 不同浓度白藜芦醇及作用不同时间(30 μg/ml)细胞抑制率
二、流式检测细胞凋亡
1. 不同浓度白藜芦醇作用后H446细胞凋亡变化: 流式检测结果显示,与CK组相比,不同浓度白藜芦醇诱导的细胞凋亡程度不同,随着白藜芦醇给药浓度的增加,细胞凋亡数量显著增加,在40 μg/ml时凋亡比例增加显著,差异有统计学意义(P<0.01),见图6、7。
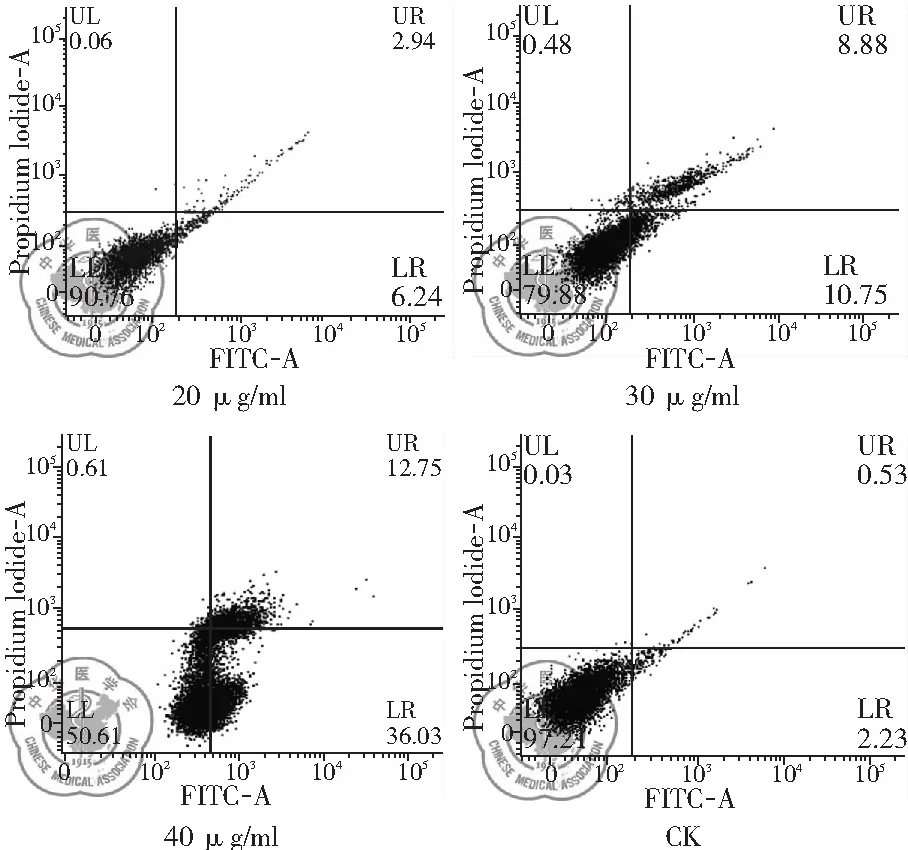
图6 不同浓度白藜芦醇流式检测的细胞凋亡变化
图7 不同浓度白藜芦醇致H446细胞凋亡率
凋亡检测结果说明白藜芦醇诱导的细胞凋亡与浓度相关,具有浓度依赖性的特点。
2. 白藜芦醇作用不同时间H446细胞凋亡变化: 流式检测结果发现,与CK组相比,给药时间不同,导致的细胞凋亡程度不同。作用24 h后,细胞凋亡比例显著上升,作用48 h后凋亡比例超过50%,说明随着给药时间的延长,细胞凋亡数量增多,凋亡率增加,Res的促细胞凋亡作用有时间依赖性特点,差异有统计学意义(P<0.01),见图8、9。
三、流式细胞仪检测ROS
1. 不同浓度白藜芦醇作用后细胞内ROS释放变化: 流式细胞仪荧光测量结果显示,随着白藜芦醇浓度增加,细胞内ROS释放增多。40 μg/ml 浓度时ROS释放量显著增多,说明ROS释放有浓度依赖性,差异有统计学意义,(P<0.01),见图10、11。
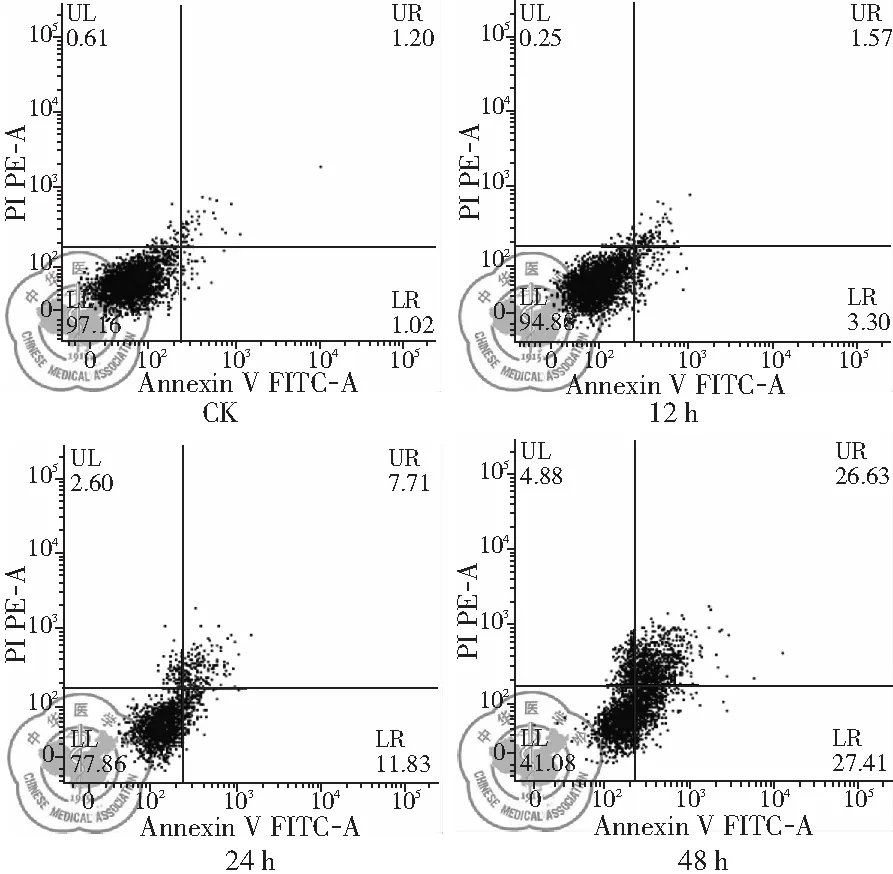
图8 30 μg/ml白藜芦醇作用不同时间流式检测的细胞凋亡变化
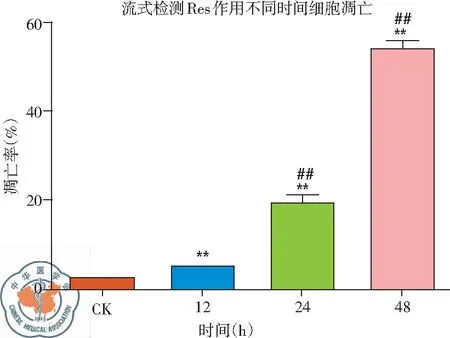
图9 30 μg/ml 白藜芦醇作用不同时间H446细胞凋亡率
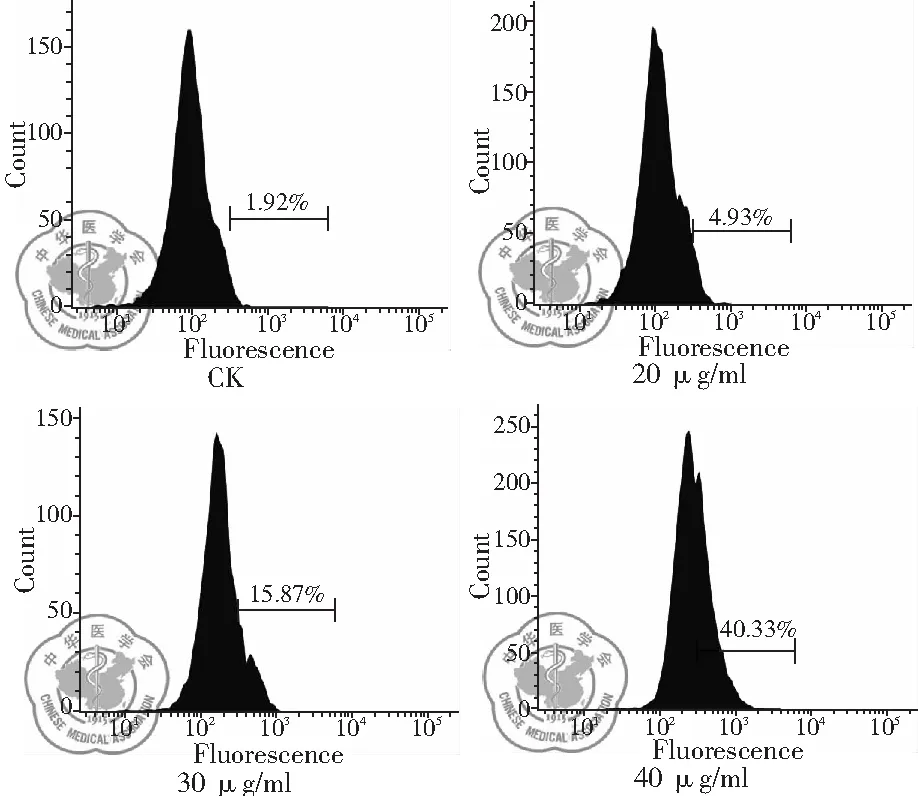
图10 不同浓度白藜芦醇给药时细胞内ROS释放情况

图11 不同浓度白藜芦醇给药时细胞内ROS释放量
2. 白藜芦醇给药不同时间细胞内ROS释放变化: 由流式检测结果可以看出,在Res给药后细胞内ROS逐渐释放,随着白藜芦醇给药时间延长,细胞内ROS释放量逐渐增多,细胞ROS释放有时间依赖性,差异有统计学意义(P<0.01),见图12、13。

图12 30 μg/ml 白藜芦醇给药不同时间细胞内ROS释放情况
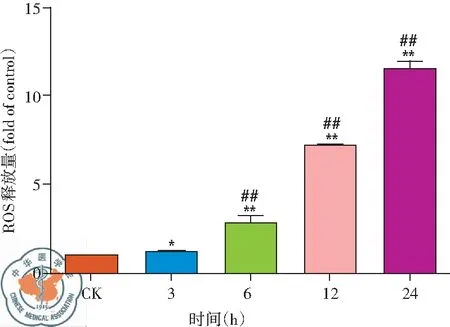
图13 30 μg/ml白藜芦醇给药不同时间细胞内ROS释放量
四、流式细胞仪检测线粒体膜电位
1. 不同浓度白藜芦醇给药后线粒体膜电位变化: 流式细胞仪检测结果显示,与CK组相比,白藜芦醇给药浓度不同,线粒体膜电位的下降程度也不同,随着浓度的增加,下降程度增加,白藜芦醇浓度40 μg/ml 时线粒体膜电位下降最为显著,有浓度依赖的特点。即随着浓度的增加,线粒体膜电位下降增加,差异有统计学意义(P<0.01),见图14、15。

图14 不同浓度白藜芦醇给药后线粒体膜电位变化
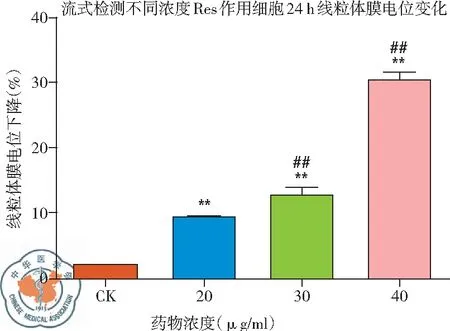
图15 不同浓度白藜芦醇给药后线粒体膜电位下降率
2. 流式细胞仪检测白藜芦醇作用不同时间线粒体膜电位变化: 流式结果显示,与CK组相比,随着白藜芦醇给药时间的延长,线粒体膜电位下降更加明显,给药24 h下降最为明显,呈现时间依赖性,差异有统计学意义(P<0.01),见图16、17。
讨论
白藜芦醇是一种多酚类化合物,主要来源于花生 、葡萄(红葡萄酒)、虎杖、桑椹等植物,具有很强的生物活性,近年来因其由于具有防癌及抗癌作用备受研究关注[16]。研究显示白藜芦醇对众多的肿瘤具有体外细胞毒性效应,包括骨髓瘤、淋巴瘤、乳腺癌、皮肤癌、宫颈癌、卵巢癌、胃癌、前列癌、结肠癌、肝癌、胰腺癌、甲状腺癌等[17-19]。研究表明白藜芦醇的抗增殖活性与刺激癌细胞凋亡有关[20-23]。有人提出,细胞凋亡的激活可能是化疗药物破坏癌细胞的一种可能机制[24]。在很多人体肿瘤中,细胞凋亡受损,说明细胞凋亡功能的破坏是正常细胞转化为肿瘤细胞的重要因素[25]。

图16 30 μg/ml 白藜芦醇给药不同时间线粒体膜电位变化
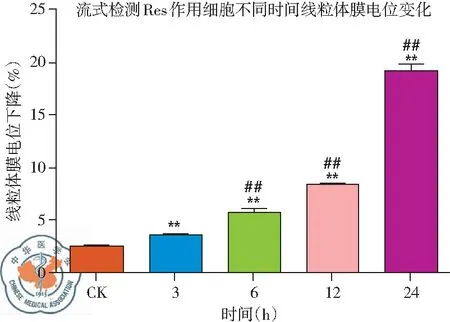
图17 30 μg/ml 白藜芦醇给药不同时间线粒体膜电位下降率
本文先采用了浓度筛选的方法,即通过不同浓度的白藜芦醇作用于H446细胞,观察其毒性作用变化与药物浓度之间的关系。细胞毒性研究结果提示,白藜芦醇作用于H446细胞后,细胞形态学发生了明显变化,而且不同的浓度造成的损伤程度不同,在细胞培养中出现了不同比例的细胞死亡。 根据浓度梯度观察结果,选择30 μg/ml白藜芦醇进一步观察其对H446细胞的毒性作用特点,观察其毒性作用是否与作用时间有相关性。研究结果显示,随着白藜芦醇作用时间的增加,受损细胞变多,受损程度变重。MTT检测结果提示白藜芦醇可对H446细胞增殖产生抑制,其抑制率随浓度、时间而增加,抑制率增加的特点,表现为浓度和时间依赖,并与细胞形态学观察结果相符。
线粒体是人体供能物质产生的最主要场所,ATP生成的任一过程受阻,氧化呼吸链电子功能传递障碍,都会导致细胞供能和组织代谢发生异常,导致机体发生异常[26]。肿瘤细胞由于其线粒体结构和功能异常,因此不能发挥正常的产能功能,其代谢会发生紊乱,继而导致肿瘤的不断发展[27-29]。细胞受到凋亡因素刺激后,线粒体的功能和结构都会发生异常,线粒体呼吸链氧化磷酸化脱偶,细胞内ROS生成增多,活性氧生成达到一定程度后可使线粒体肿胀,导致线粒体膜的通透性改变;ROS可促发和加速线粒体膜通透性转运孔的异常开放,导致ROS生成进一步增多,形成正反馈,使线粒体膜电位下降加速至不可逆,发生细胞凋亡[30]。
本文对白藜芦醇作用于H446细胞后,细胞凋亡、活性氧及线粒体膜电位3个指标进行了观察,这些观察指标与线粒体功能密切相关,并从不同浓度、不同时间来进行观察。实验结果表明,白藜芦醇可诱导H446细胞凋亡,增加细胞内活性氧的生成,导致线粒体膜电位下降,且其作用具有时间依赖和浓度依赖的特点,差异有统计学意义,P<0.01。
细胞凋亡可导致线粒体功能障碍,可引起ROS生成增多,而ROS生成增多可使线粒体肿胀,线粒体肿胀后通透性增高,使得线粒体膜电位的电压平衡不能维持,导致线粒体膜电位下降,线粒体结构破坏,功能发生异常,线粒体功能发生异常后,又可诱导细胞凋亡,因此,以上因素相互作用、相互影响,形成因果循环。本文结果显示白藜芦醇对H446细胞的抑制与线粒体功能障碍密切相关。这一途径在Luo 等[31]研究中亦得到证实,该研究结果认为白藜芦醇可通过ROS介导的DNA损伤诱导肺癌细胞早衰。另一项关于白藜芦醇诱导人肺腺癌细胞A549的研究结论,亦认为白藜芦醇的促细胞凋亡功能与线粒体功能障碍相关[32]。
综述所述,白藜芦醇对H446细胞增殖具有明显的抑制作用,可诱导H446细胞凋亡,细胞内ROS释放增多,并进一步导致线粒体膜电位下降,其作用效果具有浓度依赖和时间依赖的特点。白藜芦醇可通过线粒体功能障碍途径诱导H446细胞凋亡。
