晚期糖基化终末产物受体及胞内信号分子在肺腺癌细胞中的表达及功能
2019-03-05何美伦徐爱晖
何美伦,徐爱晖
晚期糖基化终末产物受体(receptor for advanced glycosylation end products,RAGE)是免疫球蛋白家族中的一员,作为一种多配体的跨膜信号转导受体,通过与细胞表面不同配体结合发挥功效[1]。其高表达与糖尿病血管性病变、神经退行性变、急性肺损伤以及肿瘤的发生与恶变密切相关[2-5]。RAGE的胞内端重要信号分子DIAPH1( diaphanous-realted formin 1)是Formin蛋白家族中的一员,同时为Rho蛋白效应器。RAGE胞内段通过DIAPH1的FH1区域与其相互作用,并通过激活小G蛋白家族Rho蛋白诱导细胞迁移[6]。研究[7]表明,RAGE及DIAPH1在多类恶性肿瘤中参与调节细胞运动及浸润,但是目前尚未有研究探究DIAPH1在非小细胞肺癌中的表达及RAGE对非小细胞肺癌细胞的调控情况。该研究将从分子信号水平检测RAGE及DAIPH1在肺腺癌细胞株A549中的表达,探讨RAGE的胞外配体对其迁移、凋亡的影响。
1 材料与方法
1.1材料
1.1.1细胞株 人肺腺癌细胞A549购自美国ATCC;人支气管上皮细胞BEAS-2B 购自美国Sigma公司。
1.1.2仪器和试剂 高糖DMEM培养基、PBS缓冲剂、胎牛血清、青-链霉素双抗、EDTA-胰酶、实时荧光定量PCR试剂盒、BCA蛋白浓度测定试剂盒(美国ThermoFisher公司);BEGM支气管上皮细胞培养液、支气管上皮细胞传代试剂(美国Lonza公司);RNA提取试剂盒(美国QIAGEN公司);cDNA合成试剂盒、聚丙烯酰胺凝胶、Western blot电泳缓冲液(10×)、Western blot转膜缓冲液(10×)、PVDF膜(美国Bio-Rad公司);DIAPH1抗体(美国BD公司);GAPDH抗体(美国Abcam公司);Rage抗体(美国Gene Tex公司)。
1.2实验方法
1.2.1细胞复苏、传代培养 在无菌超净台中预备2个无菌的75 cm2培养瓶,将A549细胞株和BEAS-2B复苏后分别加入含10% FBS以及1%双抗的DMEM和BEGM完全培养基。置入含5% CO2的37 ℃培养箱中培养过夜。待细胞密度长到95%左右时,以0.25% EDTA-胰酶消化传代,取生长状态良好的第2代细胞用于后续实验。
1.2.2qRT-PCR检测 将呈对数生长期的A549及BEAS-2B以8×103/cm2分别接种至6孔板中。待细胞汇合至95%时,使用QIAGEN 试剂盒提取总RNA并逆转录成cDNA。使用美国Thermo Fisher公司所提供的引物及Taq酶进行PCR扩增。为校正标本中RNA质量及逆转录效率的差异,将标本检测所得到的Ct值与相应的18SrRNA基因Ct值相减进行标化,实验重复3次。
1.2.3Western blot检测 将呈对数生长期的A549及BEAS-2B以8×103/cm2分别接种至6孔板中。待细胞汇合至95%时,弃去培养基,以细胞裂解液提取细胞中的总蛋白。以BCA法测定蛋白浓度后计算出含有30 μg蛋白的溶液体积,加入4×上样缓冲液及10×reducing buffer,最终定容为30 μg/30 μl样品,置于95 ℃加热孔中5 min,使蛋白变性。使用4%~15%聚丙酰胺凝胶分离胶电泳分离,常规转膜后封闭,一抗孵育、二抗结合,使用Odyssey双色红外荧光成像系统进行显影。为校正蛋白质样品中的质量,用所得GAPDH蛋白信号标准化所测得的RAGE及DIAPH1蛋白信号。
1.2.4细胞划痕实验 取对数生长期且生长状态佳的A549细胞以5×104/ml,将细胞接种于12孔细胞培养板中。待细胞汇合率达到90%时,将细胞饥饿。用无菌黄枪头在12孔板底部中间轻轻划出“丨”字型伤口后加入含不同浓度的CML-AGE(10、100 μg/ml)及不同浓度的S100B(1、10、100 μg/ml)10% FBS完全培养基,设立不含刺激物的BLANK组,并以Odyssey光学倒置显微镜在0 h及16 h进行拍照,利用ImageJ软件测量划痕间距离。
1.2.5凋亡检测 取对数生长期且生长状态佳的A549细胞,以8×103/cm2将细胞接种于6孔细胞培养板中。待细胞汇合率达到90%时,加入含不同浓度的CML-AGE(25、50、100 μg/ml)10% FBS完全培养基,设立不含刺激物的BLANK组。24 h后,利用前述方法提取mRNA并逆转录cDNA。使用美国ThermoFisher公司所提供的BCL-2及BAX引物及Taq酶进行PCR扩增。为校正标本中RNA质量及逆转录效率的差异,将标本检测所得到的Ct值与相应的18S基因Ct值相减,进行标准化,实验重复3次。

2 结果
2.1A549细胞中RAGE及DIAPH1mRNA表达水平经qRT-PCR检测结果表明,肺腺癌细胞A549中RAGE及DIAPH1的mRNA表达水平(0.570±0.057、0.421±0.028)较支气管上皮细胞BEAS-2B(1.064±0.092、1.045±0.080)表达明显下调(P<0.001)。见图1。
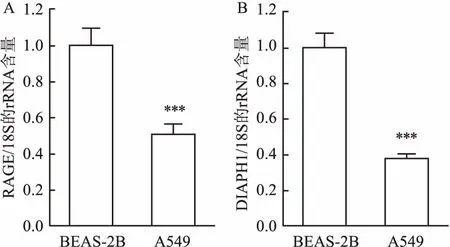
图1 qRT- PCR检测A549及BEAS-2B中RAGE与DIAPH1的表达
A:RAGE;B:DIAPH1;与BEAS-2B比较:***P<0.001
2.2A549细胞中RAGE及DIAPH1蛋白表达水平经Western blot检测两组细胞中RAGE及DIAPH1蛋白表达水平,并进行灰度值分析。结果显示,肺腺癌细胞A549中RAGE及DIAPH1的蛋白表达水平(0.381±0.073、0.351±0.115)较支气管上皮细胞BEAS-2B(1.000±0.089、1.000±0.020)表达明显下调(P<0.001)。见图2。
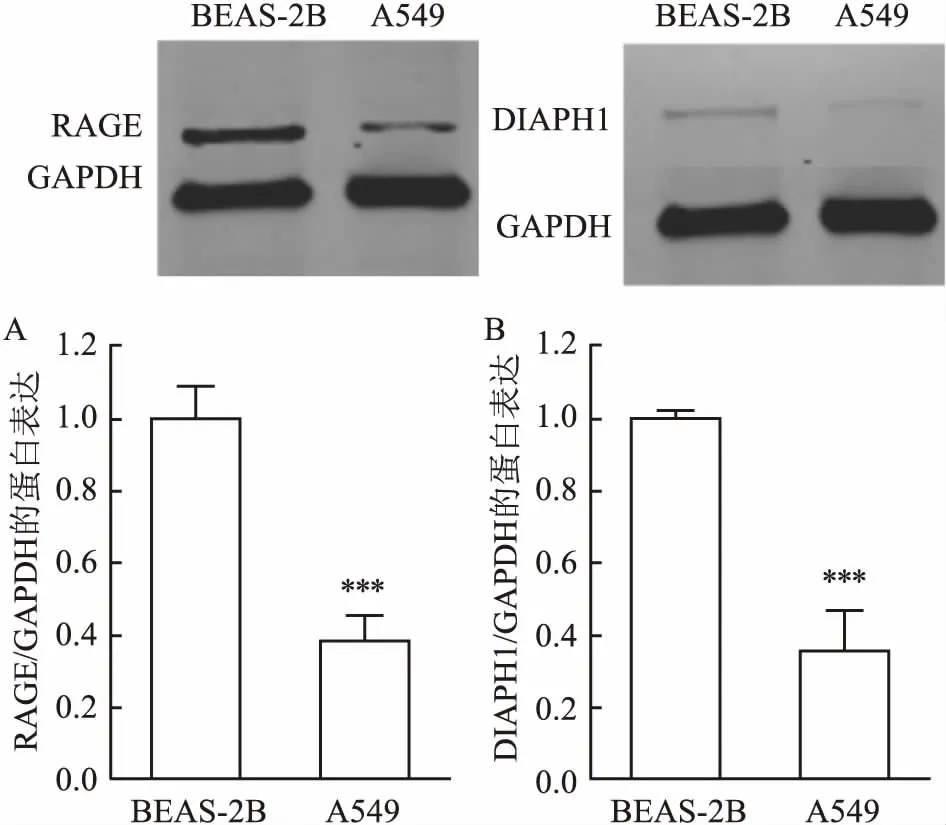
图2 Western blot检测A549及BEAS-2B中RAGE与DIAPH1的表达
A:RAGE;B:DIAPH1;与BEAS-2B比较:***P<0.001
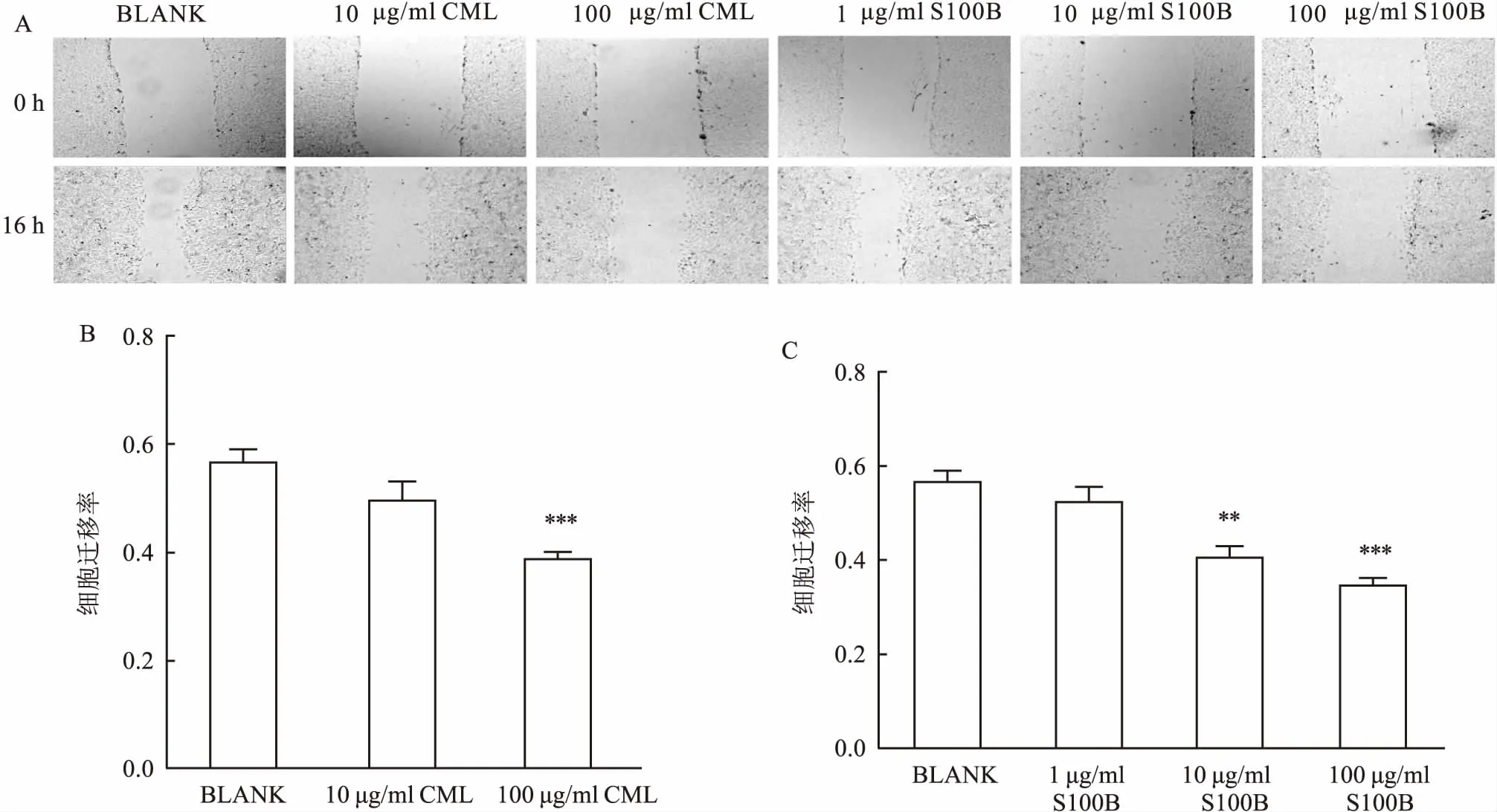
图3 RAGE配体对A549细胞迁移能力的影响

图4 CML-AGE对A549细胞凋亡能力的影响
2.3RAGE配体对A549细胞迁移能力的影响划痕实验结果显示,以不同浓度RAGE配体CML-AGE及S100B刺激A549肺腺癌细胞株。16 h后,与BLANK组(0.567±0.004)相比,CML-AGE实验组(0.495±0.037、0.387±0.015,F=12.23,P<0.001)及S100B实验组(0.523±0.032、0.405±0.024、0.343±0.018,F=14.45,P<0.001)对细胞迁移能力有明显抑制作用,其作用呈现出浓度依赖性。见图3。
2.4CML-AGE对A549细胞凋亡能力的影响qRT-PCR检测结果表明,以不同浓度RAGE配体CML-AGE 刺激A549肺腺癌细胞株后,相比于BLANK组,CML-AGE刺激组中抗凋亡基因BCL-2表达下调(1.002±0.029、0.612±0.065、0.871±0.030、0.656±0.012,F=22.22,P<0.001);促凋亡基因BAX表达上调(1.003±0.027、1.099±0.036、1.375±0.046、1.764±0.160,F=17.50,P<0.001),其作用呈现出浓度依赖性。见图4。
3 讨论
Jemal et al[8]在Cancer statistics中指出,肺癌是造成全世界发病率及死亡率较高的主要原因之一,目前已成为全世界死亡率最高的恶性肿瘤,严重危害人类的生命健康。除此以外,肺癌患者的五年生存率仅约为18%,正因为肺癌在其早期阶段对周围血管造成的浸润,进一步导致其发生远处转移,使得患者失去了手术治疗的机会。因此,寻找控制肺癌的浸润转移的有效治疗靶点变得极为重要。
晚期糖基化终产物受体,又称RAGE,是免疫球蛋白家族中的一员,作为一种多配体的跨膜信号转导受体,通过细胞外段与细胞表面不同配体结合发挥功效。既往研究[9-10]表明,RAGE在正常肺组织,尤其是肺泡I型上皮细胞中的表达较高,而在肺癌组织中,RAGE的表达较正常肺组织明显下调,其下调原因尚未明确。
近年来有研究表明,RAGE除了与细胞外配体结合,其与细胞内信号分子的结合在信号传导的过程中同样起重要作用。有学者研究[6]证实,RAGE胞内段通过DIAPH1的FH1区域与其相互作用,并通过激活小G蛋白家族Rho蛋白,尤其是Rac1及Cdc42诱导细胞迁移。DIAPH1在多项恶性肿瘤,如神经胶质瘤、乳腺癌、结肠癌中的表达明显上调,并参与调节细胞运动及浸润[11-13],但其在非小细胞肺癌中的表达情况尚未明确。在本研究中,选用肺腺癌细胞A549为实验组,以人支气管上皮细胞BEAS-2B为对照组,在无刺激的完全培养基培养后,提取细胞中的全部RNA及蛋白质。通过qRT-PCR及Western blot检测RAGE及DIAPH1的mRNA及蛋白质表达。结果表明,在肺腺癌细胞A549中,RAGE的mRNA及蛋白质水平较BEAS-2B细胞明显下降(P<0.001)。该结果与此前多项研究[8-9]结果相符合。同时,本实验首次检测出在肺腺癌细胞A549中,DIAPH1的mRNA及蛋白质水平较BEAS-2B细胞也明显下降(P<0.001),结果进一步验证了既往研究中对于RAGE在肺腺癌细胞中表达降低的假说。并通过在肺腺癌细胞中DIAPH1和RAGE表达同时降低,为RAGE与DIAPH1在细胞内结合并进一步激活信号通路提供证据。
研究[10]显示,在非小细胞肺癌患者组织标本中RAGE表达较正常对照组明显下降,同时其下调水平与TNM肿瘤分级呈正相关性。由此可推测,激活RAGE后非小细胞肺癌恶性程度越低,肿瘤细胞迁移能力越弱。本试验中,选用RAGE的胞外配体CML-AGE、S100B作为刺激物,探究其在不同浓度情况下对肺腺癌细胞A549迁移能力的影响。结果显示,相比于无RAGE配体刺激的BLANK组,CML-AGE及S100B刺激组对肿瘤细胞迁移有明显的抑制作用,且呈现出浓度依赖性(P<0.01)。结果提示激活RAGE的表达可一定程度抑制肺腺癌细胞的迁移,从而可以减缓其转移速度。本研究显示,RAGE在非小细胞肺癌细胞中的表达低于在正常肺支气管上皮细胞中的表达,且与细胞迁移能力有关,提示RAGE与非小细胞肺癌的发生及浸润转移相关,可作为临床上一项判断肿瘤恶性程度和是否转移的辅助指标。
恶性肿瘤的发展过程可视为细胞生长/细胞凋亡失衡所造成的结果,过度表达抗凋亡基因或低表达促凋亡基因,都会造成细胞的非正常死亡减少,从而引发恶性肿瘤。研究[14-15]表明,恶性肿瘤中已发现BCL-2表达上调、BAX表达下调,并且认为下调BCL-2/BAX比率可诱导细胞凋亡。本研究中,使用qRT-PCR 检测经RAGE配体CML-AGE及S100B刺激后A549细胞中二者的表达。结果显示,肺腺癌细胞A549中BCL-2的表达明显下降且BAX的表达明显上调,其作用呈现出浓度依赖性(P<0.05)。本实验结果表明,激活RAGE后,可一定程度促进细胞凋亡,提示RAGE在非小细胞肺癌的生长及凋亡中起重要作用,也为今后非小细胞肺癌的治疗提供新的靶点。但非小细胞肺癌组织中RAGE和DIAPH1表达的具体调控机制以及其与非小细胞肺癌的发生、发展、迁移的关系还有待进一步研究。
