缺血预处理诱导的外泌体对心肌细胞低氧/复氧损伤及Bcl-2、Bax表达的影响
2019-03-05产进中何淑芳
刘 中,产进中,黄 俊,张 丽,张 野,何淑芳
心肌在缺血基础上血流再灌注后损伤反而加重,称为心肌缺血再灌注损伤(ischemic reperfusion injury,IRI)。在急性心肌梗死溶栓治疗、介入治疗以及心脏外科中常常发生再灌注损伤,导致心肌损伤加重,严重影响心功能恢复。Murry et al[1]首次提出缺血预处理(ischemic preconditioning,IPC)的概念,证实IPC可以减轻IRI,是目前已知最强的内源性心肌保护方法,但至今具体的作用机制仍未完全明确。
外泌体是一种囊泡样小体,其中包含了丰富的蛋白质、核酸,可传输多种信号分子,是介导细胞间通讯的重要物质[2]。大量研究[3-4]显示,干细胞来源的外泌体,可作用于受损的心肌组织,抑制心肌细胞凋亡,减少梗死面积,发挥心肌保护作用。然而,外泌体是否参与介导了IPC的心肌保护作用,尚未可知。该研究拟探讨IPC诱导的外泌体对H9c2心肌细胞低氧/复氧(hypoxia/reoxygenation , H/R)损伤以及凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关x蛋白(Bcl-2 associated x protein,Bax)表达的影响,以期为IPC心肌保护机制研究提供新的思路和实验依据。
1 材料与方法
1.1材料
1.1.1实验动物与细胞株 健康成年雄性SD大鼠,SPF级,体质量(250±30) g,由安徽医科大学动物实验中心提供,实验动物随机分为对照组(CON组)和IPC组,每组3只。大鼠H9c2(2-1)胚胎心肌细胞株购自中科院上海细胞库。
1.1.2主要试剂及仪器 无外泌体血清、ExoQuickTMExosome Precipitation Solution试剂盒购自美国SBI公司;DME/F-12细胞培养液购自美国Hyclone公司;鼠抗HSP60单克隆抗体购自美国Santa Cruz 生物技术公司;Bcl-2、Bax 单克隆兔抗购自美国CST公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;细胞增殖检验试剂盒(cell counting kit-8,CCK-8)购自广州Biosharp公司;乳酸脱氢酶(lactic acid dehydrogenase,LDH)测定试剂盒购自南京建成生物工程研究所;FITC Annexin V凋亡试剂盒购自美国BD公司;低氧小室购自加拿大Stem Cell公司;荧光显微镜购自日本Olympus公司;蛋白电泳仪、Tanon Fine Do X6全自动化学发光图像分析系统购自上海Tannon公司;Cytomics FC500 流式细胞仪购自美国Beckman有限公司。
1.2方法
1.2.1大鼠缺血预处理 参考文献[5],建立大鼠心肌缺血再灌注损伤模型。大鼠腹腔注射5%戊巴比妥50 mg/kg进行麻醉,气管插管后,连接小动物呼吸机。于左锁骨中线处切开皮肤2 cm,在第4、5肋间打开胸腔,剪开心包,轻压大鼠胸廓,挤出心脏,在肺动脉圆锥与左心耳之间冠状动脉左前降支处用6-0 Prolene线进针作一线结,回纳心脏于胸腔,稳定15 min后开始心脏缺血再灌注损伤实验,收紧线结即为结扎左冠状动脉前降支致心肌缺血,松开线结即为心肌再灌注。对心肌进行缺血5 min,再灌注5 min,3个循环,即为IPC。对照组大鼠麻醉后,仅穿线不结扎。
1.2.2血清外泌体提取 预处理结束后收集大鼠血液,采用ExoQuickTM试剂盒提取血清中的外泌体。血清以 5 686 r/min离心15 min去除细胞和细胞碎片,留取上清液;上清经过0.22 μm一次性滤器过滤,所得上清液按照试剂盒说明书,加入沉淀剂,混合均匀后,4 ℃孵育30 min;随后将孵育好的混合物在4 ℃、4 021 r/min离心30 min,离心后外泌体呈米黄色或白色沉淀沉于管底;弃上清液,再次 4 021 r/min离心5 min,留取沉淀,即为外泌体,用400 μl PBS或DMEM/F12培养液重悬,分别标记为IPC-Exo和CON-Exo,保存于-80 ℃。
1.2.3外泌体浓度测定 采用BCA蛋白定量法测定外泌体浓度,严格按照BCA试剂盒的说明书测定样品的浓度。将0.5 mg/ml的蛋白标准品按照0、1、2、4、8、12、16、20 μl顺序加到96孔板的标准品孔中,各孔加入PBS补足到20 μl;上述提取的外泌体样品稀释10倍后,取5 μl加到96孔板中,加PBS补足到20 μl;各孔加BCA工作液200 μl,用加样枪轻轻吹打混匀;37 ℃孵育30 min后放入酶标仪,于波长570 nm处测定各孔的吸光度值。
1.2.4Western blot检测外泌体标志蛋白HSP60 上述提取的两组外泌体样品,取100 μl,加入RIPA裂解液冰上裂解随后与5×SDS上样缓冲液混匀,100 ℃煮10 min,制成蛋白样品。取20 μg蛋白样品经SDS-PAGE电泳后,转移至PVDF膜,在含5%脱脂牛奶的TBST液中室温孵育1~2 h,TBST液漂洗3次,每次10 min,加入HSP60一抗 (1 ∶500),4 ℃孵育过夜。次日TBST液漂洗3次,每次10 min,加二抗孵育1 h,TBST漂洗3次,每次10 min,采用ECL发光试剂盒显影并采集图像。
1.2.5细胞培养 H9c2心肌细胞用含10%无外泌体血清的DMEM/F-12培养液培养,于37 ℃、5% CO2的细胞培养箱中培养。选取对数生长期的细胞用于实验。当细胞密度在80%左右时,用0.25%胰酶消化1 min左右,以1 ∶3的比例传代,每隔2~3 d传代1次。
1.2.6建立心肌细胞H/R损伤模型 参照文献[6]中方法,换去H9c2细胞正常培养时的完全培养基,加入无血清无糖的低氧液(139 mmol/L NaCl、4.7 mmol/L KCl、0.5 mmol/L MgCl2、1.0 mmol/L CaCl2、5 mmol/L HEPES,pH 7.4),细胞置于低氧小室中,通入95%N2-5%CO2饱和10 min以驱除小室内的氧气,随后将低氧小室放入37 ℃培养箱中培养5 h进行低氧处理,然后用含10%无外泌体血清的完全培养基正常培养1 h进行复氧。
1.2.7实验分组及处理 H9c2心肌细胞随机分为4组:① 对照组(Control组):H9c2细胞置于DMEM/F12细胞培养液中常规培养;② 低氧/复氧组(H/R):将H9c2细胞进行5 h低氧和1 h复氧处理;③ H/R+IPC-Exo组:将MPC-Exo以20 mg/L的终浓度加入H9c2心肌细胞培养液,与心肌细胞共孵育12 h后,进行H/R处理;④ H/R+CON-Exo组:将CON-Exo以20 mg/L的终浓度加入H9c2心肌细胞培养液,与心肌细胞共孵育12 h后,进行H/R处理。
1.2.8心肌细胞活力的检测 将H9c2细胞接种于96孔培养板中,每孔8×103个,按上述方法进行分组及处理完成后,每孔加入10 μl CCK-8溶液(此时培养基为100 μl),在细胞培养箱内孵育4 h后,酶标仪上于波长450 nm处测定各组吸光度值,空白对照孔为不含细胞的培养液。H9c2心肌细胞活力为实验测定孔吸光度值减去空白对照孔吸光度值。计算各组平均值。实验独立重复3次。
1.2.9检测LDH活性 接种在96孔板的H9c2细胞按照以上进行分组及处理完成后,每组各取40 μl细胞培养上清液,严格按照LDH试剂盒说明书操作,利用酶标仪于波长450 nm处测定各孔吸光度值,然后根据公式计算各组LDH活性。实验独立重复3次。
1.2.10Annexin-V-FITC/PI双染法检测细胞凋亡将H9c2心肌细胞以3×106个/孔接种在6孔培养板,按照上述进行分组及处理完成后,0.25%胰酶(不含EDTA)消化,PBS洗涤细胞2次,1 500 r/min离心5 min,收集细胞,用100 μl 1×缓冲液重悬细胞,每组加入5 μl Annexin V-FITC和5 μl PI,轻轻混匀后,室温避光反应15 min,每组再加入400 μl缓冲液重悬细胞,随后流式细胞仪检测各组细胞凋亡率。以单染PI细胞和单染Annexin-V-FITC细胞作为基准参照,每个样本获取3×104个细胞,用FCS Express V 4.0软件进行分析。实验独立重复3次。
1.2.11Western blot检测Bcl-2、Bax蛋白表达 按照上述分组及处理结束后,提取各组细胞内总蛋白,制备蛋白样品。取20 μg蛋白样品经电泳后,转膜,后在含5%脱脂牛奶的TBST封闭液中室温孵育1~2 h,TBST液漂洗3次,每次10 min,加入Bcl-2、Bax一抗 (1 ∶1 000),4 ℃孵育过夜。次日TBST液漂洗3次,每次10 min,加入二抗孵育1 h,TBST漂洗3次,每次10 min,采用ECL发光试剂盒显影并采集图像。采用Image J软件进行分析,以Bcl-2或Bax与β-actin条带灰度值之比来表示蛋白相对表达量。

2 结果
2.1IPC对外泌体释放的影响采用BCA蛋白定量法测定血清外泌体浓度,结果表明CON-Exo浓度为(7.46± 1.77)mg/ml,IPC-Exo浓度为(14.93±1.27)mg/ml,提示IPC可诱导血清外泌体释放显著增加(P<0.01),见图1A。Western blot 结果显示IPC-Exo、CON-Exo均表达外泌体标志性蛋白HSP60,见图1B,且IPC后提取的外泌体中HSP60蛋白表达水平增加(P<0.05)。
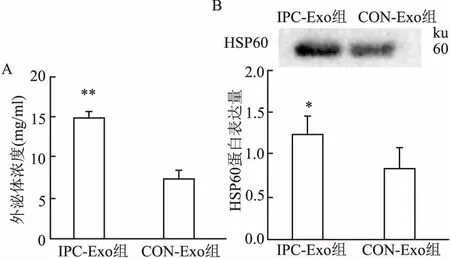
图1 IPC对外泌体释放的影响
A:两组外泌体浓度统计分析图;B: Western blot检测血清外泌体标志蛋白HSP60,且IPC后提取的外泌体中HSP60蛋白表达水平增加;与CON-Exo组比较:*P<0.05,**P<0.01
2.2IPC-Exo对H9c2心肌细胞活力的影响H9c2细胞活力检测结果如图2所示,与CON组(1.14± 0.09)相比,H/R组(0.47±0.08)细胞活力明显降低(P<0.01);与H/R组比较,H/R+IPC-Exo组(0.78±0.04)细胞活力增加(F=169.1,P<0.01);而H/R+CON-Exo组(0.51± 0.11)细胞活力无明显增加,差异无统计学意义,说明IPC-Exo可以明显增加细胞活力。
2.3IPC-Exo对H9c2心肌细胞LDH的活性的影响细胞培养液中LDH的水平可以用来表示细胞损伤的程度,各组测得结果分别为CON组(67.33±9.71)、H/R组(166.00 ±12.17)、H/R+IPC-Exo组(111.33± 11.68)、H/R+CON-Exo组(149.67± 13.80)。如图3所示,与CON组比较,H/R组心肌细胞H/R损伤后LDH活性明显增加(P<0.01);与H/R组比较,H/R+IPC-Exo组可减轻心肌细胞H/R损伤,降低H9c2心肌细胞LDH的活性(F=40.73,P<0.05)。而H/R+CON-Exo组LDH活性无明显变化,差异无统计学意义。提示IPC-Exo能够降低H9c2心肌细胞LDH的活性。
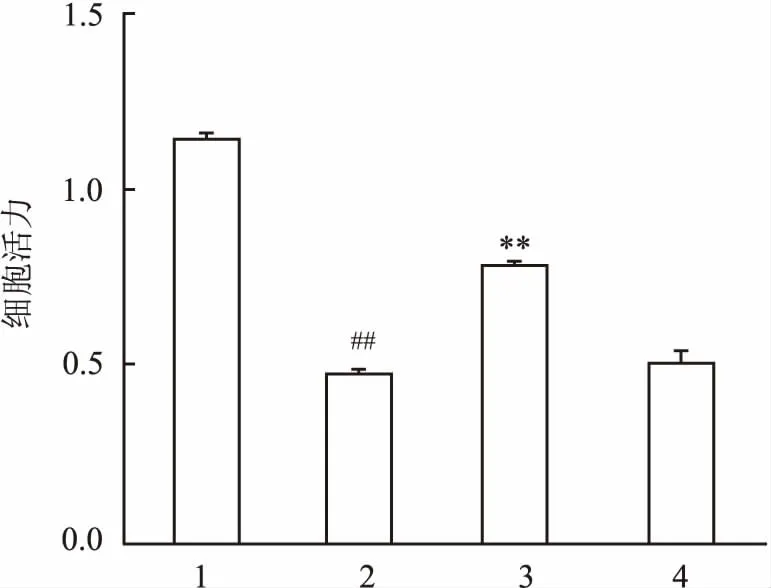
图2 IPC-Exo对H9c2心肌细胞活力的影响
1:CON组;2:H/R组;3:H/R+IPC-Exo组;4:H/R+CON-Exo组;与CON组比较:##P<0.01;与H/R组比较:**P<0.01
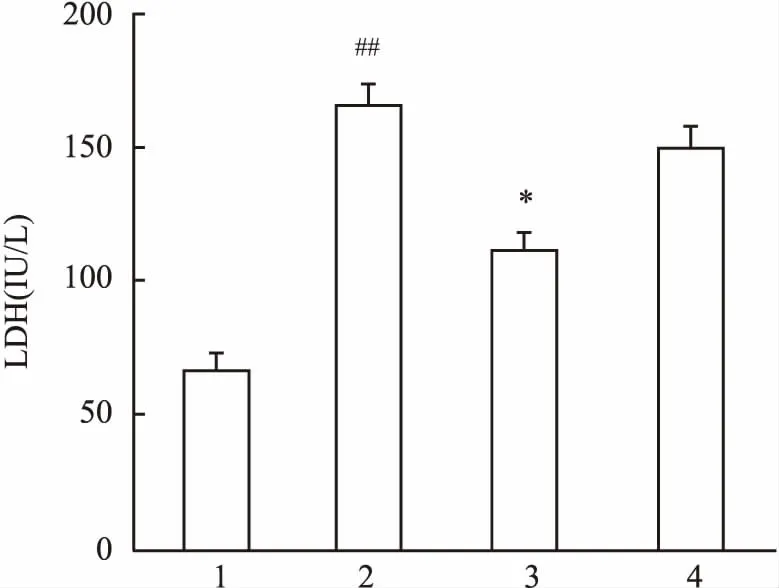
图3 IPC-Exo对H9c2心肌细胞LDH的活性的影响
1:CON组;2:H/R组;3:H/R+IPC-Exo组;4:H/R+CON-Exo组;与CON组比较:##P<0.01;与H/R组比较:*P<0.05
2.4IPC-Exo对H9c2心肌细胞凋亡的影响Annexin-V-FITC/PI双染法检测心肌细胞凋亡,结果表明,与CON组比较,H/R组凋亡细胞(右上象限、右下象限)明显增多(P<0.01);与H/R组比较,H/R+IPC-Exo组凋亡细胞明显减少(F=13.63,P<0.05);而H/R+CON-Exo组心肌细胞凋亡率无明显变化,差异无统计学意义,见图4,表明IPC-Exo可以抑制H9c2心肌细胞凋亡。
2.5IPC-Exo对H9c2心肌细胞Bcl-2、Bax表达的影响Western blot检测结果表明,与CON组比较,H/R组心肌细胞H/R损伤后Bcl-2表达明显减少(F=5.736,P<0.05),Bax表达增加(F=26.02,P<0.01),而H/R+IPC-Exo组Bcl-2表达增加、Bax表达减少,与H/R组比较,差异有统计学意义(P<0.05),而H/R+CON-Exo组差异无统计学意义,见图5,说明IPC-Exo能上调H9c2细胞Bcl-2表达、下调Bax表达。

图4 IPC-Exo对H9c2心肌细胞凋亡的影响
1:CON组;2:H/R组;3:H/R+IPC-Exo组;4:H/R+CON-Exo组;与CON组比较:##P<0.01;与H/R组比较:*P<0.05
3 讨论
近年来,外泌体在心血管疾病中的作用得到广泛关注,外泌体在缺血性心脏病中的重要作用逐渐得到认识。研究[4]显示,间充质干细胞来源的外泌体能明显减小小鼠的心肌梗死面积,通过增加ATP水平,减少氧化应激,激活PI3K/Akt 通路,从而减轻IRI。同时有研究[7]表明,血浆外泌体可以介导蛋白HSP70的转运,激活心肌细胞内ERK和p38 MAPK信号通路从而减轻I/R损伤,从而起到心肌保护作用。此外,心脏祖细胞来源的外泌体在小鼠心肌梗死中也发挥作用,可抑制心肌细胞凋亡,减少心肌梗死面积,改善心脏功能[8]。以上研究均表明,外泌体在缺血性心脏病中具有心肌保护作用,这为IRI后心肌修复治疗提供了新策略和新思路。
IPC是指反复几次短暂缺血再灌注后,可诱导心脏产生内源性保护机制,使其对后面较长时间的缺血性损伤产生明显的耐受,显著减少心律失常的发生以及减轻梗死面积。然而IPC减轻IRI的确切机制仍未完全阐明。研究[9]表明主要是涉及细胞因子、凋亡基因、激活激酶途径等。进一步深入研究IPC的作用机制,将促进其在心肌梗死、心脏再灌注等临床治疗中的应用,为预防或减轻IRI提供新靶点。本研究通过在大鼠体内进行IPC,预处理结束后收集血液,随后分别提取CON组和IPC组血清中的外泌体,采用BCA蛋白定量法测定血清中外泌体浓度,结果表明IPC组外泌体浓度明显高于CON组,表明IPC可刺激内源性外泌体的释放,从而增加其在血清内的含量。外泌体含量及内容物的变化,可以反映机体的生理病理状态,对机体产生不同的影响[10]。Giricz et al[11]研究发现,离体灌流的供体心脏经过IPC处理后,其冠脉流出液中的细胞外囊泡(其中包含外泌体),可以减轻受体心脏的IRI损伤。此外有研究[12]显示,缺血预处理可以刺激富含miRNA-144的外泌体的释放,而miRNA-144激活PI3K/Akt和ERK信号通路,从而发挥心肌保护作用。
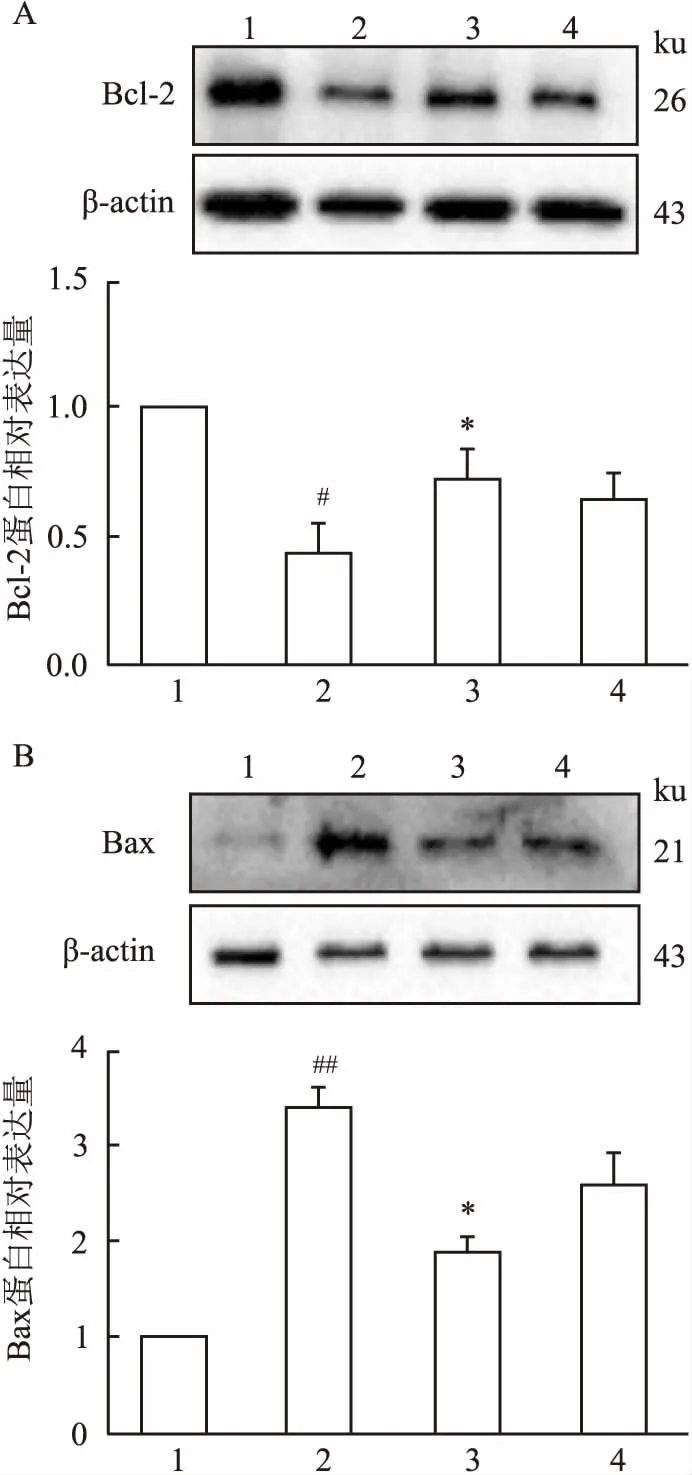
图5 IPC-Exo对H9c2心肌细胞Bcl-2、Bax表达的影响
A:Bcl-2;B:Bax;1:CON组;2:H/R组;3:H/R+IPC-Exo组;4:H/R+CON-Exo组;与CON组比较:#P<0.05,##P<0.01;与H/R组比较:*P<0.05
为进一步探讨IPC诱导释放的血清外泌体对H/R损伤的影响,将IPC-Exo与H9c2心肌细胞共孵育12 h,随后进行H/R损伤,研究结果表明,IPC-Exo能增加H9c2心肌细胞活力,降低LDH的活性,抑制心肌细胞凋亡,而CON-Exo并未有此作用。心肌细胞凋亡是IRI中重要的损伤环节,在其发生中扮演着重要角色。研究[13]表明,细胞凋亡是一种受多基因控制的程序性死亡,并且Bcl-2和Bax是细胞凋亡的重要调控因子。Bcl-2是重要的抗凋亡基因,主要通过抑制细胞色素c的释放来调节凋亡[14]。相反,Bax是促细胞凋亡基因,可抑制Bcl-2活性或作用于线粒体膜通透性转换孔导致线粒体通透性改变,引起一系列级联反应[15]。本研究结果表明,H/R组心肌细胞H/R损伤后细胞凋亡率明显增加,而H/R+IPC-Exo组凋亡细胞明显减少,同时显示H/R组Bcl-2表达明显减少,Bax表达增加,而H/R+IPC-Exo组Bcl-2表达增加、Bax表达减少,表明IPC-Exo能上调Bcl-2蛋白、下调Bax蛋白的表达。据此,推测IPC-Exo可以减轻H9c2心肌细胞H/R损伤,其机制可能是通过上调Bcl-2、下调Bax表达抑制心肌细胞凋亡从而发挥心肌保护作用。然而,本研究主要在H9c2细胞上进行的,H9c2细胞是大鼠胚胎心肌细胞株,但其不同于原代的乳鼠心肌细胞和成年心肌细胞,因此IPC诱导释放的血清外泌体是否能够减轻原代心肌细胞H/R损伤,发挥心肌保护作用,有待于进一步研究。此外本研究只观察了Bcl-2和Bax的变化,探讨了初步的分子机制,具体的作用机制有待于进一步研究。
