噪声暴露下大鼠行为学和海马促肾上腺皮质激素释放因子蛋白表达的改变
2019-03-04陈抗松杨琨杨希林陈建新廖华
陈抗松 杨琨 杨希林 陈建新 廖华*
1佛山市第一人民医院耳-侧颅底外科,听觉与平衡医学研究所(佛山528000)
2武汉大学人民医院耳鼻咽喉-头颈外科(武汉430060)
3武汉大学人民医院精神卫生中心(武汉430060)
噪声是现代都市生活中不可避免的应激源之一,噪声不仅造成耳鸣、听力损失,而且还降低免疫力,导致紧张、焦虑、高血压、心脏疾病等健康问题出现。研究表明,噪声对人的心理产生负面影响,如人的反应能力下降、瞬时和短时视听记忆下降、A型行为增多,引起抑郁、焦虑、易激惹等负性情绪[1]。本研究检测噪声暴露后大鼠ABR反应阈的变化,观察噪声暴露后其行为学改变,并通过Western-blot测定大鼠海马促肾上腺皮质释放因子(CRF)表达情况,在动物实验的基础上探讨噪声对生物体听力和情绪的负性影响及其可能的发生机制。
1 材料与方法
1.1 实验动物分组及处理
实验动物由武汉大学人民医院实验动物中心提供,实验前将每只大鼠行旷场实验及ABR检测,选取行为学指标和ABR反应阈相近的Wistar雄性大鼠24只,随机分为3组,每组8只。对照组(A组):正常喂养,不予任何处理;噪声组(B组):参照Wibke等[2]的方法,给予实验动物慢性噪声暴露(噪声条件:中心频率为4 kHz、声强为100 dB SPL的宽带白噪声,由美国TDT(Tucker-Davis technology)公司Rvpds软件包编译,连接扬声器播放,并用声级计校准),将动物置于隔音混响室内,每天固定中午12点到下午4点噪声暴露4 h,持续28 d;氟西汀组(C组):噪声暴露的条件和时间与噪声组相同,每天噪声暴露后即腹腔注射剂量为10 mg/kg的氟西汀,持续28 d。
1.2 检测指标
1.2.1 旷场行为学测量
旷场实验参照Yang等[3,18,19]的方法,自制大小为120cm×90cm×35cm的旷场,四周壁和底壁均为黑色,于上午9:00到12:00在安静、光线及温度适宜的房间内进行观察。使用动物行为自动跟踪系统(Ethovision3.0,荷兰)记录并分析大鼠在旷场内10min的总行程、平均速度、直立次数。于上午9:00到12:00在安静、光线及温度适宜的房间内进行观察。在造模的前1d、第7、14、28d对每只动物进行检测,彻底清洁旷场后,再进行下一只大鼠的测试。
1.2.2 体重及摄食量的变化
在噪声暴露前1d和噪声暴露第28d后称取三组大鼠的体重和24h摄食量,比较各组大鼠的体重和摄食量的变化。
1.2.3 糖水偏爱实验
在噪声暴露前1d和第28d对三组大鼠行糖水偏爱实验,详细实验过程参照Willner的实验方法[4,18,19]。记录动物的糖水消耗、纯水消耗并计算糖水偏爱百分比[糖水消耗(/糖水消耗+纯水消耗)×100%]。
1.2.4 ABR测试
噪声暴露前1 d、第7、14、28 d,旷场实验完成后在屏蔽隔音室内对三组大鼠行ABR测试。成功麻醉后大鼠置于固定架上,记录电极插于大鼠耳间线中点颅顶皮下,参考电极插于给声耳乳突皮下,接地线插于鼻尖,采用TDT(美国TDT公司)系统SigGenRP软件单耳给声并采集信号,刺激声为click,强度范围为10~110 dB SPL,衰减间隔5 dB,滤波带宽300~3000 Hz,持续时间10 ms,叠加1024次,以Ⅲ波出现为标准判定大鼠的反应阈,波形分化较差时可以Ⅲ波幅值接近特定的电压为判断标准,记录ABR的反应阈值。
1.2.5 Western-blot检测大鼠海马CRF表达
在上述实验完成后,根据大鼠立体定位图谱定位大鼠海马区,整个取材过程在冰上操作,断头取脑后在解剖显微镜下翻开大脑皮层,迅速完整剥离海马,将组织置于-80℃冰箱保存。称取三组标本,加入适量RIPA裂解液后冰上匀浆,4℃12000rpm离心,取上清液,BCA法测蛋白浓度,各样品取50ug总蛋白上样,恒压120V/40mA,12%的SDS-PAGE凝胶电泳。根据预染溴酚蓝显示,目的蛋白充分分离后,停止电泳。取出凝胶,切下目的条带,蒸馏水冲洗后200mA恒流PVDF膜转膜。用含5%含脱脂奶粉的TBST封闭液室温封闭2h。将PVDF膜浸泡于含兔抗鼠GAPDH及兔抗鼠CRF一抗孵育液(1:500,Santa)中,4℃孵育过夜。TBST缓冲液洗膜5min×5次。加入HRP标记二抗(1:40000,武汉博士德生物公司),室温摇床孵育2h。TBST洗膜5min×5次。ECL发光剂曝光、显影。Gel Pro4.0软件进行灰度扫描分析,检测CRF蛋白的表达。
1.3 统计学方法
采用spass17.0统计软件,每组数据用均数±标准差(x±s)表示,独立样本的计量资料采用t检验;重复检测的计量资料采用方差分析,两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠旷场实验动物行为学的比较
实验前三组大鼠的旷场行为差异无统计学意义(P>0.05)。第7d,与对照组比较,另两组大鼠的运动总行程、平均速度、直立次数和粪便粒数明显增加,差异有统计学意义(P<0.01);与噪声组比较,氟西汀组大鼠的总行程、平均速度、直立次数和粪便粒数均减少,差异有统计学意义(P<0.01)。第14、28d,与对照组相较,另两组大鼠的运动总行程、平均速度和直立次数明显降低,粪便粒数增加,差异均有统计学意义(P<0.01);与噪声组比较,氟西汀组大鼠的总行程、平均速度、直立次数增加,粪便粒数减少,差异有统计学意义(P<0.01)。
2.2 噪声暴露前后三组大鼠体重、摄食量及糖水偏爱的变化
噪声暴露前,三组大鼠的体重、摄食量和糖水偏爱的差异均无统计学意义(P>0.05)。噪声暴露后,与对照组比较,噪声组和氟西汀组的24 h摄食量减少,糖水偏爱百分比明显下降,差异均有统计学意义(P<0.05),而各组大鼠的体重差异无统计学意义(P>0.05);与噪声组比较,氟西汀组大鼠体重和摄食量的差异均无统计学意义(P>0.05),而糖水偏爱明显增加,差异有统计学意义(P<0.05)。
2.3 各组大鼠ABR反应阈的改变
与对照组比较,另两组大鼠随着噪声暴露时间的延长,其ABR反应阈明显升高,差异有显著统计学意义(P<0.01);而噪声暴露第7、14、28d,噪声组与氟西汀组比较,ABR的反应阈之间的差异均无统计学意义(P>0.05)。
2.4 各组大鼠海马区CRF表达
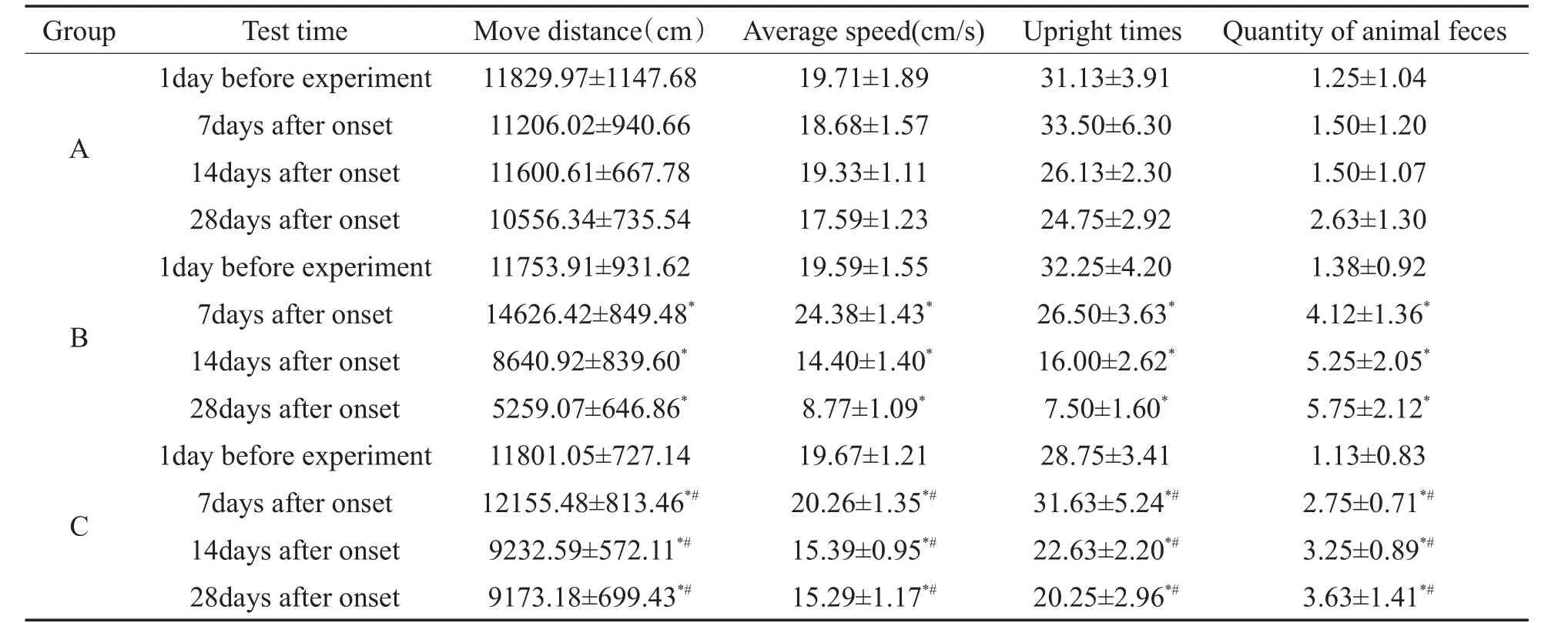
表1 各组大鼠不同时间旷场行为的比较(x±s,n=8)Table 1 the behavioral features of the rats in each group in the open-field(x±s n=8)
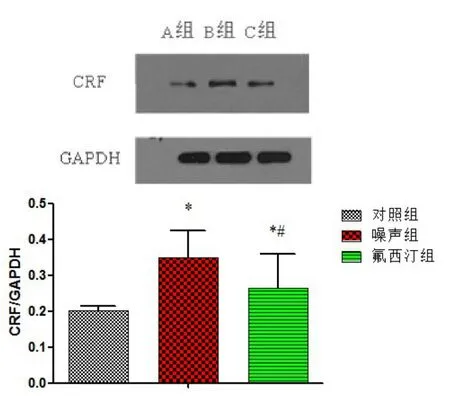
图1 Western-blot法检测三组大鼠脑海马区CRF表达Fig.1 The level of CRF expression elevated by Western blot analysis
与正常组比较,噪声组大鼠海马区CRF表达明显增加,差异有统计学意义(P<0.01);氟西汀组CRF的表达较正常组增加,但较噪声组表达降低,各组间比较差异均有统计学意义(P<0.05)。
3 讨论
噪声是一种恶性应激源,除了损害听觉系统,还激活自主神经系统,引起范围更广的生理反应如心率增加、血压升高、肌肉收缩,并释放与应激相关的激素引起机体兴奋和焦虑等[5]。无论急性应激还是慢性应激,超过了机体调节和耐受限度,往往会诱发或导致疾病的发生。研究表明噪声能增加皮质酮的释放水平,其对身体的影响不是突然的或毁灭性的,而是隐伏和日益严重的,噪声应激和生理系统对应激反应的平衡机制的破坏可能是噪声引起疾病的原因[6]。
噪声暴露使人出现耳鸣、耳聋、失眠、记忆力减退等症状,严重者可产生精神心理症状。早期研究表明噪声暴露导致儿童注意力、解决问题的能力和记忆力下降,严重影响学业成绩[7];Cui等[8]的研究表明噪声削弱大鼠的空间记忆力,损伤其海马神经细胞的再生并影响神经递质的传导。Fizza等[9]每天将大鼠在100dB SPL的白噪声环境下暴露4 h,持续15 d,通过旷场实验和悬尾实验观察其情绪行为变化,结果显示噪声导致大鼠产生抑郁焦虑样行为。旷场实验是通过观察动物(尤其是啮齿类动物)进入到一个四周封闭的空旷场地中产生的行为变化而研究其情绪的过程,目前已发展成为动物心理学方面尤其是抑郁、焦虑方面最常用评估方法之一;水平活动(总行程)和垂直活动(直立次数)反映动物的探索行为、兴奋性和运动水平[3,18,19]。本研究中,噪声组大鼠的旷场行为先表现为焦躁状态,我们平时观察也发现此阶段噪声组的大鼠易激惹,兴奋性高,攻击性强,随着噪声暴露的延长,其在规定时间内的运动、探索行为急剧减少,与抑郁症诊断中以阴性症状为主的精神运动改变有一定的相似性。快感缺失是抑郁症诊断的核心症状,糖水消耗量、糖水偏爱百分比是测量抑郁症模型动物是否存在快感缺乏的有效客观指标[4,18,19]。动物对糖水有与生俱来的喜好,噪声组大鼠对糖水的偏爱降低,与对照组差异性显著(P<0.01),表明长期噪声暴露后大鼠对幸福事件反应能力下降、兴趣缺乏,产生了抑郁样行为。氟西汀是一种选择性5-HT再摄取抑制剂(SSRI),是临床上常用的抗抑郁药物之一。大量报道证实,慢性不可预见性温和刺激动物模型是抑郁症研究中的稳定模型,而长期应用氟西汀可纠正此模型动物的异常行为[10]。我们在氟西汀组大鼠中将噪声暴露与抗抑郁治疗同步进行,结果显示氟西汀组大鼠的ABR反应阈与噪声组比较无显著差异(P>0.05),而旷场行为和糖水偏爱的改变介于对照组与噪声组之间,表明氟西汀确实对噪声所致的大鼠情绪行为改变产生了积极的治疗作用,但对听力无改善作用。
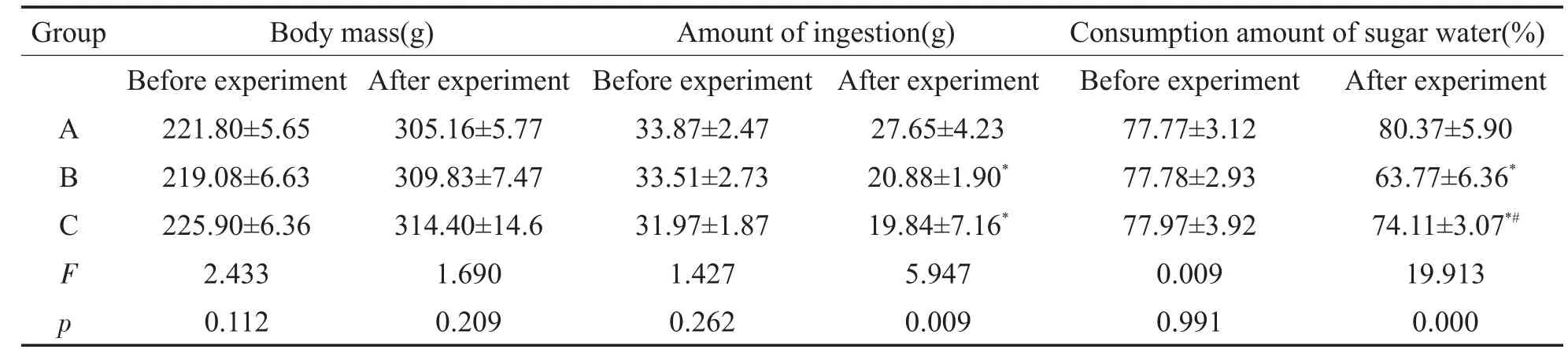
表2 各组大鼠体重、摄食量和糖水偏爱的比较(x±s,n=8)Table 2 The body mass,amount of ingestion and consumption amount of sugar water of the rats in each group(x±s,n=8)
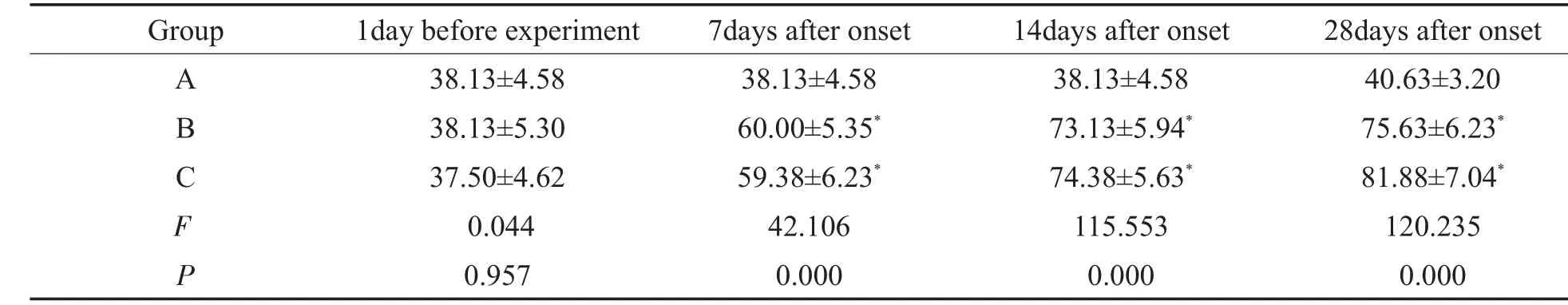
表3 噪声暴露后各组大鼠ABR反应阈(dB SPL)的改变(x±s,n=8)Table 3 TheABR thresholds(dB SPL)of rats in each group after noise exposure(x±s,n=8)
大脑通过下丘脑-垂体-肾上腺(HPA)轴及时释放激素调节机体对应激环境的反应。海马是介导应激反应的重要脑区,因其参与整合感知信息、解释环境信息的意义及调节行为反应和神经内分泌反应,所以与学习记忆、情绪调节等行为活动密切相关。Saida等[11]的研究表明海马5-HT和DA的减少可能是噪声暴露后大鼠的认知能力损伤的重要原因。促肾上腺皮质激素释放激素(CRF)是由下丘脑室旁核(PVN)分泌,作用于CRF受体,通过一系列基因表达促进合成与释放糖皮质激素,调控H-P-A轴的功能,被认为是应激反应调节的驱动因子[12]。研究表明CRF是联系神经系统与内分泌系统的桥梁,在情感障碍疾患如抑郁和焦虑的发病中发挥重要作用[13]。本研究中慢性噪声暴露使大鼠产生了焦虑抑郁样行为,并使大鼠脑海区的CRF表达显著升高(P<0.01),也证实了此观点。CRF亦可通过神经元间的突触联系调控蓝斑核NE系统与背缝核5-HT系统活性[14]。早期研究表明,慢性应激引起大鼠下丘脑与皮层中CRFmRNA表达升高,氟西汀可能通过抑制CRFmRNA表达的升高纠正HPA轴的过度激活,发挥抗抑郁作用[15]。刘昊等[16]在连续单一应激(SPS)前阻断大鼠5-羟色胺1A(5-HTlA)受体,检测其下丘脑CRF表达的改变,发现封闭5-HTlA受体能阻抑CRF表达,SPS应激可能通过5-HTlA受体活性上调下丘脑CRF分泌。本研究中,氟西汀组大鼠海马的CRF表达明显低于噪声组(P<0.01),说明5-HT再摄取抑制剂可以抑制海马CRF的表达,进而证实5-HT系统可能参与调节CRF的表达活性。
噪声可直接造成耳鸣、听力损失等耳科症状,临床上耳鸣病人也经常出现抑郁、焦虑等神经精神症状[17-19]。我们在前期研究中发现水杨酸钠致耳鸣大鼠的海马区域CRF表达增强,提示CRF表达升高可能是边缘系统参与耳鸣的重要机制之一[20-22]。因此,我们推测耳鸣和噪声应激可能导致机体产生了类似的病理生理效应,边缘系统CRF的表达在其中扮演了重要角色,为进一步研究耳鸣与抑郁的相互作用机制提供了新思路。
