慢性铝暴露对大鼠精子质量的影响*
2019-03-04,,,,,,,
,,,,,,,
(1. 右江民族医学院附属医院,广西 百色 533000;2. 右江民族医学院研究生学院,广西 百色 533000;3. 右江民族医学院医学检验学院,广西 百色 533000)
铝及铝制品广泛应用于生产和生活中,人类通过职业性、医源性和生活性接触铝。铝主要以离子形式被机体吸收,可分布并蓄积于脑组织、淋巴结、睾丸等多数软组织中。目前,铝对神经系统影响获得了较多研究者的关注[1-2],而铝对男性生殖尤其是精子质量影响的研究相对较少,其相关机制尚不清楚,而近年来有研究者发现,人的精液铝含量与精子质量减低存在相关性[3-4]。为此,本实验通过建立慢性铝暴露大鼠动物模型,探讨慢性铝暴露对大鼠精子质量影响及其与睾丸超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量的关系,为预防铝暴露引起精子质量减低提供理论基础和实验依据。
1 材料与方法
1.1 主要试剂与仪器 六水三氯化铝(上海阿拉丁生化科技股份有限公司生产),生理盐水(四川科伦药业股份有限公司生产),Medium 199营养液(美国Gibco公司生产),精子活体染色液(伊红-苯胺黑法)(北京索莱宝科技有限公司生产),SOD检测试剂盒(宁波美康生物科技有限公司生产),脂质氧化终产物丙二醛(MDA)检测试剂盒(上海碧云天生物技术有限公司生产);SCA 精子质量分析系统(西班牙Microptic S.L.公司生产),生物显微镜(日本Olympus公司生产),FSH-2可调高速匀浆机(常州市金坛友联仪器研究所生产),TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司生产),LABOSPECT 008 AS全自动生化分析仪(日本Hitachi公司生产)。
1.2 实验动物 清洁级雄性Wistar大鼠96只,体重180~200 g,由右江民族医学院实验动物中心提供(生产、使用许可证号:SYXK桂2017-0004),在实验开始前进行1周的适应性饲养。
1.3 实验方法
1.3.1 动物分组与建模 将96只实验大鼠编号,按随机数字表法分成4组,每组24只,参照孙浩[5]的实验设置方法,根据AlCl3致大鼠的半数致死量(Median Lethal Dose,LD50),结合大鼠每天的体重及饮水量,采用饮水法染铝:高剂量组[1/5 LD50,256.72 mg/(kg·d) ]、中剂量组[1/10 LD50,128.36 mg/(kg·d) ]、低剂量组[1/20 LD50,64.18 mg/(kg·d) ]及对照组[0 mg/(kg·d)]。根据大鼠精子发生的时程[6],饲养时长设置为2个精子发生时程约16周。
1.3.2 样本采集 饲养结束,给予大鼠禁食不禁水12 h,称量体重,以每100 g体重腹腔注射0.3 ml的10%水合氯醛进行麻醉。分离两侧睾丸及附睾组织,立即称重,睾丸组织用冰生理盐水冲洗并置于滤纸吸干,冰盒中操作将其切成小块,取组织块少许,加至预冷的冰生理盐水中制备成10%的组织匀浆,8000 g 4℃离心10 min,取其上清,置-20℃ 保存待测;附睾组织置于10 ml已预温至37℃的生理盐水中,剪碎,摇匀,37℃温育15 min,使精子充分游出;用70 μm孔径细胞滤网过滤,重复多次,至上清液变清,得到附睾精子悬液,待测。
1.3.3 精子质量分析 取附睾精子滤液200 μl,加入1 ml Medium199细胞营养液中,37℃温育2 min,取10 μl加到预温的精子计数板上,显微镜下数取300个精子,利用计算机辅助精子分析仪(CASA),参照世界卫生组织的精子运动分类标准[7],对精子进行分类计数,以精子的(a级+b级)作为前向运动(Progressive motility,PR),统计其百分比,检测工作于3 min内完成。同时使用伊红-苯胺黑染料,对精子进行活染,测定精子的死精子率。精子形态学检查使用伊红染色法进行。
1.3.4 睾丸组织匀浆SOD、MDA检测 用邻苯三酚自氧化显色法,经日立LABOSPECT 008 AS全自动生化分析仪,测定大鼠睾丸组织匀浆上清的SOD活力;MDA 含量的检测则采用硫代巴比妥酸(thiobarbituric acid,TBA)显色法,在紫外可见分光光度计上进行,检测分析步骤按试剂盒说明书进行。

2 结果
2.1 体重变化 在染铝第1周末,高剂量大鼠体重与对照组比较,差异有统计学意义(P<0.05);染铝第2周末,各剂量染铝组大鼠体重较对照组的差异均有统计学意义(P<0.05);染铝满4周后,中、高剂量组大鼠体重与低剂量组比较,差异有统计学意义(P<0.01),见图1。
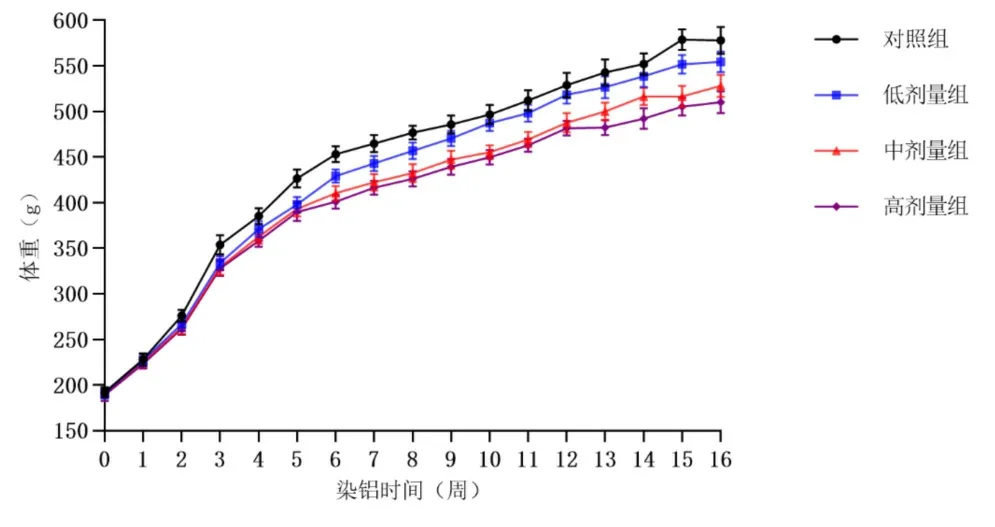
图1 染铝对雄性大鼠体重的影响
2.2 大鼠精子质量 持续喂养16周后,与对照组比较,各染铝组的前向运动精子百分比均表现为显著减低(P<0.01),而死精子百分比及异形精子百分比则显著升高(P<0.01),见表1。异形精子见图2。

表1 大鼠精子质量检测结果
注:分别与对照组前向运动精子(%)、死精子(%)、异形精子(%)比较,a、b、c:P均<0.01;分别与低剂量组前向运动精子(%)、死精子(%)、异形精子(%)比较,d、e、f:P均<0.01
2.3 睾丸SOD活性及MDA含量 与对照组相比,各剂量的染铝组睾丸SOD活性均明显减低(P<0.01),且中、高剂量组的SOD活性均明显低于低剂量组(P<0.01);睾丸MDA含量染铝组明显高于对照组(P<0.01),且中、高剂量组的MDA含量均明显高于低剂量组(P<0.05),见表2。
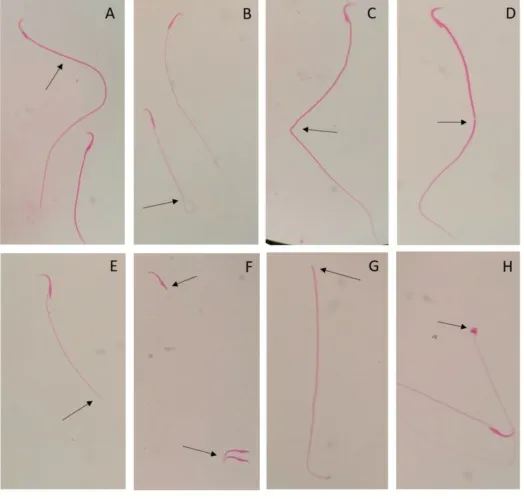
图2 大鼠精子形态图(伊红染色)
注:A:正常精子;B:卷尾;C:折尾;D:尾部鞘膜断裂;E:短尾;F:无尾;G:无头;H:头部畸形

表2 大鼠睾丸SOD活性及MDA含量检测结果
注:分别与对照组SOD、MDA比较,a、b:P均<0.01;分别与低剂量SOD、MDA比较,c、d:P均<0.05
2.4 大鼠精子质量与铝剂量、睾丸SOD活性及MDA含量的相关性分析 在铝染毒条件下,Spearman相关分析结果显示,前向运动精子精子百分比与铝染毒的剂量、MDA含量呈负相关(P<0.01),与SOD活性呈正相关(P<0.001);死精子及形态异常精子百分比与铝染毒的剂量、MDA含量呈正相关(P<0.001),与SOD活性呈负相关(P<0.001),见表3。进一步的分析结果显示,铝染毒剂量与睾丸SOD活性呈负相关(P<0.001),与MDA含量呈正相关(P<0.001),见表4。

表3 大鼠精子质量与染铝剂量、睾丸SOD活性及MDA含量的相关性分析

表4 染铝剂量与睾丸SOD活性及MDA含量的相关性分析
3 讨论
精子质量下降是生殖医学男科的常见问题,其发生与多种因素有关,有害物质暴露过量是其重要原因之一[8]。铝由于没有已知生物学功能,环境中常被视为有害物质[9-10]。本研究的实验结果显示过量的铝(1/5 LD50、1/10 LD50、1/20 LD50)可对大鼠体重增长产生影响,并且可降低精子质量。而Martinez等[11]的研究结果则表明,铝暴露量在人类日常饮食水平即可对大鼠精子产生负面影响,与本研究结果一致证实铝暴露可降低精子质量。
SOD是机体抗氧化系统中重要的金属酶类,正常生理情况下,机体的活性氧类物质(ROS)保持在较低水平,SOD在其中发挥着重要作用。生理条件下的低浓度ROS对精子是有益的,精子的活化、获能及顶体反应中ROS都发挥着重要作用[12-13]。而精子发生过程中,由于形态结构的变化,精母细胞需要舍弃大量的细胞质转变精子,导致细胞质中的抗氧化酶大量丢失,造成精子抗氧化能力相对不足;精子膜含有高水平的多不饱和脂肪酸,而不饱和脂肪酸是ROS攻击的主要对象之一,这些因素使精子容易受到ROS的损害[14]。此外,线粒体是细胞内产生ROS 的重要场所[15],而精子细胞富含线粒体,其ROS产生相当活跃。因此,外部坏境的抗氧化作用对精子细胞尤为重要。而精子发生在睾丸进行,睾丸的抗氧化系统对于精细胞至关重要。本实验结果显示,染铝组睾丸组织中SOD 活性显著低于对照组,MDA含量显著高于对照组。提示铝染组大鼠睾丸组织抗氧化系统受损,不能有效地清除组织内的氧自由基,氧自由基作用于细胞内脂质使其发生过氧化反应,使脂质过氧化的最终产物之一的MDA含量升高。本实验的结果还显示,精子质量积极指标的前向运动精子精子百分比与铝染毒剂量、睾丸组织MDA含量呈负相关,精子质量消极指标的死精子及形态异常精子百分比与铝染毒剂量、MDA含量呈正相关,铝染毒剂量与MDA含量呈正相关。而睾丸组织中的 MDA 含量升高会影响到生殖功能[16],精子质量与 MDA 含量呈负相关[17]。可见铝染毒剂量的增加引起的精子质量的进行性下降,与睾丸组织MDA含量增加有关。
综合本实验的结果,铝可对大鼠精子质量产生负面影响,并且随着铝剂量的增加,精子质量下降明显。结合各组大鼠睾丸SOD活性及MDA含量的差异,铝对精子质量的影响可能与脂质过氧化有关,其分子机制有待进一步研究。
