纳米氧化铜对水中三价砷的吸附特性及机理研究
2019-03-02韦安磊宋进喜
李 琦,高 欢,韦安磊,宋进喜
(西北大学 城市与环境学院,陕西 西安 710127)
砷是一种存在于地壳中的微量元素。水体中的砷一方面来自风化溶解等自然因素, 另一方面来源于人类工业活动, 比如冶金、 采矿、 制药等产生的副产物[1]。 自然水体中砷通常以+3价或+5价的无机砷形态存在,无机砷为原生毒物,能抑制具有重要生理功能的多种酶的活力,长期接触或饮用高浓度的含砷水体可导致多种癌症发生,并且As(III)比As(V)毒性更强[2]。随着全球工业的不断发展,水体砷污染日益加剧。为了保护公众用水安全,2001年,美国环保局(EPA)与美国国家科学院[3]联合声明对于水中砷浓度不应高于10μg/L。近年来,由于矿业活动的频繁,我国14省20多个湖泊出现了严重的砷污染问题,砷检出浓度高达1 900 μg/L[4]。此外,安建博等[5]调查发现,西安市某县5个自然村饮用水源长期存在超标现象,As(Ⅲ)含量高达(25.64±8.43)μg/L。
国内外含砷废水目前较为成熟的处理技术有混凝/沉淀法、离子交换法、生物膜法、吸附法等[6-8]。其中,吸附法由于不引入新的污染物,周期短等优点处理含砷废水更为理想。目前,被广泛用于去除水体砷的吸附剂包括铝,铁,锰,钛和磷酸铁等[9-12]。由于在去除砷的过程中常规的吸附剂受到很多因素的限制,比如受水体pH影响、水中共存的多种竞争阴离子影响、吸附缺乏动力与选择等,使得吸附有效性降低[13]。Reddy K J等[14]在实验中偶然中发现氧化铜相比其他吸附剂有较好的吸附效率,并且不受溶液pH范围、溶液中氧化还原电位及共存阴离子影响。
近年来,越来越多的研究开始将纳米级的吸附材料应用于砷废水的处理中。例如,锰纳米颗粒、铁纳米颗粒、二氧化钛纳米颗粒、氧化铜纳米颗粒等[15-17]。相比常规吸附剂,纳米级吸附剂具有更大比表面积,吸附效率更高。
纳米氧化铜由于其高效性和适应性强而受到广泛关注, 虽然对于纳米氧化铜吸附其他污染物质的研究已经有相关文献报道, 但未有文献对As(III)的吸附过程进行系统研究。本研究通过水热法合成CuO-NPs作为吸附剂,探究CuO-NPs对As(III)的吸附效果。并且,结合透射电镜(TEM),XRD(X射线衍射)和XPS(X射线光电子能谱)表征手段,分析吸附前后以及反应过程中可能的吸附机制,以期为CuO-NPs的应用和重金属治理提供试验依据。
1 材料与方法
1.1 试剂与仪器
试剂:乙酸铜(C4H6CuO·H2O)、硝酸(HNO3)、氢氧化钠(NaOH)、无水乙醇(C2H5OH)均为分析纯,购于广州化学试剂厂;试验中用水均为超纯水。
仪器:透射电子显微镜(JEM-2100F,日本)、X-射线衍射仪(XRD-7000S/L,岛津)、pH酸度计(pHS-3C,上海)、原子吸收分光光度计(AA-6300C,岛津)、X射线光电子能谱仪/俄歇能谱仪(AXIS ULTRA; 英国)。
1.2 CuO-NPs的制备
水热法制备CuO-NPs[18]。将2.5g的乙酸铜溶解于100mL的无水乙醇中,混合后滴入1.0g的氢氧化钠,搅拌30min后移入聚四氟乙烯内衬的高压反应釜中,将反应釜置于120℃烘箱中恒温2h,反应完成后冷却至室温,产物经离心分离后,用无水乙醇及蒸馏水洗涤数次,然后将产物置于真空干燥箱恒温80℃干燥24h。
1.3 吸附实验
将0.1g的纳米氧化铜加入装有0.1L不同初始浓度的As(III)溶液的聚丙烯离心管中密封避光,于250r/min的转速下依次振荡一定时间,吸附温度25°C,溶液初始pH值通过加入0.1mol/L HNO3和0.1mol/L NaOH调节至2~12。所有试验均设置3次平行。
1.4 分析方法
1.4.1 CuO-NPs的表征 透射电子显微镜表征CuO-NP的形貌;X-射线衍射仪分析CuO-NPs的晶体结构,步长0.02°,扫描速度4°/min。
1.4.2 溶液中As浓度测定 采用GB-T 6730.67-2009测定吸附后的溶液As(III)的浓度。吸附量qe计算公式如下:
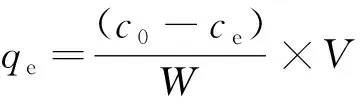
(1)
式中:C0和Ce为吸附前、 后吸附质的浓度(μg/L),W为吸附剂的用量(g),V为溶液的体积(L)。
2 结果与讨论
2.1 CuO-NPs的表征
由图1可知,水热法制备所得的CuO-NPs呈均匀的球形结构,平均粒径在20~50nm,而且CuO-NPs颗粒没有发生明显的团聚,分散性良好。这表明水热法制得的CuO-NPs颗粒具有较好的化学稳定性。

图1 CuO-NPs的TEM图Fig.1 TEM image of CuO nanoparticles
图2表明,在2θ=32.5°,35.6°,38.8°,48.7°,53.4°,58.3°,68.1°处出现尖锐的衍射峰,并且2θ=35.6°,38.8°处出现的衍射峰宽而强,在与氧化铜标准图谱对照,属于氧化铜的特征峰,说明实验样品为氧化铜,且结晶完整,为单斜晶系。根据衍射图谱对应晶面所得数据,选取最强的7个衍射峰(110,11-1,111,20-2,020,202,022),利用Scherrer公式进行晶粒粒径估算,表达式如下:
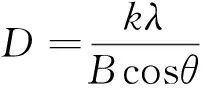
(2)
式中:D为粒径;k为Scherrer常数;k=0.89;λ为测量样品时X射线波长(0.154 056nm);B为实测样品衍射峰的半高宽度;θ为衍射角。计算得出CuO-NPs晶体晶粒粒径在20~50nm,说明所形成的晶体晶粒尺寸为纳米级别尺寸。
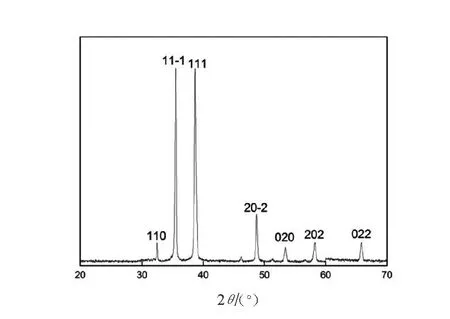
图2 CuO-NPs的XRD图Fig.2 XRD of CuO nanoparticles
零电荷点pHPZC是指材料表面正负电荷相等时的pH。由图3可知,CuO-NPs的pHPZC为7.8。这说明,当溶液pH≤7.8时,CuO-NPs表面呈正电性,有利于溶液体系中阴离子的吸附去除;当溶液pH>7.8时,CuO-NPs表面呈负电性,有利于溶液体系中阳离子的吸附去除。
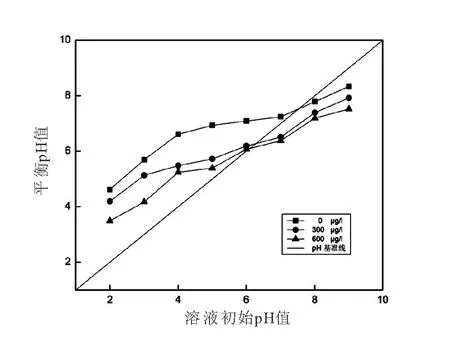
图3 不同浓度As(III)溶液中的CuO-NPs的pHPZC变化Fig.3 The point of zero charge of CuO nanoparticles
2.2 pH对吸附As(III)的影响
pH是影响纳米氧化铜去除水中As(III)的重要因素。实验在As(III)初始浓度为600μg/L,CuO-NPs投加量为0.1g条件下,分析pH在3~11时的As(III)去除情况(图4)。由图4可知,在pH=3~8情况下,CuO-NPs对As(III)的去除率随着pH升高而增加,在pH=8时去除率达到最大值97.05%。当pH≥9时,去除率随着pH升高有所降低。
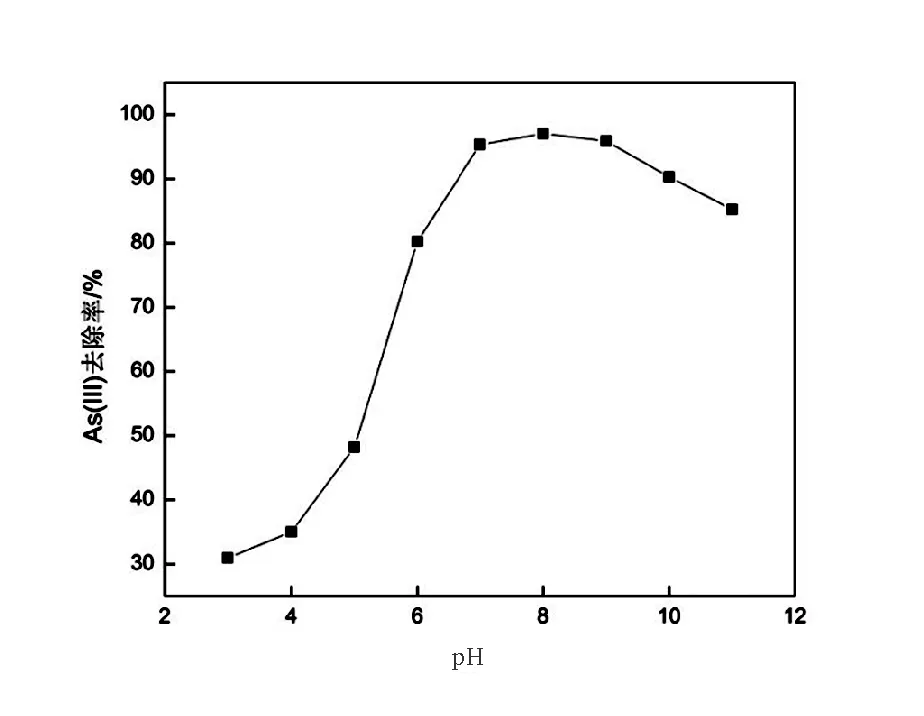
图4 CuO-NPs在不同pH下对As(III)的去除率Fig.4 Effect of pH on the percentage adsorption of arsenic(III)
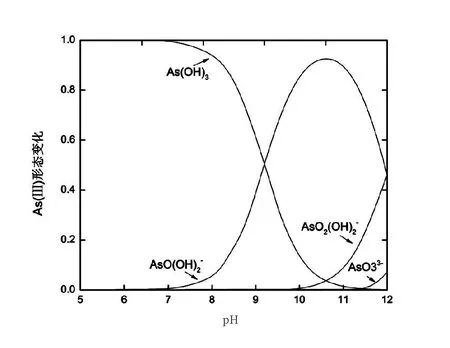
图5 不同pH条件下As(III)的形态分布Fig.5 Morphological distribution of As (III) under different pH conditions
当溶液中存在300μg/L,600μg/L的As(III)时,CuO-NPs的pHPZC由7.8分别下降至6.5和6.1(图3)。这表明CuO-NPs在吸附As(III)后,其表面电负性增强。通常而言,金属氧化物表面羟基官能团的质子化和脱质子化过程决定了其pHPZC[18]。当金属氧化物吸附某种物质时,若仅形成外层络合物,由于二者之间没有发生化学反应,则其pHPZC不会被改变。那么,若pHPZC出现下降,则意味着金属氧化物表面形成了带负电的阴离子络合物[19]。在本研究中,CuO-NPs吸附As(III)后,出现了pHPZC降低,这表明As(III)在CuO-NPs表面形成了带负电的内层络合物。
2.3 吸附等温模型
等温吸附模型是通过对吸附过程中实验数据的拟合来研究吸附剂对吸附质的化学吸附行为。通过Langmuir方程(公式3)和Freundlich方程(公式4)来对CuO-NPs对As(III)吸附实验数据进行拟合。其表达式如下所示:
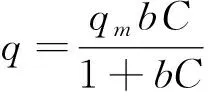
(3)
q=kFC1/n
(4)
式中:q为As(III)平衡吸附容量,μg/g;qmax为单层饱和吸附量,μg/g;C为吸附平衡时溶液中砷离子浓度,μg/L;b为Langmuir常数,L/μg;KF和n为是Freundlich吸附平衡常数。
CuO-NPs吸附As(III)的等温吸附模型拟合图及拟合参数值如图6,表1所示。可以看出,等温吸附实验结果与Langmuir等温模型拟合度高。表1中Langmuir等温方程拟合后的线性相关系数为0.999 8,高于采用Freundlich等温方程拟合的线性相关系数0.957 0,由此说明Langmuir方程更适合描述CuO-NPs对As(III)的吸附过程。
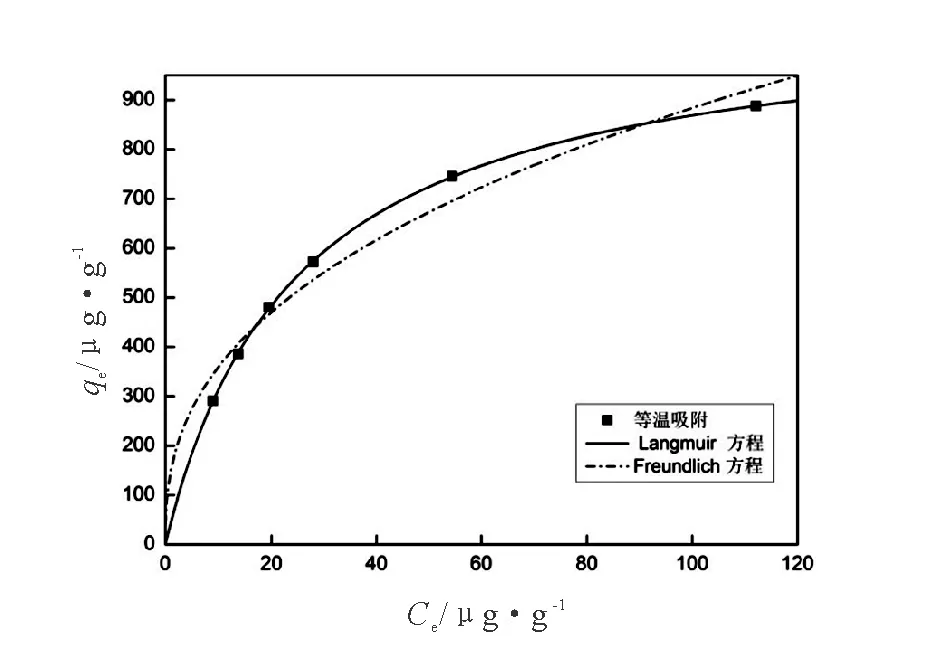
图6 CuO-NPs吸附As(III)的等温吸附拟合图Fig.6 Equilibrium isotherm model for arsenic(III) adsorption
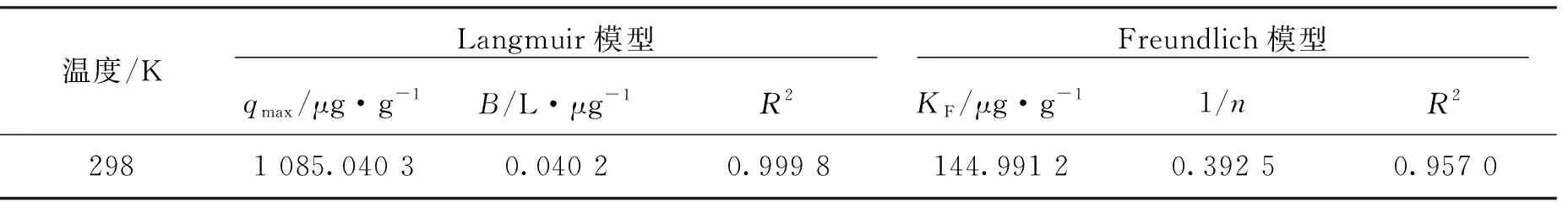
温度/K Langmuir模型 Freundlich模型 qmax/μg·g-1B/L·μg-1R2KF/μg·g-11/nR22981 085.040 30.040 20.999 8144.991 20.392 50.957 0
此外,在Langmuir吸附等温方程中,可定义一个无量纲的分离因子RL,它表示吸附过程的性质。表达式为
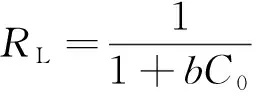
(5)
RL=0非可逆吸附;0
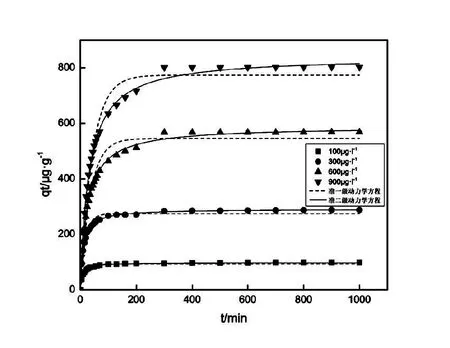
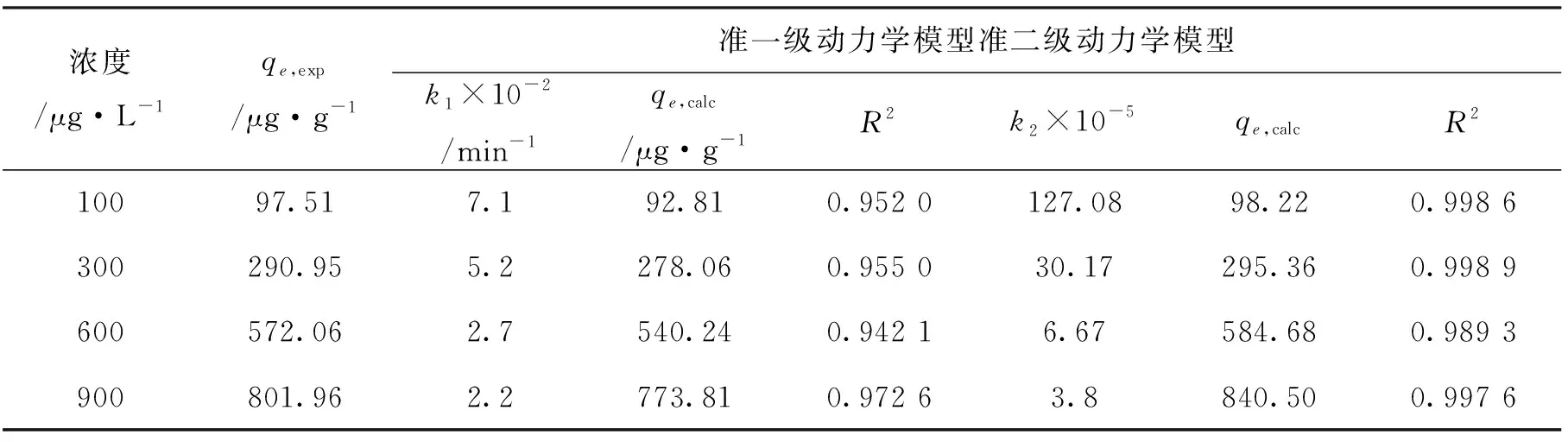
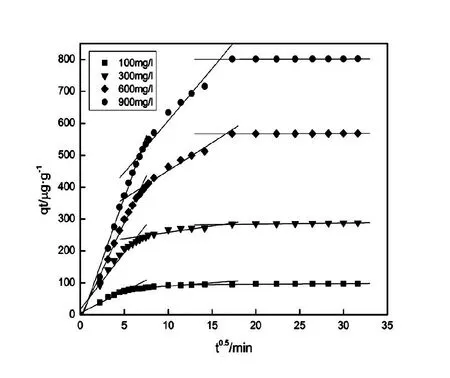
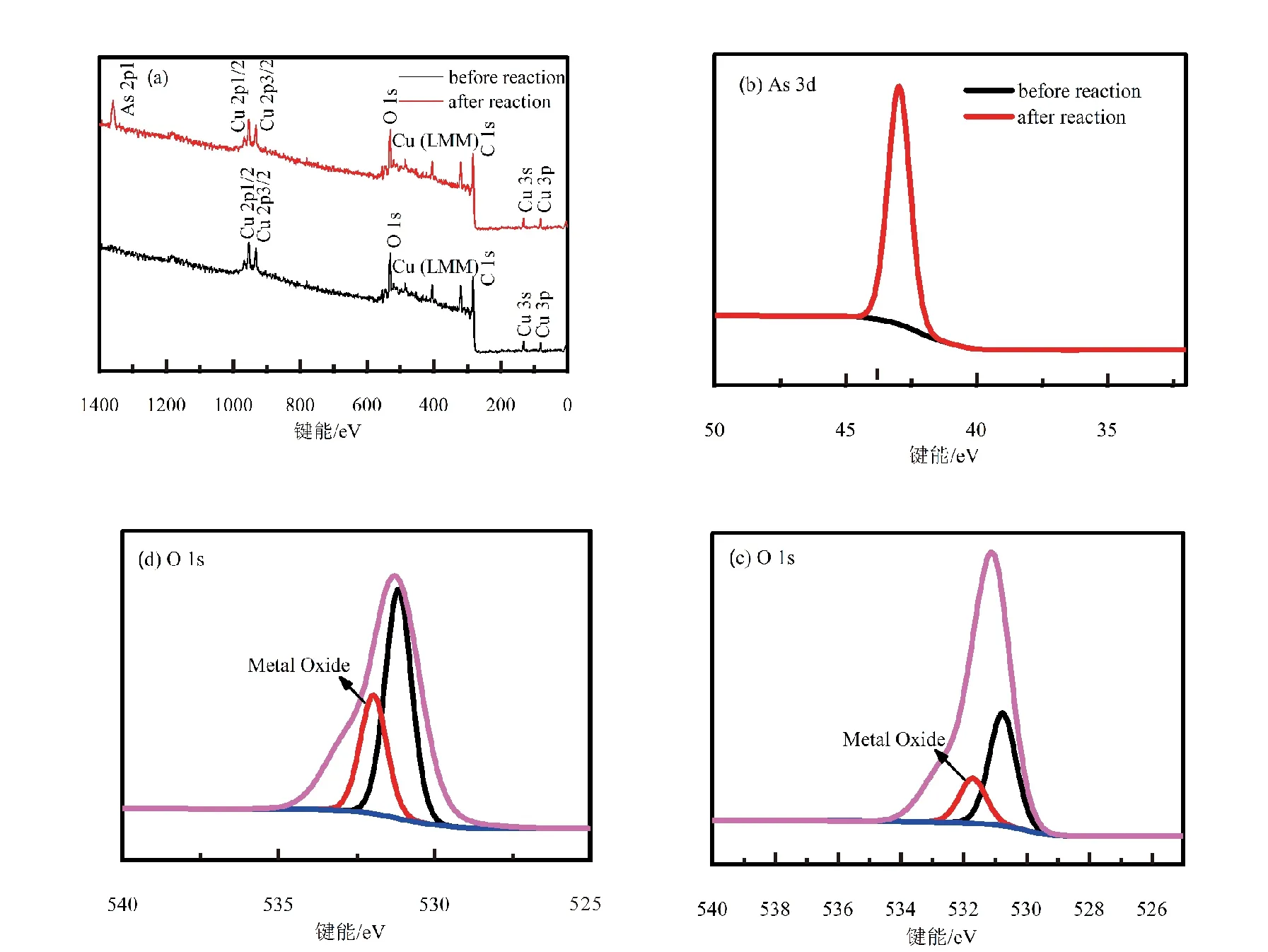
本次实验中分离因子0 陈云嫩等[20]采用巯基乙酸改性麦糟吸附水中的As(III),最大吸附容量为252.300 μg/g;Sathishkumar等[21]用Aspergillus fumigatus菌体吸附去除As(III),发现最大吸附容量为538.900 0 μg/g;相比而言,本研究的最大吸附容量为1 085.040 3 μg/g,这说明纳米氧化铜具有较高的吸附特性。 CuO-NPs对As(III)的吸附动力学曲线如图7所示。 由图可知, CuO-NPs对As(III)的吸附在前100min内速率较快, 100min后速率逐渐减慢, 400min后趋于平衡。 此外, As(III)初始浓度越高, 吸附达到平衡需要的时间越长。 这是由于CuO-NPs表面的吸附点位是一定的[18], 随着As(III)浓度的增加,需要投加更多量的CuO-NPs,提供充足的吸附点位来满足As(III)的吸附,吸附达到平衡时间也就越长。 对CuO-NPs吸附As(III)的吸附动力学数据采用准一级动力学模型式(6)、准二级动力学模型式(7)及粒内扩散模型式(8)进行拟合。表达式如下: qt=qe(1-e-k1t) (6) (7) qt=kpt0.5+C (8) 式中:qe和q2为准一级动力学模型和准二级动力学模型的平衡吸附量,mg/g;t为吸附时间,min;qt为t时刻的吸附量,mg/g;k1为准一级反应速率常数/min-1;k2为准二级反应速率常数,g/(μg·min)-1;kP是颗粒内扩散速率常数,mg/(g·min0.5);C是吸附常数。 图7 CuO-NPs吸附As(III)的吸附动力学Fig.7 Effect of contact time on arsenic(III) adsorption 准一级及准二级动力学模型拟合参数值列于表2。可以看出,准二级动力学模型计算得到的不同As(III)浓度下平衡吸附量和实验数据更为相近,模型的相关系数皆大于准一级动力学模型。由图7可看出,准二级动力学模型拟合程度更好。因此,准二级动力学模型能更好的描述CuO-NPs吸附As(III)的吸附过程。这说明该吸附过程是化学吸附过程,包括多个反应机制的过程,如As(Ⅲ)在溶液体相或界面处的扩散、表面的活化与去活化作用等[19]。随着As(III)浓度的增加,准二级反应速率常数K2不断减小,表明浓度越高,吸附达到平衡时的反应速率越小。 表2 CuO-NPs吸附As(III)的动力学参数值Tab.2 Kinetics parameters of the pseudo-first-order model and the pseudo-second-order model for arsenic(III) adsorption 图8为As(III)在CuO-NPs的粒内扩散模型图。粒内扩散模型图呈现两种结果,一种是内扩散模型图为一条直线,此时吸附过程受粒子内扩散控制,若这条直线通过原点说明粒子内扩散为唯一的决速步骤。另一种模型图呈现多段线性,说明吸附过程复杂且受多个决速步骤控制。 图8 CuO-NPs对As(III)的粒内扩散模型Fig.8 The intra particle diffusion model for arsenic(III) adsorption 由图8可以看出,吸附过程为三段线性,表明吸附过程复杂。第一阶段As(III)吸附量随t0.5不断增加,说明As(III)在CuO-NPs上进行边界层扩散;第二阶段相比第一阶段趋势线的斜率变小,吸附量增加变慢,这是受到颗粒内扩散的影响;第三阶段的斜率几乎为零,说明此时吸附趋于饱和,吸附达到平衡状态。 为研究吸附过程中的热效应,实验采用吸附热力学公式得出吸附焓ΔH,吸附熵ΔS及不同温度下的吸附自由能ΔG。吸附热力学公式如下: (9) (10) ΔG=-RTlnKd (11) 式中:R为气体常数,8.314J/(mol·K),b为Langmuir 吸附常数。 从表3可以看出,不同温度下ΔG均为负值,说明CuO-NPs对As(III)的吸附过程是一个自发的过程,且温度越高自发的程度越大。ΔH值和ΔS值分别为146.207 1KJ/mol,0.529 3J/(mol·K)。焓变ΔH为正,表明反应是吸热反应。熵变ΔS为正,说明吸附过程在固液界面的无序性增加。 表3 CuO-NPs吸附As(III)的热力学参数值Tab.3 Thermodynamic parameters for arsenic(III) adsorption 溶液pH=8时,CuO-NPs对As(III)的去除率达到最大,这主要是由于As(OH)3与纳米氧化铜水合物之间发生了较强的配位交换(式(11))。当溶液呈酸性时,As(III)主要以As(OH)3形态存在(图5),呈电中性,而此时CuO-NPs对As(III)的去除率较低。这主要是由于酸性条件较强导致的CuO-NPs表面质子化不利于配位交换的发生。当溶液pH>8时,形态为As(OH)2O-的As(III)逐渐增多,此时As(III)的去除则逐渐以As(OH)2O-与CuO-NPs水合物之间的配位交换为主(式(13))。然而,由于CuO-NPs的零电荷点为7.8,随着溶液碱性的增强,吸附剂表面负电性逐渐增大。这使得CuO-NPs与As(OH)2O-之间静电排斥逐渐增强,因此,pH>8时,CuO-NPs对As(III)的去除率逐渐降低。 >Cu—OH+As(OH)3→—Cu—OH—As(OH)2 (12) >Cu—OH+As(OH)2O-→—Cu—OH—As(OH)O- (13) 图9 反应前、后样品XPS谱图Fig.9 XPS spectra before and after the reaction 图9为吸附As(III)前、后的CuO-NPs样品的XPS图谱。吸附过程结束后,吸附材料的全谱分析CuO-NPs表面存在As(图9(a)),而且结合能在43.1 eV处的峰值进一步证实了As(III)被CuO-NPs吸附(图9(b))。图9(c)和(d)为吸附As(III)前后材料表面的O 1s高分辨率XPS谱线的分峰图。吸附As(III)后,结合能在529.0~530.0 eV处的分峰增强(图9(c)),这表明CuO-NPs表面金属氧化物中的氧含量相对增加。此外,结合能在531.5~532.0 eV处的分峰也略微增强图(9(d))。这可能是As(III)氧化态水合物样品与空气中二氧化碳作用所致。以上分析表明,吸附前后CuO-NPs样品表面金属氧化物所含的O化学键发生了显著变化,吸附过程发生了化学吸附。这也与式(2)和(3)所描述的配位交换作用相一致。 1)采用水热法成功制备了化学稳定性较好、平均粒径为20~50nm的CuO-NPs。 2)弱碱性条件有利于CuO-NPs吸附As(III);溶液pH=8时,CuO-NPs对As(III)的去除率最高,为97.05%。 3)As(III)在CuO-NPs上的等温吸附符合Langmuir方程,最大吸附容量可达1 085.040 3 μg/g,且吸附过程自发吸热、且符合准二级动力学方程。 4)CuO-NPs对As(III)的吸附,主要是通过氧化铜水合物与溶液中的As(OH)3和As(OH)2O-之间发生配位交换而实现。2.4 吸附动力学模型

2.5 吸附热力学模型
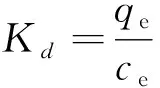
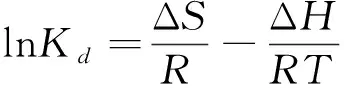

2.6 吸附机制
3 结 论
