丹酚酸A对ZDF大鼠肾脏的保护作用和抑制脂蛋白相关磷脂酶A2的研究
2019-03-01陈姣姣陈小真徐松涛施佳君马全鑫陈民利
陈姣姣,陈小真,郁 晨,徐松涛,施佳君,马全鑫,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
糖尿病(diabetes mellitus, DM)是严重危害人民健康的常见病、多发病之一[1],糖尿病肾病(Diabetic nephropathy, DN)是糖尿病代谢异常引起的肾小球硬化症,是DM常见的微血管并发症之一,是导致慢性肾功能衰竭最重要的原因之一,亦是导致糖尿病患者死亡的主要因素[2]。目前对DN 尚无特效的治疗方法,但中医药在控制 DN 症状及延缓病情发展方面有着极其重要的作用。
丹酚酸A(SAA)是丹参有效水溶性成分之一,具有广泛的药理活性,如抗炎、抗氧化、抗血小板聚集等[3-4]。目前已有多项研究表明SAA对糖尿病肾病有显著的改善作用[5-9]。糖脂代谢紊乱、炎症、氧化应激等多种危险因素促进DN发生与恶化,近年来,有研究发现脂蛋白相关磷脂酶A2(Lp-PLA2),是预测心血管事件的独立危险指标,也可反应肾脏损伤和动脉硬化的进展[10]。Lp-PLA2可通过促进炎症级联反应,阻断胰岛素受体信号的负反馈回路,加速DN发生与发展[11];而抑制Lp-PLA2可降低微血管通透性,改善糖尿病微血管病变[12]。本课题组前期研究也发现,SAA可减缓和改善糖尿病视网膜病变的同时,可显著降低糖尿病视网膜病变大鼠血清中Lp-PLA2的活性[13]。视网膜病变和糖尿病肾病均为糖尿病微血管并发症,故而推测SAA改善糖尿病肾病的作用机制可能与降低Lp-PLA2水平相关。因此,本实验自发性糖尿病大鼠Zucker Diabetes Fatty(ZDF)大鼠作为早期糖尿病肾病模型,观察SAA对ZDF大鼠肾脏的保护作用以及对Lp-PLA2的调节作用,为SAA的开发应用研究提供参考。
1 材料和方法
1.1 实验动物
SPF级7~8周龄雄性ZDF大鼠40只(体重200±10 g)及同周龄的雄性瘦型ZL大鼠8只(体重170±10 g),由北京维通利华实验动物技术有限公司提供[SCXK(京)2012-001];饲养于浙江中医药大学动物实验研究中心屏障实验室[SYXK(浙)2013-184],环境温度:(22±2)℃,相对湿度:50%~60%,光照:12 h/12 h明暗交替,噪声<50 dB;在IVC笼内饲养,自由饮食。经浙江中医药大学实验动物伦理审查委员会通过,决议编号: ZSLL-2015-72。
1.2 主要试剂与仪器
丹酚酸A粉针剂,由正大青春宝药业有限公司提供;Lp-PLA2抑制剂:darapladib,由中国科学院上海药物所提供。BUN、Crea试剂盒购自上海申能-德赛诊断技术有限公司;酶联免疫吸附法检测(ELISA)试剂盒:TRF、mALB、RBP购自杭州诚维生物有限公司;Lp-PLA2活性检测试剂盒,购自Abcam公司;PAS染色试剂盒,购自珠海贝索生物技术有限公司;RNA提取试剂盒(MiniBEST Universal RNA Extraction Kit)、逆转录试剂盒(One Step PrimeScript miRNA cDNA Synthesis Kit)和荧光定量试剂盒(SYBR Premix TaqTM Ⅱ),购自日本TaKaRa公司;Lp-PLA2抗体、羊抗(二抗),购自Abcam公司。
全自动生化分析仪(7020,日立公司,日本);Thermo多功能酶标仪(Varioskan Flash Thermo公司,美国);Nana Zoomer数字切片扫描设备(2.0 RS,滨松公司,日本);半自动石蜡切片机(RM2245,Leica公司,德国);自动染色机(Autostainer XL,Leica公司,德国);激光多普勒血流仪(ML191,埃德仪器国际贸易有限公司,澳大利亚);RT-PCR仪(iQ5型,Bio-Rad公司,美国);红外荧光扫描成像系统(CLx,Odyssey公司,美国)。
1.3 实验方法
1.3.1 分组与给药
取7~8周龄雄性ZDF大鼠40只,饲喂Purina#5008饲料,饲养4周后,根据体重与血糖值,分为5组,即模型对照组,SAA 0.25 mg/kg、0.5 mg/kg、1 mg/kg剂量组和阳性对照组,每组8只。另取8只同周龄ZL大鼠饲喂基础饲料,作为正常对照组。参考马全鑫等[12]的研究设置SAA各剂量组ZDF大鼠每日分别尾静脉注射SAA 0.25 mg/kg、0.5 mg/kg、1 mg/kg,阳性对照组大鼠每天经口灌服25 mg/kg darapladib,模型对照组和正常对照组每日一次经口灌服5 mL/kg生理盐水,连续给药12周。
1.3.2 肾功能与肾微循环血液流变学的变化
给药12周后,用大鼠代谢笼法收集24 h尿液,检测TRF、mALB、RBP的含量,另外,各组大鼠禁食不禁水12 h,尾静脉取血0.5 mL,分离血清,全自动生化仪检测Bun、Crea的含量。随后,各组大鼠经3%~4%异氟烷诱导麻醉后,将其仰卧位固定于鼠板上,并用1%~2%异氟烷维持麻醉,按外科手术方法打开腹腔,用激光多普勒血流仪检测双肾表面血流速度。
1.3.3 肾脏组织病理学观察
所有大鼠进行CO2安乐死后,取肾脏,甲醛固定,脱水,包埋切片,分别行苏木素-伊红(HE)染色与PAS染色,观察肾脏组织病理变化。
1.3.4 Lp-PLA2活性测定
给药前及给药4、8、12周时,大鼠禁食不禁水12 h,尾静脉取血0.5 mL,分离血清,使用ELISA试剂盒检测Lp-PLA2活性。
1.3.5 肾组织中Lp-PLA2基因和蛋白的表达
取部分肾组织提取总RNA,反转录成cDNA,设计Lp-PLA2引物(GAPDH: F:5’-GGCACAGTCAA GGCTGAGAATG-3’,R:5’-ATGGTGGTGAAGACG CCAGTA-3’,Lp-PLA2: F:5’-CTGACGGGACTTTT GTAACTGG-3’,R:5’-AGCCTTGTTGGTGAGGTC TATG-3’),使用RT-PCR仪将cDNA进行二步法扩增,所有反应信息资料由Bio-Rad iQ5 PCR仪收集。GAPDH基因作为内参对照,目的基因转录水平通过公式2-△△CT计算肾组织中Lp-PLA2 mRNA表达量。
同时,称取20 mg肾脏,加入裂解液进行匀浆处理,高速离心10 min,取上清至预冷的1.5 mL离心管中;按照 5∶1 的比例加入变性剂,在加热器上,加热5 min;按蛋白含量上样,浓缩胶恒压80 V(20 min),分离胶恒压 200 V,待溴酚蓝移至分离胶底部时,终止电泳。将蛋白转至 NC 膜上,电转200 mA,90 min,BSA封闭2 h,孵育一抗(1∶10000)过夜、孵育二抗(1∶10000)1 h,将NC膜放至Odyssey红外荧光扫描仪上进行扫描,分析蛋白条带,计算灰度值来反映肾组织中Lp-PLA2蛋白表达量。
1.4 统计学处理
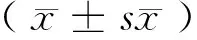
2 结果
2.1 SAA对ZDF大鼠肾微循环血流及肾功能的影响
与正常对照组比,模型对照组肾微循环血流速度变慢(P<0.01),与模型对照组比,给予0.5 mg/kg、1 mg/kg的SAA以及25 mg/kg darapladib后,均可显著提高微循环血流速度(P<0.05,P<0.01)。另外,模型对照组血清BUN明显高于正常对照组(P<0.01),除0.25 mg/kg的SAA外,其余各给药组的BUN水平均显著降低(P<0.05,P<0.01),但给药组Crea水平均无明显影响(P>0.05),见图1。
2.2 SAA对ZDF大鼠尿中TRF、mALB、RBP的影响
模型对照组ZDF大鼠尿TRF、mALB、RBP水平均显著高于正常对照组(P<0.01);与模型对照组比,0.5 mg/kg SAA组能显著降低尿TRF水平(P<0.05),1 mg/kg SAA组能显著降低尿TRF、mALB、RBP水平(P<0.01),darapladib组亦能显著降低TRF和RBP水平(P<0.05,P<0.01),见图2。
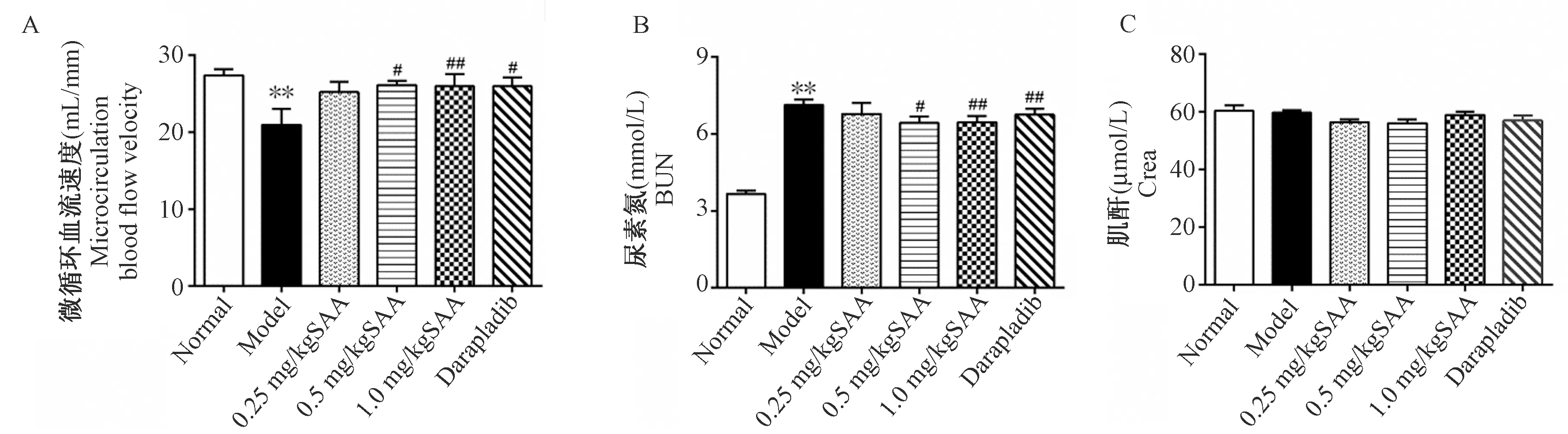
注:A为微循环血流速度,B为尿素氮水平,C为肌酐水平。与正常对照组比,*P<0.05,**P<0.01。与模型对照组比,#P<0.05,##P<0.01。图1 SAA对ZDF大鼠肾微循环血流及肾功能的影响Note. A: Microcirculation blood flow velocity, B: BUN level, C: Crea level; Compared with control group, *P<0.05, **P<0.01. Compared with model group, #P<0.05, ##P<0.01.Figure 1 Effects of SAA on renal microcirculation blood flow and function in the ZDF rats
2.3 SAA对肾脏组织病理的影响
HE染色显示,正常对照组肾小球结构完整,系膜区未见异常,无明显病理变化;模型对照组大鼠肾脏结构紊乱,系膜细胞明显增生、分布弥散,炎性浸润,可见显著性病变;各给药组肾脏组织病理有所改善,见图3-1;另外,PAS染色显示,正常对照组糖原沉积较少,着色较淡,结构完整,基底膜与系膜区无明显病变;模型对照组大鼠糖原沉积明显,着色较深,结构不清,肾小球系膜区增大,肾小管基膜增厚;各给药组大鼠结构明显改善,病变减轻,见图3-2。
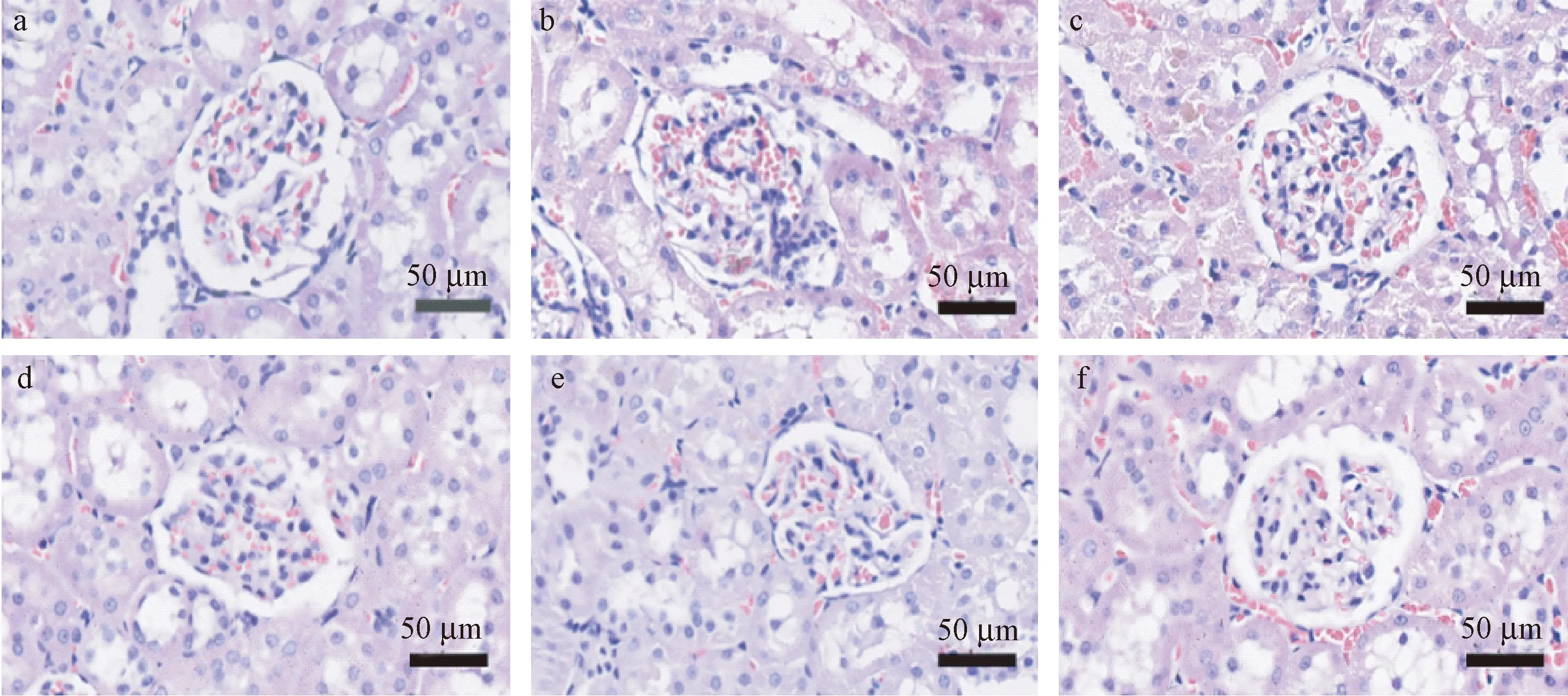
注:a:正常对照组,b:模型对照组,c-e分别为0.25 mg/kg、0.5 mg/kg、1 mg/kg SAA组,f:Darapladib组。图3-1 SAA对ZDF大鼠肾脏组织病理学的影响(HE染色, ×400)Note. a: Control group, b: Model group, c-e:0.25 mg/kg, 0.5 mg/kg, 1 mg/kg SAA group, f: Darapladib group.Figure 3-1 Effects of SAA on renal pathology in the ZDF rats(HE staining)
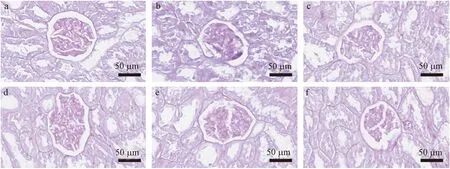
注:a:正常对照组,b:模型对照组,c-e分别为0.25 mg/kg、0.5 mg/kg、1 mg/kg SAA组,f:Darapladib组。图3-2 SAA对ZDF大鼠肾脏组织病理学的影响(PAS染色, ×400)Note. a: Control group, b: Model group, c-e:0.25 mg/kg, 0.5 mg/kg, 1 mg/kg SAA group, f: Darapladib group.Figure 3-2 Effects of SAA on renal pathology in the ZDF rats(PAS staining)
2.4 SAA对ZDF大鼠血清Lp-PLA2活性的影响
与正常对照组比,模型对照组 Lp-PLA2活性在给药前及给药后4、8、12周时显著升高(P<0.01);与模型对照组比,给予0.5 mg/kg和1 mg/kg SAA组和darapladib组 Lp-PLA2活性显著降低(P<0.05,P<0.01),见表1。
与正常对照组相比,模型对照组ZDF大鼠肾组织Lp-PLA2 mRNA与蛋白表达水平均显著升高(P<0.01);与模型对照组比,各给药组ZDF大鼠肾组织Lp-PLA2 mRNA表达均显著降低(P<0.05,P<0.01),同时,0.5 mg/kg和1 mg/kg SAA组和darapladib组均能显著降低ZDF大鼠肾组织Lp-PLA2蛋白表达(P<0.01),见图4。
3 讨论
ZDF大鼠是从出现糖尿病表型的Zucker 大鼠中筛选出来的,是一种自发性2型糖尿病大鼠,具有胰岛素抵抗,脂质紊乱、糖耐量异常等特征,在16周龄时可出现早期微血管并发症,包括早期肾病、视网膜病变、心肌病变较为突出,脑神经元轻微病变[14],在其20周龄时蛋白排泄和滤过异常,肾功能减退,逐步发展成为DN[15]。DN的临床症状主要有水肿、高血压、持续性蛋白尿,肾脏微循环血流障碍及尿生化指标异常[16-17]。本实验以Zucker 瘦型大鼠ZL 作为正常对照组,研究发现ZDF大鼠23-24周时也出现肾微循环血流速度显著下降,尿mALB,TRF和RBP等尿生化指标异常升高,肾小球基底膜增厚、糖原积累等病理学改变,与DN临床表现一致,表明ZDF大鼠DN模型成立。给予SAA的ZDF大鼠肾脏微循环血流速度增高、尿生化指标水平得到改善,肾小球和肾小管糖原沉积减少,系膜区与基底膜增生、增厚情况均明显减轻,与Hou等研究结果一致[8],提示SAA对DN具一定的保护作用。
mALB、TRF、RBP是诊断早期DN的独立风险因子[18],这些尿蛋白指标增高是肾脏发生肾小管损害、肾小球滤过障碍、血管内皮功能下降的有力证据,可被视为DN严重程度的量度。给予SAA后能明显降低尿TRF、mALB和RBP水平,且呈一定的剂量依赖性;同时也发现SAA干预后能显著降低血清中BUN水平,但对Crea无明显影响,这可能与本研究中的ZDF大鼠模型还处于DN早期阶段,以尿蛋白代谢紊乱为主,表明SAA对ZDF大鼠早期DN的蛋白代谢紊乱具有明显的改善作用;另外也发现给予darapladib后并未直接降低尿mALB水平,但可抑制尿TRF、RBP水平,提示darapladib可能通过抗炎作用[19],间接降低BUN,从而改善蛋白代谢紊乱,其机理还需进一步研究。

表1 SAA对ZDF大鼠血清Lp-PLA2活性的影响Table 1 Effects of SAA on serum Lp-PLA2 activity in the ZDF rats
注:与正常对照组比,*P<0.05,**P<0.01;与模型对照组比,#P<0.05,##P<0.01。。
Note. Compared with control group,*P<0.05,**P<0.01, Compared with model group,#P<0.05,##P<0.01.

注:A为Lp-PLA2 mRNA表达量,B为Lp-PLA2蛋白表达量;图B中a为正常对照组,b为模型对照组,c-e分别为0.25 mg/kg、0.5 mg/kg、1 mg/kg SAA组,f为Darapladib组;与正常对照组比,*P<0.05,**P<0.01;与模型对照组比,#P<0.05,##P<0.01。图4 SAA对ZDF大鼠肾组织Lp-PLA2表达的影响Note. A: Lp-PLA2 mRNA expression, B: Lp-PLA2 protein expression; In Fig. B, a: Normal group, b: Model group, c-e:0.25 mg/kg, 0.5 mg/kg, 1 mg/kg SAA group, f:Darapladib group. Compared with control group, *P<0.05,**P<0.01.Compared with model group, #P<0.05,##P<0.01.Figure 4 Effects of SAA on the renal mRNA and protein expression of Lp-PLA2 in the ZDF rats
Lp-PLA2是一种炎症性疾病的新型标记物,可水解氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)中的氧化磷脂,生成溶血磷脂胆碱(lysophosphatidylcholine, LPC)和氧化游离脂肪酸(oxidized free fatty acid, OX-NEFA)[20-21],二者具有促氧化、促炎等作用,损伤内皮细胞,诱导血管通透性障碍。苗艳等[22]对240名DN患者血清Lp-PLA2活性进行检测,发现其与尿微量白蛋白含量及DN严重程度呈正相关。在本研究中ZDF大鼠DN模型中的血清Lp-PLA2活性上升,肾脏Lp-PLA2的基因和蛋白表达显著升高(P<0.01),证实了Lp-PLA2的活性和在肾脏中表达水平与DN的严重程度有关。有研究表明给予Lp-PLA2抑制剂可通过降低空腹血糖和胰岛素水平改善胰岛素敏感性,从而在一定程度上修复糖尿病妊娠大鼠的代谢异常[23]。同样本研究中Lp-PLA2抑制剂(darapladib)干预ZDF大鼠后亦能在一定程度上改善DN状态;且0.5 mg/kg、1 mg/kg SAA能明显抑制ZDF大鼠血清中Lp-PLA2的活性及其在肾脏组织中的表达,这也证实了SAA具有抗炎作用,与Fan等报道一致[24]。由此提示,SAA可能是通过抑制Lp-PLA2的活性,降低机体慢性炎症状态;同时通过抑制Lp-PLA2在肾脏中的表达,改善肾小球血管通透性和肾组织局部的炎症微环境,从而起到保护ZDF大鼠肾脏的作用。
综上所述,SAA可改善2型糖尿病大鼠肾微循环和尿蛋白代谢紊乱,改善肾组织炎症,减缓DN的发展,其机制可能与抑制血清Lp-PLA2活性和抑制肾组织中Lp-PLA2的表达有关。
