奥司他韦在树鼩体内的药动及药效学应用研究
2019-03-01李润峰杨春光张云辉角建林张荣平夏雪山杨子峰
袁 兵,李润峰,杨春光,张 晟,张云辉,角建林,张荣平,夏雪山,杨子峰*
(1. 广州医科大学附属第一医院广州呼吸健康研究院(呼吸疾病国家重点实验室,国家呼吸系统疾病临床医学研究中心),广州 510120;2. 云南省第一人民医院呼吸内科昆明理工大学附属医院,昆明 650032;3. 昆明医科大学实验动物学部,昆明 650500;4. 昆明医科大学生物医学工程中心,昆明 650500; 5. 昆明理工大学生命科学与技术学院,昆明650505)
流感疾病严重威胁人类健康[1],目前常用于流感疾病研究的小鼠、雪貂等动物模型由于与人类种属差异过大,药物预见性较差,如小鼠流感致病机制与人类存在较大差异[2],临床模拟性和药物预见性较差,多种经小鼠模型验证有效的抗炎药止步于临床试验[3];另外小鼠、雪貂等模型动物在抗流感药物药代动力学参数方面与人相比差异较大,如人类口服奥司他韦的生物利用度大于75%[4],但是小鼠和雪貂的生物利用度仅为30%和11%[5]。因此开发一种能有效复制人类流感疾病特征和良好药物预见性的新型动物模型,对于开发和筛选新的抗流感药物或疫苗的疗效,评估抗病毒治疗方案具有重要价值。
树鼩(Tupaiabelangeri,familyTupaiidae)是一种形似松鼠的小型哺乳动物,在我国主要分布于云南、贵州、广西等地区。2013年中科院昆明动物所科学家发现树鼩与灵长类亲缘关系比小鼠等常用动物模型更为接近,在很多方面具有可用来替代猕猴等大型灵长类实验动物的遗传基础[6],已在病毒性感染疾病等多种疾病模型中获得广泛应用[7-8],在上世纪80年代树鼩已用于流感病毒研究[9]。本课题组进一步证实树鼩在流感症状、病毒复制,呼吸道受体分布等方面较其他常见流感动物模型与人流感疾病特征更具模拟性[10],然而抗流感药物在树鼩动物模型上的药代动力学以及药效学研究方面却未见报道。为开发这一新的动物资源,本研究通过检测奥司他韦在树鼩体内血浆中代谢产物浓度变化,估算其药代动力学参数,并与其他动物模型的奥司他韦药代动力学参数比较,为奥司他韦在树鼩体内的合理用药提供依据,在此基础上,进一步研究口服奥司他韦在树鼩体内能否有效抑制流感病毒排毒,以及对流感疾病症状的影响,为验证树鼩是一个具有良好药物治疗预见性的流感动物模型提供客观的依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
清洁级野生驯养树鼩80只,雌性,100~155 g, 12~15月龄,购自昆明医科大学医学实验动物学部 [SCXK(滇) 2013-0002]。购置后于昆明理工大学实验动物中心BSL-3级标准动物房中IVC装置笼具中饲养、实验 [SYXK(滇) 2011- 0004]。实验程序符合实验动物伦理委员会要求,动物使用的伦理审批号IACUC:KMU2017-M0016,按实验动物使用的3R原则给予人道的关怀。
1.1.2 病毒
人甲型流感病毒株(A/California/04/2009 H1N1)和A/Duck/HK/Y280/97 H9N2禽流感病毒突变株(H9N2 Y280-PB2-E627K)由香港大学惠赠;犬肾传代细胞(Madin-Darby canine kidney,MDCK)购自中国科学院典型培养物保藏委员会细胞库,由广州医科大学呼吸疾病国家重点实验室保存。
1.2 主要试剂与仪器
磷酸奥司他韦(批号:SC-18802)购自江苏倍达医药科技有限公司;F-12/DMEM培养液(批号:8117019)、胎牛血清(批号:10270-106)、0.25%胰蛋白酶Trypsin(批号:25200-056)、青霉素/链霉素溶液(100x)(批号:15140-122)购自美国GIBCO公司;TPCK胰酶(批号:T1426)购自美国Sigma公司;戊巴比妥钠(批号:P3761)购自广州捷倍斯生物科技有限公司;大鼠IVC独立送风隔离笼具(苏州冯氏实验动物设备有限公司)。
1.3 试验方法
1.3.1 动物分组
实验用树鼩取血清经血凝抑制实验检测证实A/California/04/2009 H1N1和A/Duck/HK/Y280/97 H9N2抗体为阴性,将动物随机进行以下分组:①奥司他韦药代动力学组:根据经口灌胃口服奥司他韦后取血时间,将树鼩分为0,0.25,0.5,1,1.5,2,4,6,8 和12 h组,每组4只,共计40只。②A/California/04/2009 H1N1感染组:树鼩随机分为A/California/04/2009 H1N1病毒组,奥司他韦高剂量(40 mg/(kg·d))给药组,奥司他韦低剂量(4 mg/(kg·d))给药组,每组6只动物,共计18只树鼩,每只树鼩经鼻接种A/California/04/2009 H1N1病毒106TCID50/250 uL。③H9N2 Y280-PB2-E627K感染组:树鼩随机分为H9N2禽流感病毒组,奥司他韦高剂量给药组,奥司他韦低剂量给药组,每组6只动物,共计18只树鼩,每只树鼩经鼻接种H9N2 Y280-PB2-E627K病毒106TCID50/250 μL。④正常对照组:设4只对照组,经鼻接种250 μL PBS。
1.3.2 奥司他韦药代动力学研究
40只树鼩禁食12 h(自由饮水)后,经口灌胃给予奥司他韦10 mg/kg,首次灌胃给药后记录给药时间,分别于给药后0、0.25、0.5、1、1.5、2、4、6、8 和12 h经尾静脉或股静脉采血0.5 mL,方法同文献[10],采集到的血液置于含肝素离心管中, 1500 r/min 4℃离心10 min,血浆转移至EP管中置-80℃深低温冰箱保存。
精确称取适量磷酸奥司他韦、羧基奥司他韦及内标帕拉米韦,用90%甲醇水溶液制成约1 mg/mL储备液,其中磷酸奥司他韦需折算成奥司他韦浓度,然后用甲醇逐级稀释成梯度工作溶液;内标帕拉米韦用甲醇配成1 μg/mL的工作溶液。分别取10 μL磷酸奥司他韦和羧基奥司他韦工作溶液,加入50 μL空白树鼩血浆,再加入130 μL含内标帕拉米韦的工作溶液,涡旋混合离心10 min,取上清液10 μL进样分析,其中磷酸奥司他韦血浆浓度依次为0.1、0.5、2.5、5.0、10、50、100、 200、 400、 800、 1500 ng/mL,羧基奥司他韦血浆浓度依次为 2.5,5.0,10,25,50, 250, 500, 2000和4000 ng/mL。,以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权(W=1/x)最小二乘法进行回归运算,求得的直线回归方程,经线性拟合,奥司他韦在0.1至200 ng/mL范围内成线性关系,线性方程为:y=0.00412x+0.000616 (r=0.97),绘制标准曲线见图1,根据标准曲线获得各血样检测结果,及对应的统计矩参数和药时曲线。
NOS1AP基因rs12742393位点多态性对瑞格列奈治疗我国汉族2型糖尿病患者疗效的影响 …………… 王 涛等(10):1347

图1 标准曲线Figure 1 Standard curve of the analytes
1.3.3 奥司他韦治疗对树鼩鼻腔排毒和细胞计数的影响
称取动物体质量,按奥司他韦高剂量和低剂量计算每日给药总剂量,分两次给药,于病毒接种前2 h给药,每日给药两次,连续给药5 d。每日观察树鼩鼻部症状,树鼩感染后第1、3和5天经腹腔注射3%戊巴比妥钠溶液麻醉后,吸取600 μL无菌PBS,从树鼩一侧鼻孔缓慢滴入,用90 mm2平皿收集鼻灌洗液,鼻灌洗液经800 r/min 离心取上清适量分装,鼻灌洗液沉淀进行细胞分类计数,收集的鼻灌洗液检测病毒滴度TCID50。
1.3.4 血清抗体效价检测
A/California/04/2009 H1N1和H9N2 Y280-PB2-E627K病毒感染组树鼩(包括病毒组,奥司他韦高剂量/低剂量给药组)饲养至病毒感染后第21天行安乐死,心脏取血后收集血清,分装至EP管中,-80℃保存备用,通过血凝抑制实验检测血清病毒中和抗体滴度。
1.4 统计学方法

表1 树鼩及其他动物模型奥司他韦药代动力学参数Table 1 Pharmacokinetic parameters of oseltamivir in the tree shrews and other animal models
2 结果
2.1 树鼩与其他几种流感动物模型药代动力学参数比较
树鼩口服给予磷酸奥司他韦10 mg/(kg·d),给药后血浆中奥司他韦的药时曲线见图2:树鼩口服奥司他韦给药后血浆中活性成分羧基奥司他韦的主要药代动力学参数如下:高峰血药浓度(Cmax)为1.34 μg/mL, 达峰时间(Tmax)为0.75 h,血清清除半衰期(T1/2)为2.03 h,血药浓度-时间曲线下面积(AUC0-12)为1.76 mg·h/liter。进一步查阅文献[5,11-12]比较其与大鼠、小鼠、雪貂及人口服奥司他韦后相应药代动力学参数差异(表1)。
2.2 奥司他韦对树鼩感染H9N2 Y280-PB2-E627K和A/California/04/2009 H1N1流感病毒药效学研究
在治疗后第1天,奥司他韦高剂量给药组树鼩鼻腔H9N2病毒排毒被明显抑制,至第3天奥司他韦高剂量给药组树鼩鼻腔已无排毒,病毒组和奥司他韦低剂量给药组鼻腔排毒明显减少(图3A);但树鼩感染A/California/04/2009 H1N1病毒后治疗第1天和第3天,奥司他韦对各组鼻腔排毒滴度基本没有影响,至治疗第5天时奥司他韦高剂量给药组树鼩鼻腔排毒较病毒组明显下降,有3/5的树鼩未再检出A/California/04/2009 H1N1流感病毒,而病毒组和奥司他韦低剂量给药组鼻腔灌洗液排毒虽然较前降低,但所有树鼩仍有排毒(图3B)。
感染H9N2 Y280-PB2-E627K和A/California/04/2009 H1N1流感病毒后,部分树鼩鼻腔灌洗液中黄色粘稠分泌物增多,在感染后第3天鼻腔灌洗液中细胞计数增加至高峰,细胞以上皮细胞和淋巴细胞为主,其中高剂量奥司他韦能够明显抑制H9N2 Y280-PB2-E627K病毒感染组鼻腔细胞总数(图4 A),但对A/California/04/2009 H1N1病毒感染各组鼻腔细胞总数无影响(图4B)。
2.3 奥司他韦对树鼩感染H9N2 Y280-PB2-E627K和A/California/04/2009 H1N1流感病毒血清抗体影响
树鼩感染人甲型流感病毒A/California/04/2009 H1N1和禽流感病毒H9N2 Y280-PB2-E627K后均能产生相应抗体,人甲型流感病毒A/California/04/2009 H1N1感染后产生的抗体效价(640-2560)明显高于禽流感病毒H9N2 Y280-PB2-E627K产生的抗体效价(160-640),奥司他韦抗病毒治疗对流感病毒抗体产生无明显影响(表2)。
3 讨论
奥司他韦口服吸收后可在体内转化为活性代谢产物奥司他韦羧酸盐[13],以人体代谢为例,奥司他韦活性代谢物在血浆中可在30 min内检测到,并在3~4 h后达到最大浓度,半衰期6~10 h[12],本项目药代动力学检测结果显示奥司他韦在树鼩体内的高峰血药浓度、达峰时间、血清清除半衰期(T1/2)、血药浓度-时间曲线下面积(AUC0-12)等与大鼠、雪貂和人各药代动力学参数间相差较大,仅药物达峰时间和血浆清除半衰期与小鼠相近,这些参数可在一定程度上指导奥司他韦在树鼩的应用。本研究中树鼩个体间药代动力学参数差异比较大,这可能与所用树鼩为野生驯养树鼩,遗传背景差异较大有关,研究人员可在后续动物实验中通过增大树鼩数量,以减少数据之间的误差。

注:与病毒组相比,*P<0.05。图3 不同毒株感染奥司他韦治疗后树鼩排毒滴度Note. Compared to the virus group, *P<0.05.Figure 3 Viral shedding in the tree shrews infected with different viruses after oseltamivir treatment

注:与病毒组相比,*P<0.05。图4 不同毒株感染奥司他韦治疗后树鼩鼻灌洗液细胞计数Note. Compared to the virus group, *P<0.05.Figure 4 Cell count in the nasal cavity lavage of tree shrews infected with different viruses after oseltamivir treatment
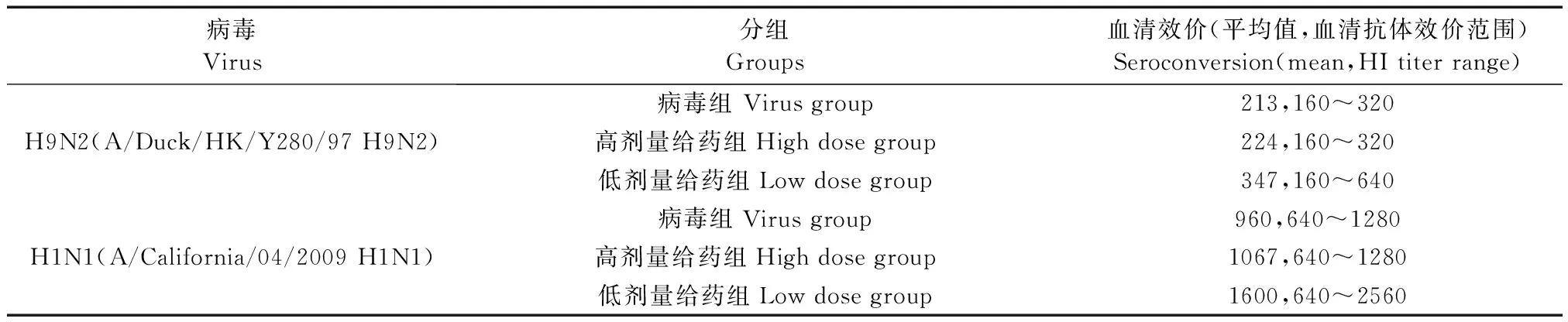
病毒Virus分组Groups血清效价(平均值,血清抗体效价范围)Seroconversion(mean,HI titer range)H9N2(A/Duck/HK/Y280/97 H9N2)病毒组 Virus group213,160~320高剂量给药组High dose group224,160~320低剂量给药组Low dose group347,160~640H1N1(A/California/04/2009 H1N1)病毒组Virus group960,640~1280高剂量给药组High dose group1067,640~1280低剂量给药组Low dose group1600,640~2560
注:高剂量给药量(40 mg/(kg·d));低剂量给药量(4 mg/(kg·d))。
Note. High dose(40 mg/(kg·d));Low dose(4 mg/(kg·d)).
在药效学研究中,课题组借鉴人采用每天两次,每次75 mg,共5 d足以抑制季节性流感病毒毒株的神经氨酸酶活性[14-15]特点,同时根据树鼩与人类及其它实验动物的体表面积进行等效剂量换算[16],以及前期实验树鼩鼻腔排毒时间(4~6 d),确定本研究奥司他韦给药剂量高剂量为40 mg/(kg·d),低剂量为4 mg/(kg·d),给药时间为5 d。本研究中树鼩感染A/California/04/2009 H1N1和H9N2 Y280-PB2-E627K流感病毒后,鼻腔可有效复制,规律排毒,其中感染人A/California/04/2009 H1N1病毒后鼻腔排毒滴度、排毒时间均大于感染H9N2 Y280-PB2-E627K禽流感病毒,甚至长于课题组先前的树鼩感染人甲型流感病毒(A/PR/8/34,GZ/02/09和SOIV/GZ/07/09)排毒时间[10],其可能原因与所用的A/California/04/2009 H1N1流感病毒属于2009年大流行人甲型流感病毒,对模型动物具有较强的致病力和毒力[17],另一方面也可能与经鼻腔接种病毒剂量高于先前实验(105TCID50)有关。奥司他韦羧酸盐属于选择性流感病毒神经氨酸酶抑制剂[12],能够有效抑制病毒从被感染的细胞中释放,从而减少流感病毒的传播[18],树鼩口服奥司他韦对其鼻腔排毒具有抑制作用,但不同给药剂量以及不同感染毒株之间存在较大差异,高剂量奥司他韦对A/California/04/2009 H1N1和H9N2 Y280-PB2-E627K流感病毒的抑制作用强于低剂量给药,其中对感染H9N2 Y280-PB2-E627K病毒树鼩的排毒抑制作用明显高于感染A/California/04/2009 H1N1病毒树鼩,这种差异一方面与所用毒株A/California/04/2009 H1N1毒力明显高于H9N2 Y280-PB2-E627K,奥司他韦在感染初期不能有效抑制树鼩鼻腔H1N1病毒复制,另一方面与奥司他韦对不同毒株的抑制作用存在差异有关[19]。
树鼩感染人甲型流感病毒A/California/04/2009 H1N1后产生的抗体效价明显高于H9N2 Y280-PB2-E627K禽流感病毒感染产生的抗体效价,其原因可能与流感毒株类型和毒力有关[20],病毒毒力强的毒株可产生的较高的抗体滴度,血清中产生的中和抗体,对病毒再感染可产生积极的免疫力[21]。而感染相同病毒的不同给药组和病毒组之间抗体效价接近,说明奥司他韦对病毒抗体效价的产生没有影响。课题组在前期研究发现H9N2 Y280-PB2-E627K流感病毒感染能够促进机体分泌炎症细胞因子和趋化因子,本研究中发现树鼩感染A/California/04/2009 H1N1和H9N2 Y280-PB2-E627K流感病毒后,在部分树鼩鼻灌洗液中含有黄色粘稠分泌物,细胞计数增加,以第3天为高峰,说明与其他模型动物研究类似,流感病毒感染可导致树鼩鼻部粘膜出现炎症反应[22],增加的细胞包括上皮细胞和炎性细胞,炎性细胞以淋巴细胞为主,而上皮细胞和炎症细胞能够分泌炎性细胞因子[23],促进与流感病毒感染相关的炎症反应。而高剂量奥司他韦给药组可以有效抑制了H9N2 Y280-PB2-E627K病毒复制,导致该组树鼩鼻腔中的细胞总数无明显上升,说明奥司他韦抗流感药物可以通过降低流感病毒滴度,减少流感相关的炎症反应。
综上,磷酸奥司他韦治疗能够降低树鼩鼻腔排毒,减轻相关炎症反应,说明该模型具有一定药物治疗预见性,可将其应用于抗病毒药物优化剂量研究[13],对机体有损害副作用的抗病毒药物[24]发生机制研究,以及耐药或新发流感病毒的致病机理研究,为流感疾病的研究提供了一个有效的动物平台工具。
