PD-1/PD-L1在小细胞肺癌中的临床研究进展*
2019-03-01综述宋霞审校
综述 宋霞 审校
肺癌是影响人类健康的重要疾病,其中小细胞肺癌(small cell lung cancer,SCLC)占肺癌总数的10%~15%[1],其发病机制与吸烟密切相关。SCLC侵袭性高,倍增时间短,增殖指数高,早期易发生转移[2],确诊时30%~40%的患者处于局限期,60%~70%的患者处于广泛期,患者5年生存率仅为2%~10%[3]。初期化疗成效明显,但复发后再次化疗往往无效[4],分析显示系统化疗对生存率无明显提高[5]。SCLC的发生和进展机制相对复杂,缺少相应的驱动基因,靶向治疗在SCLC中进展缓慢,急需寻找新的治疗靶点和药物预测标志物以改善SCLC治疗现状[6]。
近年来,肿瘤免疫治疗已成为除手术、化疗、放疗以及靶向治疗之外的另一重要治疗手段,其中程序分子-1(programmed death-1,PD-1)和程序性分子配体(programmed death-ligand 1,PD-L1)抗体免疫治疗具有特异性杀伤肿瘤细胞,并维持患者长期生存的潜在优势。目前已有研究表明SCLC易受免疫治疗方法的影响[7-8],为SCLC患者提供了新的希望。本文对PD-1/PDL1通路在SCLC中的作用及应用进行综述。
1 PD-1/PD-L1概述
PD-1属免疫球蛋白超家族成员。PD-1主要在活化的CD4+T细胞、CD8+T细胞等免疫细胞上表达,在肿瘤免疫逃逸中起着重要的作用[9]。PD-1的配体包括PD-L1和PD-L2。其中,PD-L1主要在抗原提呈细胞、B细胞、T细胞、上皮细胞表达,并且在NSCLC[10]、乳腺癌[11]、膀胱癌[12]等多种肿瘤细胞中也广泛表达。
PD-1/PD-L1信号通路对T细胞的活化起重要作用,而且能够抑制生长因子的生成和细胞增殖[13]。该通路异常激活抑制T细胞的活化和增殖,促进调节性T细胞的产生,使肿瘤细胞逃脱免疫系统的识别和杀伤[14]。PD-1和PD-L1在顺铂耐药的SCLC细胞系(H69R、H82R)中以较高水平表达,细胞PD1/PD-L1信号转导可能是顺铂治疗无效的途径,靶向针对PD-1/PD-L1途径可改善侵袭性SCLC的化疗敏感性[15]。
2 PD-1/PD-L1单抗在SCLC治疗中的应用
PD-1/PD-L1通路抑制剂通过抑制PD-1与PDL1结合,阻断负向调控信号,使T细胞活性受抑制的状态解除,从而令T细胞恢复活性增强免疫应答,达到内源性抗肿瘤。抗PD-1单抗的代表性药物有niv⁃olumab和pembrolizumab。PD-L1抗体代表性药物有atezolizumab、durvalumab、avelumab。
2.1 纳武单抗(nivolumab)
nivolumab是全人源化IgG4、抗PD-1抗体。2015年公布了CheckMate 017[16]和 CheckMate 057[17]结果,为nivolumab用于治疗NSCLC提供了理论依据。基于此结果,美国食品药品监督局(FDA)批准将nivolumab应用于经治的转移性或晚期NSCLC,促进了SCLC免疫治疗研究的开展。2016年CheckMate 032,研究主要评估nivolumab单药或nivolumab联合伊匹单抗(ipilimumab)治疗复发性SCLC的有效性和安全性[18]。该研究共纳入216例经治疗后疾病进展的SCLC患者,将其分为4组,第1组接受nivolumab,第2、3、4组分别接受不同剂量的nivolumab联合ipilimumab。该研究首要评价终点为客观缓解率(ORR),次要研究终点包括总体生存率(OS)、无进展生存时间(PFS)和生物标记物,结果显示,第1~4组ORR分别为10%、33%、23%和19%。nivolumab联合ipilimumab方案在早期治疗队列中有较好的疗效和耐受性,且与PD-L1表达或患者对铂类的敏感性无关。该结果促使研究者对这一队列进行了长期随访,并在晚期SCLC中进行随机扩增队列研究,进一步评估niv⁃olumab联合ipilimumab方案的疗效。
美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南 2017年第一版将 niv⁃olumab±ipilimumab作为复发SCLC二线治疗的推荐方案之一[19]。随后,2017年ASCO报道了CheckMate 032研究随机扩增队列的报告[20],在扩展队列中,247例患者被随机分配至nivolumab组和nivolumab联合ipilimumab组。结果显示,在既往接受过治疗的SCLC患者中,nivolumab和nivolumab联合ipilimumab治疗显示出持久的疗效。该研究证实nivolumab联合ipilimumab可以作为治疗复发SCLC的选择。
2017年WCLC报道了CheckMate 032研究对TMB进行探索性分析(https://www.ncbi.nlm.nih.gov/pubmed/29731394)。其中有211例TMB可评估患者,低TMB为69例,中TMB为69例,高TMB为73例。结果显示,高TMB患者nivolumab单药治疗的ORR为21.3%,PFS为1.4个月,联合治疗ORR为42.6%,PFS为7.8个月;单药组中,低、中、高TMB的中位OS分别为3.1、3.9、5.4个月,联合组中,低、中、高TMB中位OS分别为3.4、3.6、22.0个月。由此显示高TMB的SCLC患者相较低、中TMB患者联合免疫治疗获益明显。与PD-L1表达相比,TMB作为生物标志物更适合预测SCLC免疫治疗应答。
2018年8月FDA批准nivolumab用于经铂化疗和至少一种其他疗法治疗过的转移性SCLC。本次获批是基于Checkmate 032研究的ORR(12%)和DoR(17.9个月),所以nivoluamb成为20年来获批治疗小细胞肺癌的新疗法。
CheckMate 331研究对nivolumab与拓扑替康或氨柔比星对一线治疗后复发SCLC的疗效进行了头对头比较,该项临床试验于2015开始,计划入组480例患者,实际入组803例患者,所有患者被随机分为两组,分别接受nivolumab静脉注射治疗、拓扑替康或氨柔比星化疗。试验的主要终点是治疗12个月后的OS,次要终点是PFS及ORR。2018年宣布试验失败。结果显示,与复发性SCLC二线标准拓扑替康或氨柔比星化疗相比,nivolumab未能显著延长OS,没有达到研究的主要终点。该研究中nivolumab的安全性与以往涉及SCLC患者单药研究中所观察的结果一致。参加试验的患者中肿瘤PD-L1表达情况是否是其影响因素有待进一步证实(https://news.bms.com/press-release/corporatefinancial-news/bristol-myers-squibb-announces-phase-3-checkmate-331-study-doe)。正在进行的CheckMate 451研究Ⅲ期,比较了nivolumab单药、nivolumab联合ipilimumab与安慰剂在ED-SCLC维持治疗的疗效,试验就SCLC是否进行免疫维持治疗以及选择哪种免疫治疗维持方案进行探索。
2.2 帕博利珠单抗(pembrolizumab)
pembrolizumab是抗PD-1单抗。2015年ASCO公布了KEYNOTE 028研究结果,该研究主要评估对象为初始化疗失败且PD-L1阳性的广泛期SCLC患者,予pembrolizumab单药治疗,主要研究终点为ORR。结果显示,20例治疗患者中7例患者部分缓解,ORR为35%,中位缓解时间为8.6周[21]。研究表明pembrolizumab对于治疗广泛期SCLC具有较好疗效。2018年ASCO上公布的KEYNOTE 158[22]是一项Ⅱ期临床试验研究,评价pembrolizumab的抗肿瘤活性,共纳入了11个癌种患者,包括SCLC。针对既往治疗失败、或进展、或对标准治疗不耐受的晚期SCLC患者,给予pembrolizumab单药,主要终点指标是ORR、DoR和PFS,OS是次要终点指标。结果显示,107例SCLC患者中,总体ORR为18.7%,PD-L1阳性肿瘤患者ORR为35.7%,PD-L1阴性肿瘤患者ORR为6.0%;所有患者的中位PFS为2.0个月,PD-L1阳性患者为2.1个月,PD-L1阴性患者为1.9个月;中位OS总体为9.1个月,PD-L1阳性患者为14.6个月,PD-L1阴性患者为7.7个月。pembrolizumab单抗在晚期SCLC患者中表现出理想的抗肿瘤活性和持久反应,特别是在PD-L1阳性患者中疗效更为显著,与CheckMate 032显示出了不同的获益人群。美国临床试验数据库https://www.clinicaltrials.gov/中查询得到是pembrolizumab与化疗联合一线治疗广泛期小细胞肺癌的Ⅲ期随机、双盲、安慰剂对照性试验,该试验是pembrolizumab在SCLC一线治疗中的探索,旨在证实更早使用免疫抑制剂能否使SCLC患者更加获益。
2.3 阿特珠单抗(atezolizumab)
atezolizumab是全人源化的,针对PD-L1的IgG1同种型的工程化单克隆抗体,PD-L1抗体。2016年10月FDA批准atezolizumab用于既往含铂类化疗或靶向药治疗失败的转移性SCLC患者。
PCD4989g研究[23]是一项atezolizumab治疗包含SCLC在内的多种实体瘤的Ⅰa期研究。研究纳入17例SCLC患者,65%的患者既往接受三线以上治疗。结果显示中位PFS为1.5个月(95%CI:1.2~2.7),中位OS为5.9个月(95%CI:4.3~20.1)。初步的结果显示Atezo治疗ES-SCLC具有良好的耐受性,单药的疗效令人鼓舞,但是研究纳入的病例较少,需要更多的数据来支持临床。一线治疗研究IMPower 133是一项Ⅲ期、多中心、双盲、随机的安慰剂对照研究,评估了atezolizumab与化疗(卡铂加依托泊苷)联合相较于化疗对未经治疗广泛期小细胞肺(ES-SCLC)患者的疗效和安全性。研究共招募了403例患者,研究主要终点包括患者的PFS,以及OS。2018年发布的IM⁃power133试验结果显示[24],与单用卡铂和依托泊苷相比,在卡铂和依托泊苷中加入atezolizumab可显著改善OS和PFS。中位随访13.9个月,Atezolizumab显著延长OS(中位OS,12.3个月vs.10.3个月,HR=0.70,95%CI为0.54~0.91,P=0.007),两组中位PFS分别为5.2个月和4.3个月(HR=0.77,95%CI为0.62~0.96,P=0.02)。atezolizumab组对疾病的控制时间较对照组更长,这是免疫治疗SCLC里程碑式的进展。IM⁃power 133成为20多年来首次显示在一线治疗获得OS大幅改善的针对ES-SCLC的免疫组合疗法Ⅲ期试验方案,这将可能成为一线治疗ES-SCLC的新标准。
2.4 度伐鲁单抗(durvalumab)
durvalumab是人免疫球蛋白IgG1单克隆抗体,PDL1抗体。2017年WCLC公布了MEDIOLA研究结果https://library.iaslc.org/search-speaker?search_speaker=49493。该研究是durvalumab联合在DNA修复中发挥重要作用的PARP抑制剂Olaparib治疗多瘤种的篮子研究。研究纳入38例SCLC患者,其中1例PR,1例CR,12周DCR为29%。研究认为,durvalumab+olaparib治疗SCLC具有良好的耐受性,可能有长期的临床获益。
2018年ASCO公布了NCT01693562研究结果(摘要号8518http://ascopubs.org/doi/abs/10.1200/JCO.2018.36.15_suppl.8518)。该研究将durvalumab单药用于广泛期SCLC,纳入21例(其中20例经治)广泛期小细胞肺癌患者,接受durvalumab 10 mg/kg,每2周1次。结果显示,ORR为9.5%,2例PR,DCR为14.3%。有效的患者中,1例初治患者疗效持续14.6个月,另1例(铂类耐药既往三线化疗后)疗效持续了25.5个月以上。中位PFS为1.5个月,12个月的PFS率为14%,中位OS为4.8个月,12个月的OS率为27.6%。虽然小样本研究,但是研究结果展现了durvalumab在广泛期SCLC的初步疗效。
同期公布了NCT02261220研究结果(摘要号8517http://ascopubs.org/doi/abs/10.1200/JCO.2018.36.15_suppl.8517),报道了durvalumab联合tremelimumab用于ED-SCLC治疗的安全性和有效性。研究中纳入30例既往接受过全身治疗的患者(治疗中位数为2)。最终结果显示经确认的ORR为13.3%,中位缓解持续时间为18.9个月,中位PFS为1.8个月,中位OS为7.9个月,12个月OS为41.7%。安全性方面,20例患者(67%)报告≥1例AE(不良事件)或TRAE(治疗相关不良事件),最常见AE为疲劳(n=7[23%])和瘙痒(n=7[23%]),7例患者(23%)有3/4级TRAE,无患者因TRAE停药,无治疗相关死亡。从疗效以及安全性考虑双免疫联合或可成为ED-SCLC的一种治疗选择。
2.5 阿维单抗(avelumab)
avelumab是靶向PD-L1的人单克隆抗体。2017年3月FDA批准了PD-L1抗体avelumab用于治疗一种叫做默克细胞癌(MCC)的罕见皮肤癌。avelumab在SCLC领域的研究尚未有公布的结果,研究多采用联合策略。PAVE研究(NCT03568097https://www.clinicaltrials.gov/中查询得到),使用avelumab联合化疗用于晚期SCLC患者一线治疗的单臂开放标记Ⅱ期研究,纳入了55例SCLC患者,其结果将为SCLC一线治疗带来新思路。一项正在进行的名为JAVELIN Medley的研究(NCT02554812 https://www.clinicaltrials.gov/中查询得到),是avelumab联合其他免疫调节剂治疗局部晚期或转移性实体瘤成年患者的Ⅰb/2期开放标签、多中心研究,评价其安全性、临床活性等。其中在SCLC队列中使用avelumab+utomilumab治疗化疗进展后的SCLC直到疾病进展。期待这些研究结果的公布,为SCLC的治疗提供更多、更有效的治疗选择。
2.6 其他
国内有关PD-1/PD-L1单抗药物的多项研究也在进行,目前在新药申请阶段的有BGB-A317/PD-1(BeiGene),SHR-1210/PD-1(Hengrui),JS001/PD-1(Junshi),IBI308/PD-1(Innovent),关于SCLC的研究,详见表1。
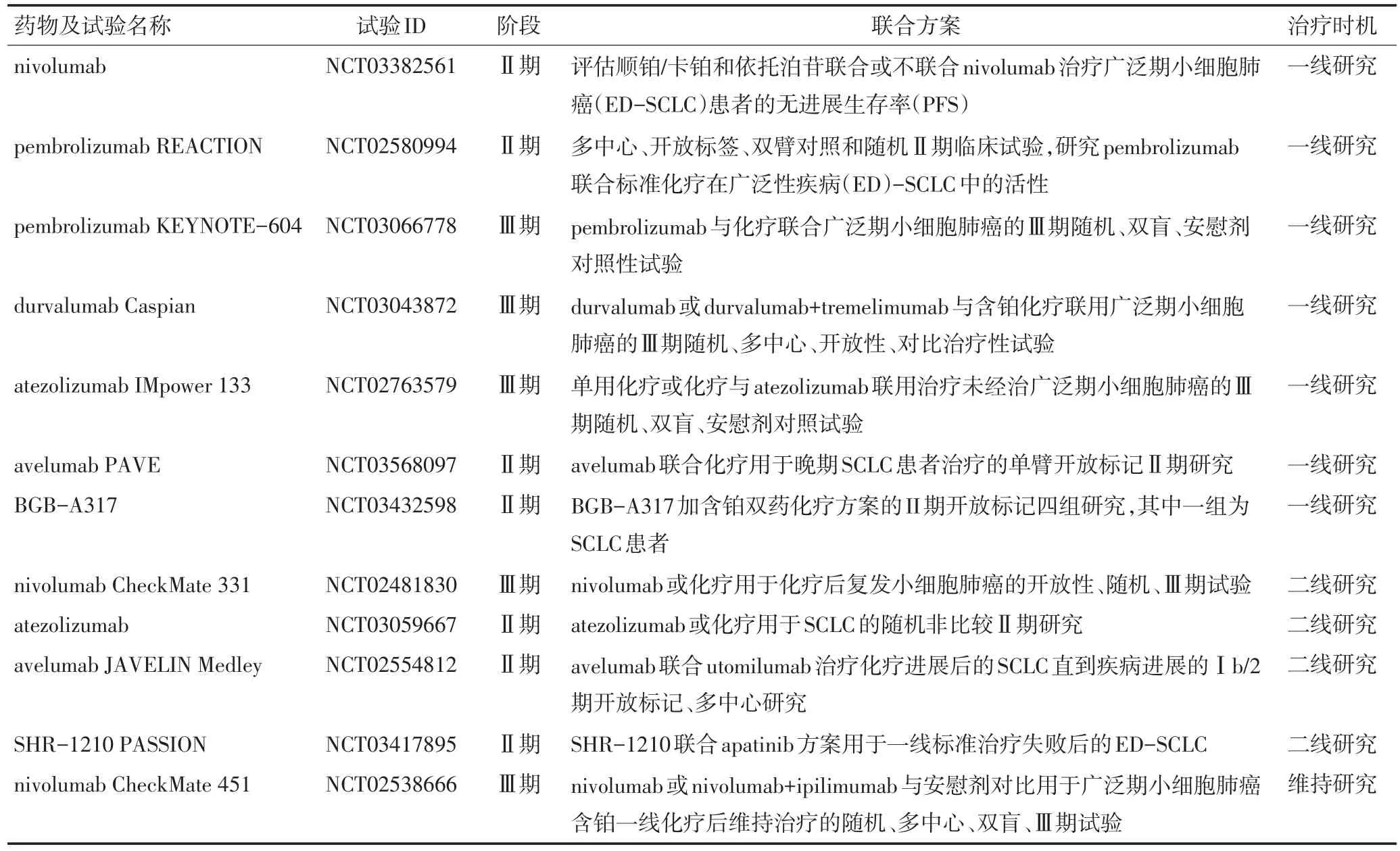
表1 正在进行中的抗PD-1/PD-L1治疗SCLC的临床试验
3 PD-L1表达及TMB在疗效预测中的作用
Wang等[25]发现放疗和免疫调节治疗后癌症患者外周血中PD-1的mRNA水平明显升高,为抗PD-1治疗提供线索。PD-L1表达广泛应用于多种肿瘤的免疫疗效预测。PCD4989gⅠ期研究,探索性分析发现PD-L1表达和PD-L1 mRNA表达与更长的PFS和OS相关。一项国内研究[26]显示在SCLC细胞系H446细胞中PD-L1高表达,并定位在细胞浆及细胞膜中。Keynote系列研究一贯以PD-L1表达作为生物标志物,兼顾简便性与经济性,且结果也令人鼓舞。
TMB是基因中发生突变的密码总量,TMB越高,致癌突变也就越多,和正常细胞也就越不相同。同样,肺癌突变负荷越大,对抑制PD-1通路的免疫治疗药物敏感性也越高[27]。在CheckMate 026研究[28]回顾性亚组分析以及2018美国癌症协会年会(AACR)年会上公布的CheckMate 227Ⅲ期临床试验研究的初步结果[29]也证实了TMB作为生物标志物选择一线NSCLC患者的作用,从而让研究者对TMB作为生物标志物更有信心。2018年4月CheckMate 032的回顾性研究[30]结果表明高TMB的SCLC患者从nivolumab联合ipilimumab治疗中获益最大,且无论是联合还是单药治疗,获得完全或部分反应患者的TMB均高于疾病稳定或疾病进展患者。可以看出SCLC免疫治疗反应中TMB有预测作用,但尚不清楚其分子多样性是否足以区分免疫治疗反应不同的临床亚组,目前只能得出TMB最高人群免疫治疗获益最多。而且目前仅在nivolumab的研究中使用TMB作为标志物的检测多为回顾性研究,需进一步证实TMB的预测作用。TMB检测相比PD-L1耗时较长、花费较高、需要更多组织,cutoff值界定也未统一,针对不同检测平台得到的结果一致性也有待探讨。
TMB或PD-L1表达以及联合使用,包括正在研究的标志物如可溶性程序性死亡配体1(sPD-L1)、肿瘤微卫星不稳定性(MSI)、DNA损伤修复(DDR)等都在进一步使SCLC患者在免疫治疗中获得更大的收益。
PD-1/PD-L1抗体治疗清除肿瘤细胞的原理及临床研究的验证,转变了人们对肿瘤治疗的认知。应科学评价免疫治疗疗效,探索将免疫治疗与其他治疗方式结合的最佳策略,找到目前最合适的预测因子,开发可以广泛普及的检测手段,以真正实现SCLC的精准化免疫治疗。
