105例残胃癌临床病理学特征及预后分析*
2019-03-01
残胃癌最初由Balfour等[1]于1922年首次提出,越来越多的研究者开始关注该疾病,其发病率较低,约占所有胃癌的1%~8%[2-3]。最初残胃癌被定义为由于良性疾病而行远端胃大部切除术5年后于残胃发生的原发性恶性肿瘤。随着疾病谱的变化及诊治水平的提高,残胃癌的定义不断被调整。一方面,随着新的质子泵抑制剂和H2受体拮抗剂的开发和应用,越来越多的消化性溃疡可以通过药物治疗治愈,而非手术干预。另一方面,由于胃癌诊断和治疗技术的不断提高,胃癌患者的生存期逐渐延长。因此,因良性溃疡性疾病行胃大部切除术后发生的残胃癌所占比例越来越小,因胃恶性肿瘤行胃大部切除术后发生的残胃癌正逐渐成为主流。2017年的日本第15版《胃癌处理规约》将残胃癌定义为行远端胃大部切除术后残胃内发生的恶性肿瘤,而不论初次胃部疾病的性质及初次手术与诊断残胃癌之间的时间间隔[4]。目前关于残胃癌的研究多为临床资料的回顾性分析,而鲜有针对相关分子机制的基础研究。残胃癌的病因包括:手术后残胃结构及功能的改变、初次胃癌的遗留及复发、HP感染及EB病毒感染等。由于大多数残胃癌在诊断时已处于进展期,预后通常较差。本文采用日本第15版《胃癌处理规约》中残胃癌的定义,收集相关资料进行回顾性分析,以探讨残胃癌患者的临床病理特征及与预后的关系。
1 材料与方法
1.1 病例资料
回顾性分析2004年5月至2017年7月天津医科大学肿瘤医院收治的105例残胃癌患者的临床病理和预后资料。纳入标准:1)组织病理学检查证实为胃腺癌;2)初次疾病良性组残胃癌(GSC-B)患者初次手术原因为胃良性溃疡所致穿孔或瘢痕梗阻;3)初次疾病恶性组残胃癌(GSC-M)患者初次手术原因为胃癌,并接受根治性手术。排除标准:同时合并其他原发性肿瘤。
1.2 随访
采用门诊、电话及信件等随访方式。接受根治性手术后,所有患者前2年均需每3个月或6个月随访1次,随后每年随访1次直至死亡。患者的生存时间为自诊断残胃癌起至死亡时间、随访截止时间或有效的末次随访时间。
1.3 统计学分析
采用SPSS 24.0软件进行统计学分析。生存率的计算采用Kaplan-Meier法计算,组间率的比较采用χ2检验,组间均数比较采用两独立样本t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 患者临床病理特征
105例残胃癌患者中,男性84例(80%),女性21例(20%),男性患者的比例明显高于女性患者;年龄为31~81岁,中位年龄为61岁。
2.1.1 GSC-B与GSC-M组患者的临床病理学特征比较 本研究中105例患者初次手术时疾病性质以恶性疾病为主,共68例(64.8%),良性者37例(35.2%)。通过χ2分析发现,GSC-B组患者年龄更大(63.22±8.95vs.58.93±10.06,P=0.003)、男性患者比例更高(94.6%vs.72.1%,P=0.006)、首次手术至发生残胃癌的时间间隔更长(390.95±95.18vs.64.53±73.15,P<0.001)、送检淋巴结总数更多(17.6±12.5vs.6.2±6.5,P<0.001),而GSC-M组患者肿瘤病理类型中分化不良者所占比例更高(83.0%vs.52.9%,P=0.002),其余临床病理学特点相比,差异均无统计学意义(表1)。
2.1.2 吻合口组与非吻合口组的临床病理学特征比较 根据残胃癌肿瘤部位不同将患者分为吻合口组和非吻合口组,分别为72例(68.6%)、33例(31.4%),吻合口组残胃癌患者比例明显高于非吻合口组。通过对比发现,两组间的年龄、性别、首次术后至诊断残胃癌的时间间隔、肿瘤大小及病理类型等临床病理学特征相比,差异均无统计学意义(表2)。
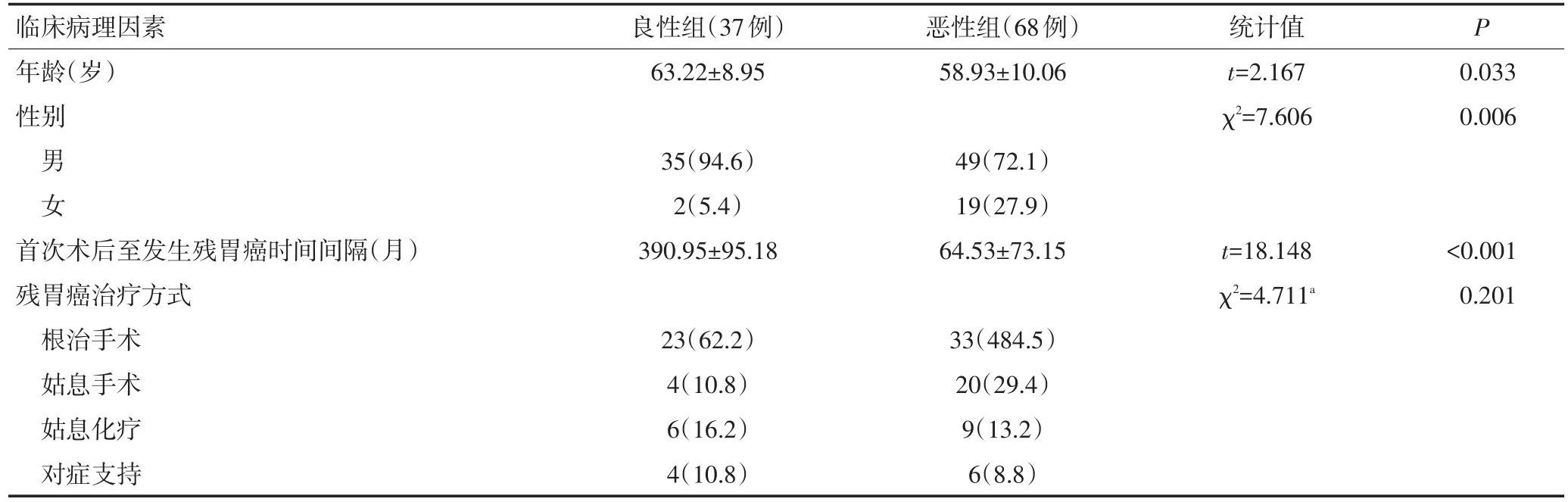
表1 GSC-B与GSC-M组的临床病理学特征比较
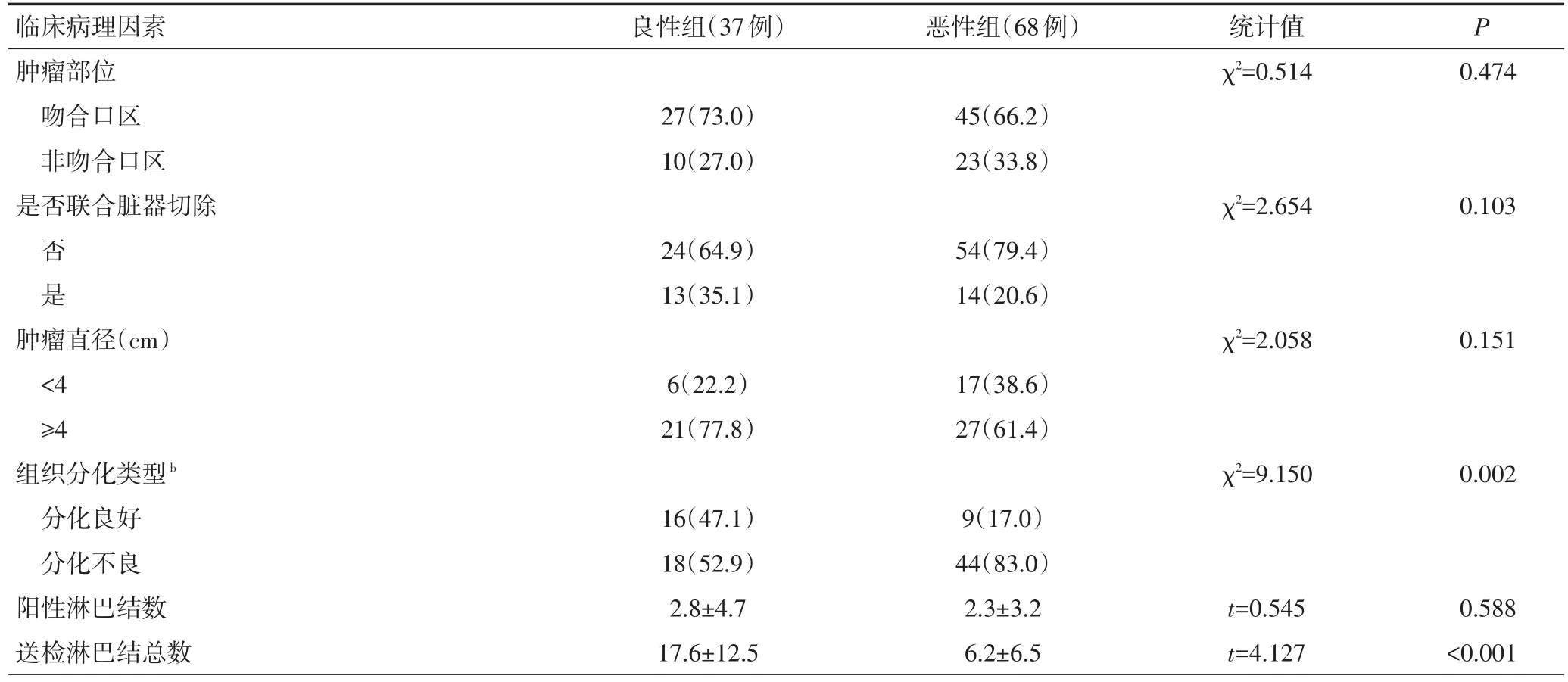
表1 GSC-B与GSC-M组的临床病理学特征比较 (续表1)
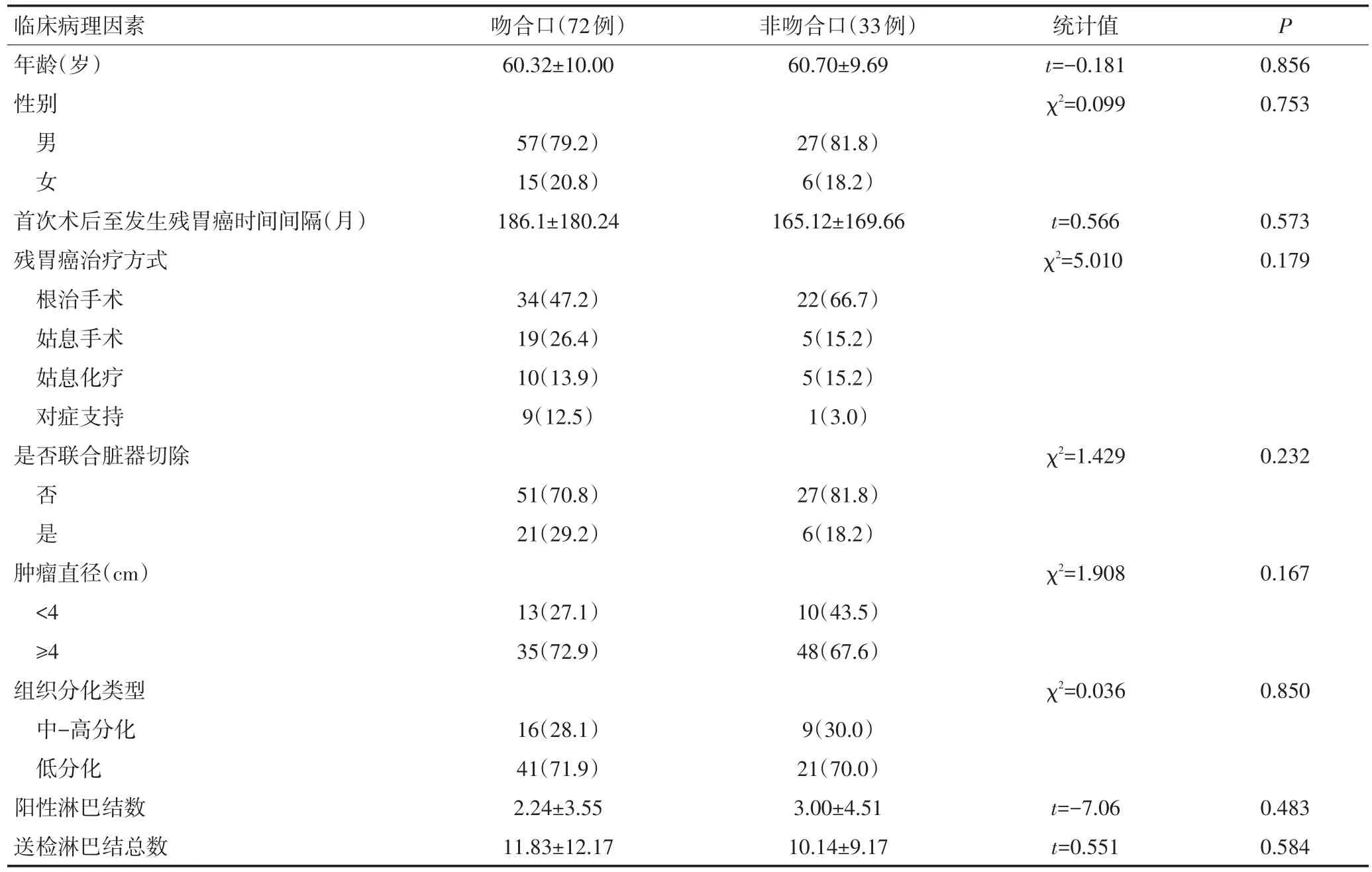
表2 吻合口组与非吻合口组的临床病理学特征比较
2.2 生存分析
本研究中所有患者的1年、3年及5年生存率分别为53.0%、26.0%及11.4%。而接受根治性切除的残胃癌患者的1年、3年及5年生存率分别为65.6%、41.3%及23.6%。对残胃癌患者进行单因素生存分析发现,远处转移及R0切除与患者的预后相关(均P<0.01,表3);将上述因素纳入COX回归模型进行多因素生存分析发现,R0切除是影响残胃癌患者生存的独立预后因素(P=0.02,表4)。
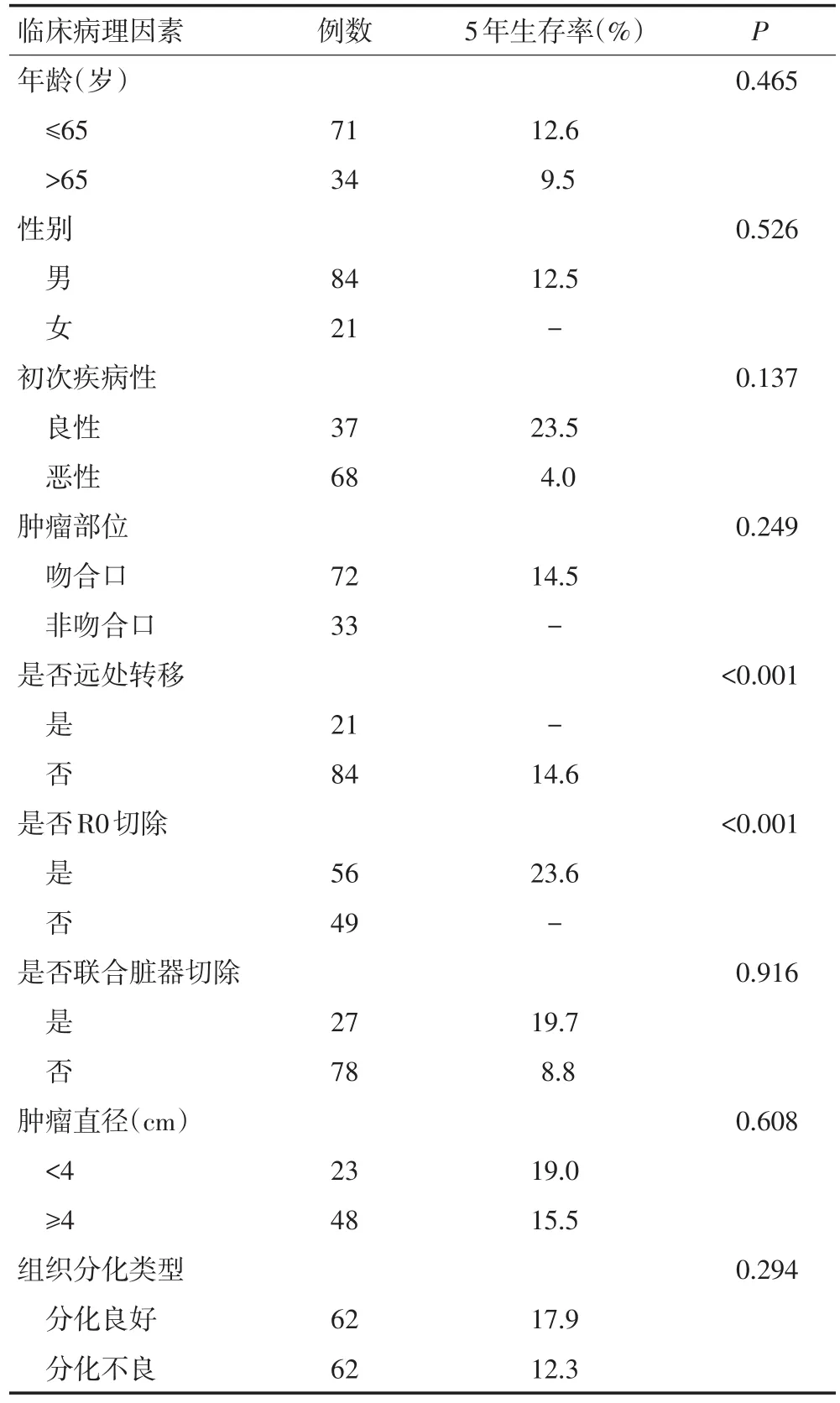
表3 影响残胃癌术后生存时间的单因素生存分析
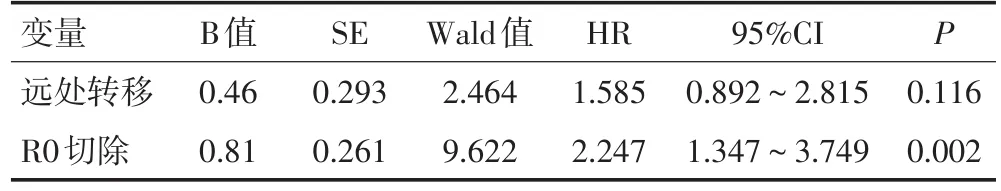
表4 影响残胃癌患者预后的多因素分析
生存分析发现,共56例残胃癌患者接受R0切除,预后明显提高(P<0.001,图1),而未接受R0切除的49例患者中,姑息手术组与非手术组分别有24例、25例,两组相比差异无统计学意义(图2)。同时,初次疾病性质(良性、恶性)及肿瘤部位(吻合口区、非吻合口区)均与患者预后相关,差异无统计学意义(图3,4)。
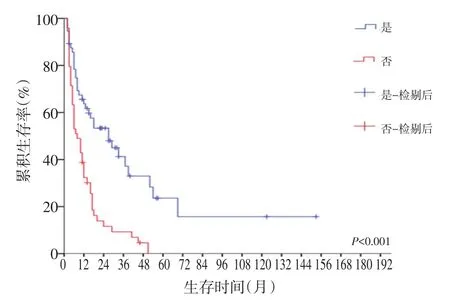
图1 R0切除组与非R0切除组残胃癌患者的生存曲线
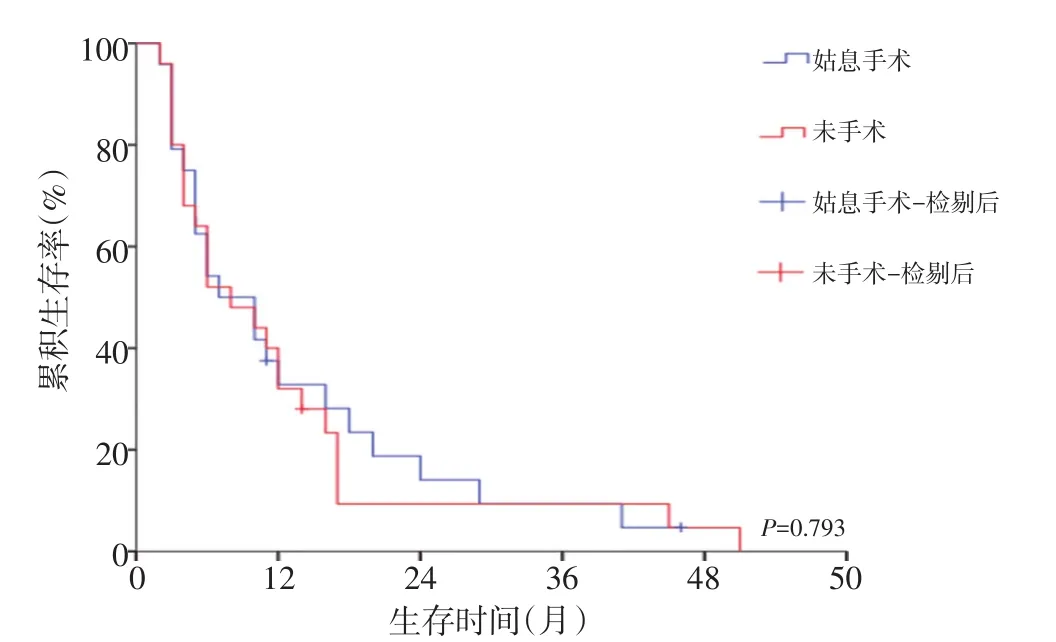
图2 姑息手术组与非手术组残胃癌患者的生存曲线
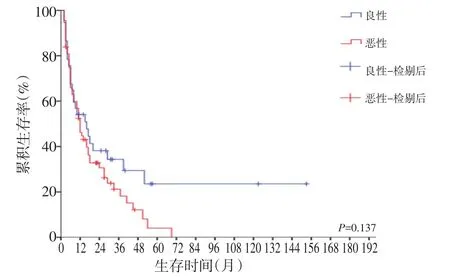
图3 首次疾病良性组与恶性组残胃癌患者的生存曲线
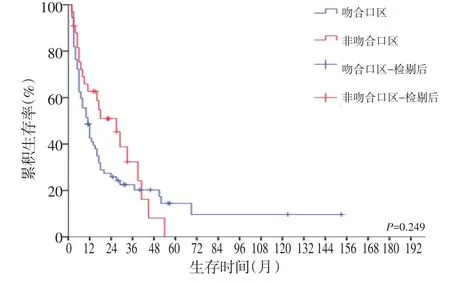
图4 吻合口区与非吻合口区残胃癌的生存曲线
3 讨论
既往研究表明,残胃癌的发病率较低,约占胃癌的1%~8%[2-3]。近年来,由于筛查的普及和检查手段的不断进步,残胃癌的检出率也在逐渐升高,临床医师及研究者对该病的关注也越来越多。由于该病早期尚无明显的特异性症状,多数患者就诊时已处于晚期阶段,导致其根治性切除率较低,预后较差[5]。因此,本研究着重关注残胃癌的临床病理学特征及与预后的联系,以期为临床上残胃癌诊疗策略的选择与制定提供参考,进而改善残胃癌患者的预后。
因良性疾病及恶性疾病行胃大部切除术后残胃癌发生的机制有所不同。目前,多数学者认为良性溃疡性疾病术后残胃癌的发生与胃解剖结构的改变、胃周淋巴液引流方向的改变及消化液反流对胃黏膜的刺激作用有关;而胃恶性疾病行胃大部切除术后残胃癌的发生与胃黏膜易于癌变的性质有关[6]。本研究将残胃癌患者根据初次疾病性质分为GSC-B组和GSC-M组,两组的例数分别为37例(35.2%)和68例(68.8%),GSC-M组病例数明显高于GSC-B组,这一点不同于Ohira等[7]的报道,这与近年来质子泵抑制剂的应用及原发胃癌根治性切除率的提高有着很大的关系。通过比较GSC-B组和GSC-M组患者的临床病理特征发现,GSC-B组患者年龄更大、男性患者比例更高、初次手术至发生残胃癌的时间间隔更长、检出淋巴结总数更多,而GSC-M组肿瘤组织类型以低分化和未分化为主。通常胃溃疡的发病年龄小于胃癌,但由于两者术后发生残胃癌的机制不同,即前者需要经过对胃黏膜长期的刺激作用,而后者则可能由于胃黏膜易于癌变的性质及肿瘤细胞的残留等,最终使得GSC-B组患者的发病年龄明显高于GSC-M组患者。由于不良的饮食习惯及较大的精神压力,男性胃良性溃疡性疾病的发生率明显高于女性,因此GSC-B组患者以男性为主。由于GSC-M组患者接受初次根治性手术时已进行了胃周淋巴引流区域充分的淋巴结清扫,故而在进行残胃癌切除术时清扫的淋巴结数明显少于GSC-B组。目前,残胃癌的分期仍参照胃癌TNM分期系统进行,若检出淋巴结总数<15枚,将可能造成与真实分期的偏离,影响残胃癌患者治疗方案的制定及预后的判断。本研究中,GSC-B组患者从初次手术至诊断残胃癌之间的时间间隔均为10年及以上,明显大于GSC-M组,因此,在临床实践中,对于因良性溃疡性疾病行胃大部切除术的患者,术后亦应定期随访,尤其术后10年以上更应加强胃镜等的复查,以提高残胃癌的早期检出率及根治性切除率,改善残胃癌患者的预后[7-8]。有研究发现[9-10]GSC-B组患者的预后明显优于GSC-M组患者。Irino等[11]认为由于初次疾病性质的不同,残胃癌患者的临床病理学特征有显著差异,但对患者的生存无显著影响。本研究的生存分析显示GSC-B组患者的预后优于GSC-M组患者,但差异无统计学意义,这可能与本研究纳入的样本数较少有关,可能存在一定的偏倚。
既往研究发现,位于残胃吻合口处的残胃癌肿瘤分化程度较低、预后较差,而非吻合口处的残胃癌肿瘤分化程度较高,预后相对较好[12-14]。本研究结果显示,吻合口组残胃癌分化不良者所占比例略高于非吻合口组(71.9%vs.70.0%),差异无统计学意义。生存分析显示两组患者的生存差异无统计学意义。
近年来,由于残胃癌诊断及治疗水平的不断提高,残胃癌患者的生存率亦不断改善,但国内外多项研究报道的残胃癌患者3年及5年生存率亦不尽相同,国内陈路川等[12]报道残胃癌患者术后(包括根治性和姑息性手术)的5年生存率为44.1%。日本Ino⁃mata等[15]的研究结果显示残胃癌患者的5年生存率高达69%。本研究中残胃癌患者的整体5年生存率为11.4%,而接受根治性切除术的残胃癌患者的5年生存率为23.6%,明显低于其他研究者的报道,分析原因为:1)由于国内早期筛查体系不够完善,大多数患者在诊断时病期较晚;2)本研究纳入单中心数据,样本例数有限。通过单因素生存分析发现,是否远处转移及R0切除是影响残胃癌患者预后的相关因素。因此,残胃癌诊断明确后,对于可接受根治性切除术者应尽早行根治性切除术,以提高患者生存率[9,16]。对于未能进行R0切除的患者,姑息手术与非手术治疗相比并无明显的生存获益,因此对于这类患者应首选非手术治疗。多因素生存分析结果显示,R0切除是影响残胃癌患者生存的独立预后因素,因此,接受胃大部切除术的患者,不论初次疾病的性质,均应重视术后定期复查,提高残胃癌早诊率及根治性切除率,改善患者预后[17-19]。
