颗粒细胞EGF类因子信号通路在调控卵母细胞成熟和发育中的作用
2019-02-28杨鑫宇贾振伟
杨鑫宇,贾振伟
颗粒细胞EGF类因子信号通路在调控卵母细胞成熟和发育中的作用
杨鑫宇,贾振伟
内蒙古民族大学动物科学技术学院,通辽 028043
动物体内卵泡排卵前促黄体素(luteinizing hormone, LH)诱导了卵丘颗粒细胞扩散,并启动卵母细胞恢复减数分裂。普遍认为,卵泡壁层颗粒细胞表达LH受体,卵母细胞及其周围卵丘细胞不表达LH受体,LH通过作用于卵泡壁层颗粒细胞产生信号分子,这些信号分子作用于卵丘颗粒细胞介导了LH生物作用。然而,一直以来,关于排卵前介导LH作用而诱导卵母细胞成熟的机制一直存在争议。目前研究认为,LH作用于卵泡壁层颗粒细胞后产生了EGF类因子,并与颗粒细胞的受体结合,促进了卵母细胞的成熟和发育。由于体外成熟的卵丘卵母细胞复合体来源于生长卵泡,其卵丘颗粒细胞EGF类因子信号系统不完善,目前的体外成熟培养体系难以模拟卵泡内的生理环境,导致卵母细胞体外发育能力较差,限制了这些卵母细胞的利用效率。本文综述了颗粒细胞EGF类因子信号系统、EGF类因子在调控卵母细胞成熟中的作用及对卵母细胞发育能力的影响,为优化卵母细胞体外成熟培养体系,完善卵丘颗粒细胞的EGF类因子的信号系统,进而提高卵母细胞体外成熟效率提供理论依据。
颗粒细胞;EGF类因子;卵母细胞成熟;卵母细胞发育能力
哺乳动物体内卵母细胞生长、成熟和排卵过程十分复杂,涉及多种激素和生长因子以内分泌或旁分泌的方式作用于卵泡颗粒细胞参与此过程的调控。动物卵泡颗粒细胞包括壁层颗粒细胞和卵丘颗粒细胞,普遍认为,排卵前促黄体素(luteinizing hormone, LH)作用于卵泡颗粒细胞后激活下游信号通路诱导了卵母细胞生长后期细胞质和细胞核成熟、排卵以及排卵后黄体细胞的形成。目前研究认为,卵母细胞不表达LH受体,卵丘颗粒细胞在卵母细胞分泌因子的抑制下也不表达LH受体,但卵泡壁层颗粒细胞表达LH受体,这说明LH作用于卵泡壁层颗粒细胞后将可能激活一些信号分子,将LH的生物作用传递至卵母细胞[1,2]。值得注意的是,目前研究已明确LH作用于卵泡壁层颗粒细胞后将产生表皮生长因子(epidermal growth factor, EGF)类因子,这些细胞因子介导了LH的作用,调控卵母细胞的成熟和发育[3]。
家畜卵母细胞体外成熟培养是一项重要的繁殖生物技术,在畜牧业生产和科学研究上广泛应用,是体外受精、性别控制、转基因动物生产及动物克隆等技术开展的前提和关键。由于体外成熟的卵丘颗粒细胞不表达LH受体,但表达促卵泡生成素(follicle-stimulating hormone, FSH)受体,因此,卵母细胞体外成熟期间通过添加FSH而激活卵丘颗粒细胞内调控卵母细胞恢复减数分裂的信号通路。但目前普遍认为,相对于体内成熟的卵母细胞,体外成熟的卵母细胞发育能力较差,影响了其利用效率。研究发现,卵母细胞在卵泡内生长后期,LH将诱导EGF类因子的产生,并激活EGF类因子信号系统,促进卵母细胞成熟[4]。由于体外成熟的卵母细胞脱离了卵泡环境,而且这些卵母细胞来源于生长卵泡,提示体外成熟的卵母细胞,卵丘颗粒细胞的EGF类生长因子信号系统可能不完善,不利于卵母细胞成熟,这可能是导致体外成熟的卵母细胞发育能力较差的一个重要因素。因此,本文综述了颗粒细胞EGF类因子信号系统、EGF类因子在调控卵母细胞成熟中的作用及对卵母细胞发育能力的影响,为优化卵母细胞体外成熟培养体系,完善卵丘颗粒细胞的EGF类因子的信号系统,提高卵母细胞体外成熟效率提供理论参考。
1 颗粒细胞EGF类因子信号系统
1.1 EGF类因子及其受体
哺乳动物表皮生长因子(epidermal growth factor, EGF)类因子,与EGF分子结构和生物学功能相似,因此被称为EGF类蛋白家族。目前研究认为,动物卵巢颗粒细胞表达的EGF类因子主要包括:特指双调蛋白(amphiregulin, AREG)、β细胞素(betacellulin, BTC)和表皮调节素(epiregulin, EREG)[5]。这些EGF类因子来源于非活性的跨膜前体糖蛋白,包括信号序列、跨膜结构域和胞外EGF结构域。EGF类因子的前体蛋白在细胞膜外被蛋白酶水解而释放功能性的肽,通过与受体结合而发挥生物学功能。EGF类因子的受体与EGF受体(epidermal growth factor- receptor, EGFR)相同,是一种分子量为170 kDa的细胞膜糖蛋白,属于酪氨酸激酶受体,由细胞外的配体结合区,疏水跨膜区和细胞内的酪氨酸激酶信号活化区3部分组成。
目前研究表明,体内卵泡发育和卵母细胞成熟期间,排卵前高水平的LH促进了壁层颗粒细胞表达EGF类因子,且通过旁分泌的方式作用于卵丘颗粒细胞EGFR,使其表达EGF类因子。FSH促进了壁层和卵丘颗粒细胞表达EGFR,而卵母细胞分泌因子促进了卵丘颗粒细胞表达EGFR[4,6,7](图1)。而且,研究认为,颗粒细胞EGF类因子与EGFR胞外区结合后,使其细胞内的部分发生特定酪氨酸残基磷酸化,从而激活细胞内ERK1/2、PI3K以及JAK/STAT等下游信号通路,其中EGF类因子与EGFR结合后通过RAS/cRAF/MEK1级联反应而激活ERK1/2,激活的ERK1/2与CEBPB、c-myc和AP-1等转录因子结合而促进基因表达,因此,ERK1/2被认为是调控卵母细胞减数分裂的恢复、卵丘颗粒细胞的扩散和排卵的关键信号分子[8~10]。
1.2 颗粒细胞EGF类因子信号系统功能的完善
近年来,许多学者认为卵巢小有腔卵泡来源的卵丘卵母细胞复合体不能对EGF类生长因子发生反应,随着卵泡发育,卵丘颗粒细胞逐渐获得功能性EGF信号网络,这与EGF类生长因子是介导卵母细胞成熟和排卵的中心调控因子的观点一致[11,12]。优势卵泡为了排卵,排卵前卵丘颗粒细胞能够对EGF类生长因子发生反应,而次要卵泡缺乏这种能力。为了了解生长阶段卵泡的颗粒细胞对EGF类生长因子反应能力较低的原因,许多学者开展了相关研究。其中一种观点认为,相对于大卵泡,小卵泡的颗粒细胞EGF类生长因子受体基因mRMA表达量较低,导致其对EGF类生长因子反应能力较低[13~15]。另外一种观点认为,小卵泡的颗粒细胞EGF类生长因子受体基因mRMA表达量与大卵泡的颗粒细胞一致,但其翻译能力及翻译后蛋白磷酸化水平较低,导致这些小有腔卵泡对EGF类生长因子反应和颗粒细胞扩散能力较低[12]。这些结果说明,体内随着卵泡的生长,卵丘颗粒细胞EGF类因子信号系统功能逐渐完善,并获得支持卵母细胞成熟和发育的能力。同时提示,小的有腔卵泡颗粒细胞EGF类因子信号系统功能不健全,这可能是小卵泡来源卵丘卵母细胞复合体(cumulus-oocyte complex, COCs)体外培养后,导致卵母细胞发育能力较低的一个重要因素。
2 EGF类因子在调控卵母细胞成熟的作用
2.1 EGF类因子介导了LH信号
EGF主要由卵泡内膜细胞和颗粒细胞产生。研究表明,体外卵母细胞成熟期间,EGF促进多种哺乳动物卵丘颗粒细胞扩散和卵母细胞成熟[16~18]。研究认为,EGF通过卵丘颗粒细胞调控卵母细胞成熟,因为成熟有腔卵泡来源的卵母细胞表达EGF受体数量很少,而卵丘颗粒细胞拥有大量的EGF受体[19,20]。而且,已有的研究证明,LH促进了排卵前卵泡颗粒细胞EGF的表达,这说明EGF通过介导LH信号,并作用于颗粒细胞而调控卵母细胞成熟和发育[18]。
然而,Inoue等[21]研究LH调控排卵前卵泡发育机制时发现,LH峰值后EGF表达以及在卵泡液积累的量没有发生显著变化,暗示EGF可能不是介导LH作用的关键因子。特别重要的是,在多种哺乳动物上的研究发现,排卵前EGF家族成员的EGF类生长因子(AREG, EREG和BTC)不表达,而LH峰启动后,这些EGF类生长因子表达量迅速增加[21~23]。研究已证明,在LH刺激下,EGF类生长因子首先在卵泡壁层颗粒细胞上表达,然后分别以自分泌或旁分泌的方式作用于壁层颗粒细胞和卵丘颗粒细胞EGFR,增强了前列腺素-过氧化物酶合成酶2 (prostaglandin- peroxidase synthase 2, PTGS2)表达,且促进了卵丘颗粒细胞表达EGF类生长因子。壁颗粒细胞和卵丘颗粒细胞PTGS2表达增加后,促进了前列腺素E2 (prostaglandin E2, PGE2)的合成,PGE2作用于卵丘颗粒细胞上的受体,激活p38MAPK而进一步促进EGF类生长因子表达,这些EGF类生长因子与卵丘颗粒细胞EGF受体结合后,激活了ERK1/2、PI3K等信号通路,促进了调控卵母细胞恢复减数分裂和卵丘颗粒细胞扩散基因的表达,进而放大LH信号,使LH刺激信号从卵泡颗粒细胞外围向内传递至卵母细胞[24,25]。综上所述,EGF类生长因子介导了排卵前LH信号,由于EGF类生长因子受体和EGF受体相同,因此EGF体外可能与其受体结合而模拟了EGF类生长因子的功能,而体内EGF可能不是LH信号的主要介导者。
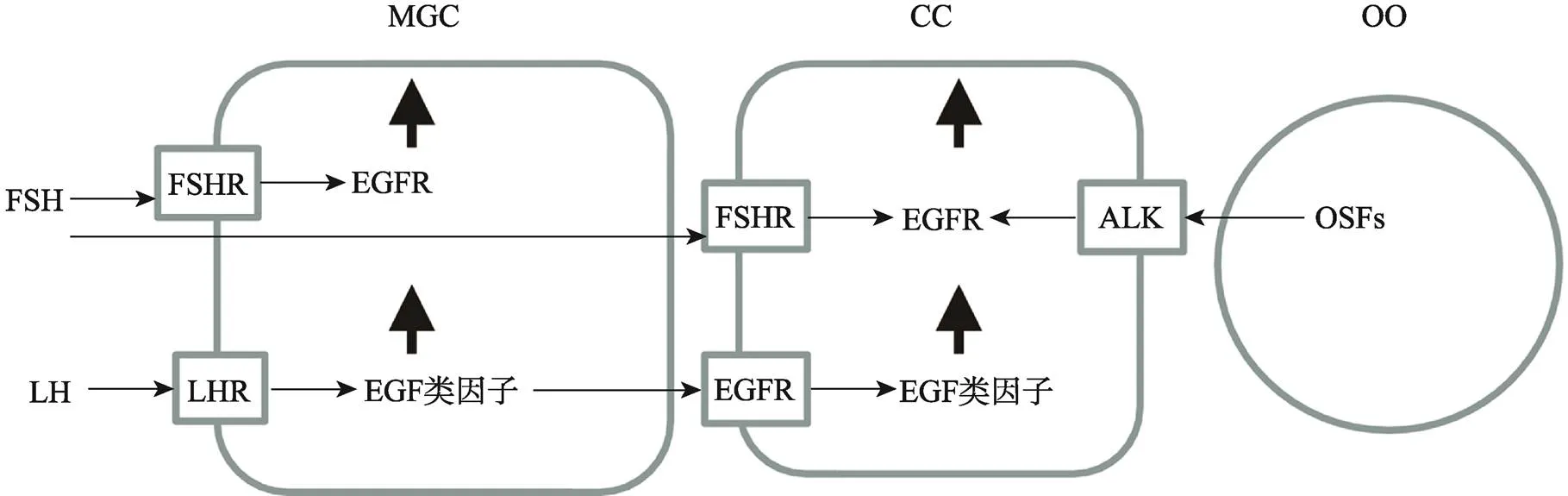
图1 EGF类因子及其受体在壁层和卵丘颗粒细胞上的表达

2.2 EGF类因子调控卵母细胞减数分裂
体内有腔卵泡生长期间,颗粒细胞为卵母细胞提供cAMP/cGMP而使其减数分裂阻滞在生发泡阶段。目前,研究已明确,C型尿钠肽(C-type natriuretic peptide, CNP)激活卵丘颗粒细胞上的受体(NPR2)产生cGMP,进入卵母细胞通过抑制磷酸二酯酶(PDE3A)的活性,降低cAMP的水解,高水平的cAMP激活蛋白激酶A而抑制MPF的活性,进而将抑制减数分裂[26]。体内LH峰刺激后,降低了颗粒细胞cGMP的产生,使cGMP进入卵母细胞的量减少,激活了PDE3A,使cAMP水平下降,卵母细胞恢复减数分裂。目前研究表明,LH峰刺激后,AREG和EREG等EGF类因子表达量增加,激活其受体后,抑制CNP表达量,导致cGMP生产水平下降,同时增强间隙连接蛋白磷酸化,进而关闭间隙连接,最终导致cGMP进入卵母细胞的量减少,解除其对卵母细胞减数分裂的阻滞[27](图2)。
此外,体外研究表明EGF信号网络的激活也参与了哺乳动物卵母细胞成熟的调控。例如,体外cAMP调控剂维持了卵母细胞减数分裂阻滞,而添加EGF诱导了其恢复减数分裂[28]。研究发现,FSH体外由EGF类生长因子介导,诱导了卵母细胞恢复减数分裂和卵丘颗粒细胞扩散[29]。cAMP是FSH信号通路的下游信号分子,高水平的cAMP也能够通过促进EGF类生长因子表达而诱导卵母细胞恢复减数分裂。另外,外源的AREG、EREG和EGF也能诱导多种哺乳动物卵母细胞恢复减数分裂和卵丘颗粒细胞扩散。特别注意的是,在小鼠()上的研究发现,利用含有AREG的卵泡液培养卵母细胞诱导了卵母细胞成熟和卵丘颗粒细胞扩散,而免疫耗竭AREG后其作用消失[30]。在小鼠中,COC体外培养期间,使用EGF类生长因子受体抑制剂,阻滞了AREG诱导的卵母细胞成熟,但培养前去除卵丘颗粒细胞后,并没有干扰卵母细胞成熟,揭示EGF类生长因子不是直接作用卵母细胞,而是通过作用卵丘颗粒细胞而影响卵母细胞成熟[31]。综上所述,排卵时EGF信号网络降低了卵丘颗粒细胞的cGMP进入卵母细胞,同时体内LH或体外FSH激活EGF信号网络,导致卵丘颗粒细胞发生一系列的生理变化而诱导卵母细胞成熟。
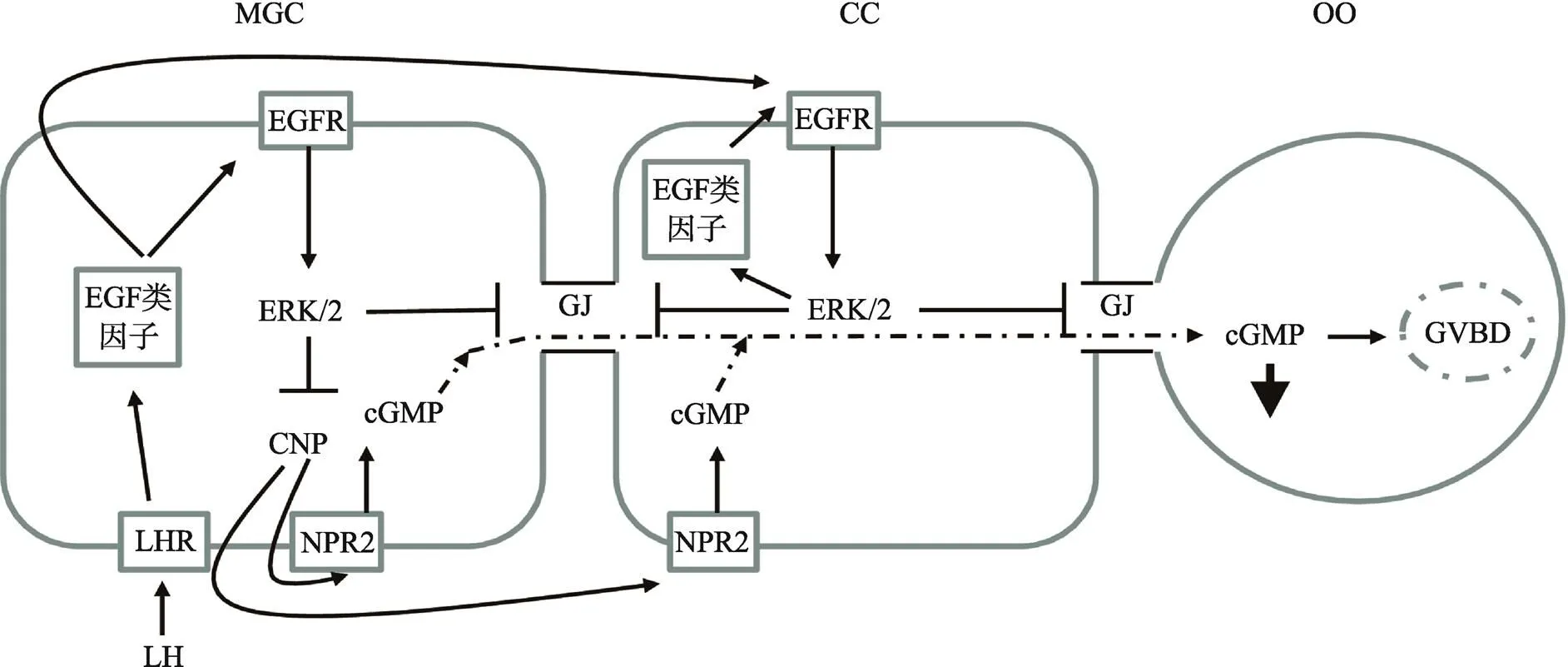
图2 EGF类因子对卵母细胞细胞减数分裂恢复的调控作用

2.3 EGF类因子对卵母细胞代谢的调控
COC代谢是影响卵母细胞成熟和发育的一个重要因素。研究表明,相对于FSH,EGF类生长因子增强了牛()卵丘颗粒细胞的糖酵解[32]。另有研究发现,相对于FSH,EGF类生长因子诱导了小鼠卵母细胞线粒体较高水平的膜电位,增强了卵母细胞氧化磷酸化,促进了ATP的产生,而且,AREG和EREG提高了卵丘卵母细胞复合体氨基己糖通 路代谢活性,进而促进透明质酸的合成,增强卵丘颗粒细胞扩散,同时促进了卵丘颗粒细胞的糖基 化[33,34]。对牛、小鼠和猪()的研究表明,颗粒细胞增强糖基化与体外成熟的卵母细胞发育能力相关[35~37],但AREG和EREG等EGF类生长因子诱导的颗粒细胞糖基化是否会影响卵母细胞发育能力,目前尚不确定,仍需进行深入研究。综上所述,EGF类生长因子在调控卵丘颗粒细胞的糖酵解和卵母细胞氧化磷酸化方面发挥了重要作用,这可能是影响卵母细胞成熟和发育能力的关键因素。
3 EGF类因子对卵母细胞发育能力的影响
3.1 EGF类因子对卵母细胞发育能力的影响
由于EGF信号系统在诱导卵母细胞成熟和颗粒细胞扩散方面发挥了重要作用,因此,将EGF纳入体外成熟培养体系,有可能提高卵母细胞发育能力。目前许多研究已证明,相对于体内成熟的COC,体外成熟的COC颗粒细胞EGF类生长因子表达量较低。例如,Richani等[38]研究发现,相对于小鼠体内成熟的COC,FSH诱导体外成熟的COC,颗粒细胞AREG基因mRNA表达量及其蛋白的分泌较低。而且,基因芯片研究数据表明,相对于小鼠体内成熟的COC,FSH诱导体外成熟的COC,颗粒细胞基因表达差异最显著的是AREG,EREG和BTC这3个EGF类生长因子[39]。体内LH峰刺激后EGF类因子主要由卵泡壁层颗粒细胞产生,是COC接受的诱导卵母细胞减数分裂的早期信号因子,导致卵丘颗粒细胞自动放大EGF信号网络。由于卵母细胞体外成熟培养期间,脱离了卵泡环境,COC缺少来自于壁层颗粒细胞传递的EGF类因子的作用,不能激活EGF类因子受体,因此,颗粒细胞不能接受ERK1/2- PGE2-p38MAPK自动放大的信号。体外成熟的COC一般来自于小的生长卵泡,其卵丘颗粒细胞EGF信号系统尚处于发育阶段,体外培养期间,培养液内添加FSH可能部分克服EGF信号系统的缺陷。尽管如此,卵母细胞体外成熟培养期间,添加EGF类因子仍有利于卵母细胞成熟和发育。
鉴于体外成熟的COC颗粒细胞EGF信号系统缺陷,许多研究检验了体外成熟期间补充EGF类因子对卵母细胞发育能力的影响(表1)。例如,在小鼠上的研究发现,卵母体外成熟期间,相对于FSH和EGF,培养液添加EREG显著提高了卵母细胞成熟和受精后囊胚率,而且EREG和AREG结合使用显著提高了囊胚内细胞团细胞数,并增加了胎儿的数量[38]。Prochazka等[10]研究报道,猪卵母细胞体外成熟期间,补充EREG或AREG,相对于FSH和LH,显著提高孤雌激活后的胚胎数量。这些结果揭示,生物活性的EGF类因子作为卵母细胞体外成熟的添加因子可能比FSH和EGF更适合,但具体的分子机制仍不清楚。这些研究说明,体内FSH和EGF不是诱导卵母细胞成熟的直接生理性因子,而体外成熟培养体系使用EREG和/或AREG可能模拟了体内卵母细胞成熟期间的发生的生理事件,进而提高了卵母细胞发育能力。另外,Richani等[38]发现,EREG和AREG体内刺激了EGF类生长因子的表达,而FSH促进这些因子的表达能力有限。而且在卵母细胞体外培养期间,相对于FSH,EREG和AREG显著提高了EGF类生长因子的表达量,这些研究结果进一步证明EGF类因子是体内影响卵母细胞成熟的关键因子[40]。
一般认为EGF类因子对颗粒细胞基因表达、信号通路和细胞功能影响的能力低于促性腺激素,但其调控卵细胞发育的能力却高于促性腺激素的潜在机制是什么?目前研究认为,EGF类因子的优势作用可能是影响了卵丘颗粒细胞和卵母细胞代谢。例如,用AREG处理牛COC,相对于FSH,能显著提高葡萄糖消耗量、乳酸的产量以及乳酸的产量/葡萄糖吸收量的比率[32]。对小鼠的研究发现,相对于FSH和EGF,EGF类因子增强了线粒体的活性,氨基己糖生物合成通路代谢活性,进而提高了透明质酸的产量和蛋白质β-O-连接糖基化的水平[33]。另外,EGF类因子可能通过调控卵母细胞翻译而影响其发育能力。最近研究发现,EGF或 AREG作用于卵丘颗粒细胞产生的信号分子,可能介导了FSH调控卵母细胞中一些对胚胎发育起关键作用的基因mRNA的翻译[41]。但目前关于EGF类因子激活卵丘颗粒细胞何种信号通路而调控卵母细胞mRNA的翻译仍不确定,尚需进行深入研究。
3.2 EGF类因子协同多种信号分子提高了卵母细胞发育能力
目前人们普遍认为,卵母细胞成熟期间,促性腺激素激活了COC多种信号通路,可能与EGF类因子信号通路协作影响卵母细胞减数分裂成熟和发育能力。这些受促性腺激素调控的众多信号通路,其中被卵母细胞分泌因子激活的信号通路能够延长卵丘颗粒细胞和卵母细胞间隙连接的通讯。GDF9和BMP15是主要的卵母细胞分泌因子,能够增强COC对EGF类因子的敏感性而提高卵母细胞的发育能力(表1)。例如,在牛上研究发现,AREG与BMP15结合使用提高了体外成熟的卵细胞发育能力,BMP15增强了颗粒细胞之间的间隙连接功能,AREG增强了卵丘颗粒细胞的糖酵解,BMP15维持了细胞间隙的通讯,进而使颗粒细胞产生的代谢物进入卵母细胞,提高其发育能力[32]。
另外,促性腺激素作用于COC后将产生大量的cAMP,cAMP水平的增加不仅能够延长卵丘颗粒细胞和卵母细胞间的通讯,也能增强对COC对EGF类因子的敏感性。例如,研究发现,cAMP调控剂(forskolin+IBMX)前成熟处理COC后进行体外成熟,体外成熟液中添加AREG 和EREG显著提高了卵母细胞的发育能力[42]。

表1 EGF类因子对卵母细胞发育的影响
此外,发育能力较低的猪卵母细胞,双丁酰环腺甘酸与GDF9和BMP15蛋白前体结合使用,增强了AREG诱导的卵母细胞成熟、囊胚形成以及颗粒细胞扩散相关基因(HAS2, TNFAIP6和PTGS2)的表达,而且,相对于促性腺激素,这些因子的结合使用促进了EGF类因信号通路的下游因子ERK1/2的磷酸化[43]。另有研究发现,CNP和GDF9结合使用增强了小鼠COC对AREG的反应能力,提高了腔前卵泡来源的卵母细胞发育能力,这些结果进一步说明EGF类因信号系统在调控卵母细胞成熟和发育过程中的重要作用[44]。综上所述,体外成熟期间,EGF类因子刺激卵母细胞恢复减数分裂,过早的使卵母细胞和卵丘颗粒细胞失去间隙连接功能,结合使用卵母细胞分泌因子和cAMP调控剂能够维持卵母细胞和颗粒细胞之间的间隙连接通讯功能,并能增强EGF信号系统功能,进而提高卵母细胞发育能力。
4 结语与展望
EGF类因子信号网络是体内是排卵级联反应的关键参与者,卵母细胞从卵泡排出期间,EGF类因子将LH信号从卵泡周边颗粒细胞传递至卵母细胞,调控了卵丘卵母细胞代谢,促进了卵母细胞成熟,而且,体外卵母细胞成熟期间,添加外源的EGF类因子能够提高卵母细胞发育能力,这说明其在优化卵母细胞体外成熟培养体系方面具有重要的利用价值。
目前研究认为EGF类因子增强了卵丘颗粒细胞糖酵解和卵母细胞氧化磷酸化功能,这可能是其提高卵母细胞发育能力的一个重要原因。而且,EGF类因子也增强了卵丘颗粒细胞的糖基化,但其诱导颗粒细胞的糖基化是否会影响卵母细胞发育能力尚不确定,仍需深入研究。另外,EGF类因子通过作用于卵丘颗粒细胞产生的信号分子,调控卵母细胞中一些对胚胎发育起关键作用的基因mRNA的翻译,这也可能是其提高卵母细胞发育能力的另一个原因,但EGF类因子激活卵丘颗粒细胞何种信号通路而调控卵母细胞mRNA的翻译亦不确定,尚需深入研究。
此外,卵母细胞成熟期间,EGF类因子信号通路可能和多种信号通路协作影响卵母细胞减数分裂成熟和发育能力。而且,体外成熟期间,EGF类因子刺激卵母细胞恢复减数分裂,过早的使卵母细胞和卵丘颗粒细胞失去间隙连接功能,通过添加卵母细胞分泌因子和cAMP水平的调控剂(dbcAMP或CNP)维持了间隙连接功能,增强了EGF类因子在调控卵母细胞成熟和发育方面的作用。因此,为了模拟体内的环境,在完善卵丘颗粒细胞EGF类因子的信号系统的同时,使用间隙连接功能的增强剂,将可能建立理想的家畜卵母细胞体外成熟体系。
[1] Eppig JJ, Pendola FL, Wigglesworth K. Mouse oocytes suppress cAMP-induced expression of LH receptor mRNA by granulosa cells., 1998, 49(3): 327–332.
[2] Diaz FJ, Wigglesworth K, Eppig JJ. Oocytes determine cumulus cell lineage in mouse ovarian follicles., 2007, 120(Pt8): 1330–1340.
[3] Park JY, Su YQ, Ariga M, Law E, Jin SL, Conti M. EGF-like growth factors as mediators of LH action in the ovulatory follicle., 2004, 303(5658): 682–684.
[4] Shimada M, Hernandez-Gonzalez I, Gonzalez-Robayna I, Richards JS. Paracrine and autocrine regulation of epidermal growth factor-like factors in cumulus oocyte complexes and granulosa cells: key roles for prostaglandin synthase 2 and progesterone receptor., 2006, 20(6): 1352–1365.
[5] Ashkenazi H, Cao X, Motola S, Popliker M, Conti M, Tsafriri A. Epidermal growth factor family members: endogenous mediators of the ovulatory response., 2005, 146(1): 77–84.
[6] El-Hayek S, Demeestere I, Clarke HJ. Follicle-stimulating hormone regulates expression and activity of epidermal growth factor receptor in the murine ovarian follicle., 2014, 111(47): 16778–6783.
[7] Gupta S, Pandey S, Parmar MS, Somal A, Paul A, Panda BSK, Bhat IA, Baiju I, Bharti MK, Saikumar G, Sarkar M, Chandra V, Sharma GT.Impact of oocyte-secreted factors on its developmental competence in buffalo., 2017, 25(3): 313–320.
[8] Oda K, Matsuoka Y, Funahashi A, Kitano H. A comprehensive pathway map of epidermal growth factor receptor signaling., 2005, 1: 2005.0010. doi: 10.1038/msb4100014.
[9] Fan HY, Liu Z, Shimada M, Sterneck E, Johnson PF, Hedrick SM, Richards JS. MAPK3/1 (ERK1/2) in ovarian granulosa cells are essential for female fertility., 2009, 324(5929): 938–941.
[10] Prochazka R, Blaha M. Regulation of mitogen-activated protein kinase 3/1 activity during meiosis resumption in mammals., 2015, 61(6): 495–502.
[11] Diaz FJ, O’Brien MJ, Wigglesworth K, Eppig JJ. The preantral granulosa cell to cumulus cell transition in the mouse ovary: development of competence to undergo expansion., 2006, 299(1): 91–104.
[12] Ritter LJ, Sugimura S, Gilchrist RB. Oocyte induction of EGF responsiveness in somatic cells is associated with the acquisition of porcine oocyte developmental competence., 2015, 156(6): 2299–2312.
[13] Singh B, Rutledge JM, Armstrong DT. Epidermal growth factor and its receptor gene expression and peptide localization in porcine ovarian follicles., 1995, 40(4): 391–399.
[14] Prochazka R, Kalab P, Nagyova E. Epidermal growth factor-receptor tyrosine kinase activity regulates expansion of porcine oocyte-cumulus cell complexes., 2003, 68(3): 797–803.
[15] Caixeta ES, Ripamonte P, Franco MM, Junior JB, Dode MA. Effect of follicle size on mRNA expression in cumulus cells and oocytes of: an approach to identify marker genes for developmental competence., 2009, 21(5): 655–664.
[16] Boland NI, Gosden RG. Effects of epidermal growth factor on the growth and differentiation of cultured mouse ovarian follicles., 1994, 101(2): 369–374.
[17] Lorenzo P, Illera MJ, Sanchez J, Silvan G, Illera JC. The effect of EGF on cumulus expansion and bovine oocyte maturation., 1992, 37(1): 250.
[18] Procházka R, Srsen V, NagyováE, Miyano T, Flechon JE. Developmental regulation of effect of epidermal growth factor on porcine oocyte-cumulus cell complexes: nuclear maturation, expansion, and F-actin remodeling., 2000, 56(1): 63–73.
[19] Garnett K, Wang J, Roy SK.Spatiotemporal expression of epidermal growth factor receptor messenger RNA and protein in the hamster ovary: follicle stage-specific differential modulation by follicle-stimulating hormone, luteinizing hormone, estradiol, and progesterone., 2002, 67(5): 1593–1604. .
[20] Almeida KC, Pereira AF, Alcântara Neto AS, Avelar SR, Bertolini LR, Bertolini M, Freitas VJ, Melo LM.Real-time qRT-PCR analysis of EGF receptor in cumulus-oocyte complexes recovered by laparoscopy in hormonally treated goats., 2011, 19(2):127–136. .
[21] Inoue Y, Miyamoto S, Fukami T, Shirota K, Yotsumoto F, Kawarabayashi T. Amphiregulin is much more abundantly expressed than transforming growth factor-alpha and epidermal growth factor in human follicular fluid obtained from patients undergoingfertilization–embryo transfer., 2009, 91(4): 1035–1041.
[22] Espey LL, Richards JS. Temporal and spatial patterns of ovarian gene transcription following an ovulatory dose of gonadotropin in the rat., 2002, 67(6): 1662– 1670.
[23] Carletti MZ, Christenson LK. Rapid effects of LH on gene expression in the mural granulosa cells of mouse periovulatory follicles., 2009, 137(5): 843–855.
[24] Conti M, Hsieh M, Park JY, Su YQ. Role of the epidermal growth factor network in ovarian follicles., 2006, 20(4): 715–723.
[25] Panigone S, Hsieh M, Fu M, Persani L, Conti M. Luteinizing hormone signaling in preovulatory follicles involves early activation of the epidermal growth factor receptor pathway., 2008, 22(4): 924–936.
[26] Zhang M, Su YQ, Sugiura K, Xia G, Eppig JJ. Granulosa cell ligand NPPC and its receptor NPR2 maintain meiotic arrest in mouse oocytes., 2010, 330(6002): 366– 369.
[27] Tsuji T, Kiyosu C, Akiyama K, Kunieda T. CNP/NPR2 signaling maintains oocyte meiotic arrest in early antral follicles and is suppressed by EGFR-mediated signaling in preovulatory follicles., 2012, 79(11): 795–802.
[28] Downs SM, Daniel SA, Eppig JJ. Induction of maturation in cumulus cell-enclosed mouse oocytes by follicle-stimulating hormone and epidermal growth factor: evidence for a positive stimulus of somatic cell origin., 1988, 245(1): 86–96.
[29] Procházka R, Petlach M, Nagyová E, Nemcová L. Effect of epidermal growth factor-like peptides on pig cumulus cell expansion, oocyte maturation, and acquisition of developmental competence: comparison with gonadotropins., 2011, 141(4): 425–435.
[30] Zamah AM, Hsieh M, Chen J, Vigne JL, Rosen MP, Cedars MI, Conti M. Human oocyte maturation is dependent on LH-stimulated accumulation of the epidermal growth factor-like growth factor, amphiregulin., 2010, 25(10): 2569–2578.
[31] Downs SM, Chen J. EGF-like peptides mediate FSH-induced maturation of cumulus cell-enclosed mouse oocytes., 2008, 75(1): 105–114.
[32] Sugimura S, Ritter LJ, Sutton-McDowall ML, MottersheadDG, Thompson JG, Gilchrist RB. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction- mediated metabolite supply., 2014, 20(6): 499–513.
[33] Richani D, Sutton-McDowall ML, Frank LA, Gilchrist RB, Thompson JG. Effect of epidermal growth factor-like peptides on the metabolism of-matured mouse oocytes and cumulus cells., 2014, 90(3): 49.
[34] Richani D, Wang X, Zeng HT, Smitz J, Thompson JG, Gilchrist RB. Pre-maturation with cAMP modulators in conjunction with EGF-like peptides during in vitro maturation enhances mouse oocyte developmental competence., 2014, 81(5): 422–435.
[35] Sutton-McDowall ML, Mitchell M, Cetica P, Dalvit G, Pantaleon M, Lane M, Gilchrist RB, Thompson JG. Glucosamine supplementation during in vitro maturation inhibits subsequent embryo development: possible role of the hexosamine pathway as a regulator of developmental competence., 2006, 74(5): 881–888.
[36] Pantaleon M, Tan HY, Kafer GR, Kaye PL. Toxic effects of hyperglycemia are mediated by the hexosamine signaling pathway and o-linked glycosylation in early mouse embryos., 2010, 82(4): 751–758.
[37] Frank LA, Sutton-McDowall ML, Brown HM, Russell DL, Gilchrist RB, Thompson JG. Hyperglycaemic conditions perturb mouse oocytedevelopmental competence via beta-O-linked glycosylation of heat shock protein 90., 2014, 29(6): 1292–1303.
[38] Richani D, Ritter LJ, Thompson JG, Gilchrist RB. Mode of oocyte maturation affects EGF-like peptide function and oocyte competence., 2013, 19(8): 500–509.
[39] Kind KL, Banwell KM, Gebhardt KM, Macpherson A, Gauld A, Russell DL, Thompson JG. Microarray analysis of mRNA from cumulus cells followingormaturation of mouse cumulus-oocyte complexes., 2013, 25(2): 426–438.
[40] Blaha M, Nemcova L, Kepkova KV, Vodicka P, Prochazka R. Gene expression analysis of pig cumulus-oocyte complexes stimulatedwith follicle stimulating hormone or epidermal growth factor-like peptides., 2015, 13: 113.
[41] Franciosi F, Manandhar S, Conti M. FSH Regulates mRNA translation in mouse oocytes and promotes developmental competence., 2016, 157(2): 872–882.
[42] Gilchrist RB, Luciano AM, Richani D, Zeng HT, Wang X, Vos MD, Sugimura S, Smitz J, Richard FJ, Thompson JG. Oocyte maturation and quality: role of cyclic nucleotides., 2016, 152(2): R143–R157.
[43] Mottershead DG, Sugimura S, Al-Musawi SL, Li JJ, Richani D, White MA, Martin GA, Trotta AP, Ritter LJ, Shi J, Muelle TD, Harrison CA, Gilchrist RB. Cumulin, an Oocyte-secreted heterodimer of the transforming growth factor-βfamily, is a potent activator of granulosa cells and improves oocyte quality., 2015, 290(39): 24007–24020.
[44] Romero S, Sánchez F, Lolicato F, van Ranst H, Smitz J. Immature oocytes from unprimed juvenile mice become a valuable source for embryo production when using C-type natriuretic peptide as essential component of culture medium., 2016, 95(3): 64, 1–10.
The role of EGF-like factor signaling pathway in granulosa cells in regulation of oocyte maturation and development
Xinyu Yang, Zhenwei Jia
The surge of luteinizing hormone (LH) in preovulatory ovarian follicles triggers the resumption of meiosis in oocytes and induces the proliferation of surrounding cumulus granulosa cells. It is believed that LH receptors are expressed in the mural granulosa cells, but not the oocytes and the surrounding cumulus cells, suggesting that the LH signaling is mediated by factors produced by the granulosa cells. However, the mechanism underlying oocyte maturation induced by LH before ovulation has been controversial. Current studies suggest that LH binds on to its receptor on granulosa cells of the follicular wall to promote the production of EGF-like factors, which activate various signaling cascades and induce oocyte maturation and development. Since thematuration system is difficult to simulate thephysiological environment,cultured follicles are likely to be deficient in the EGF-like factors, which could result in the poor developmental competency ofcultured oocytes and restrict their efficient utilization. In this review, we summarize the EGF-like factor signaling system in granulosa cells and its regulation of oocyte maturation and development. It aims to optimize thematuration culture system of oocytes and increase the EGF-like factor signaling system in cumulus granulosa cells, thereby providing a framework for improving the efficiency onmaturation of oocytes.
granulosa cells; EGF-like factor; oocyte maturation; oocyte developmental competency
2018-10-07;
2019-01-10
国家自然科学基金项目(编号:31760670)资助 [Supported by the National Natural Science Foundation of China (No. 31760670)]
杨鑫宇,在读硕士,专业方向:配子与胚胎生物技术。E-mail: 2609447363@qq.com
贾振伟,博士,副教授,研究方向:配子与胚胎生物技术。E-mail: zhenwei1999@sina.com
10.16288/j.yczz.18-193
2019/1/17 12:17:31
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190117.1217.002.html
(责任编委: 史庆华)
