弹簧圈栓塞治疗腹主动脉瘤腔内修复术后持续性Ⅱ型内漏
2019-02-28韩晓峰刘光锐李铁铮黄连军
韩晓峰 郭 曦 刘光锐 李铁铮 黄连军
(首都医科大学附属北京安贞医院介入诊疗科,北京 100029)
对肾下型腹主动脉瘤(abdominal aortic aneurysm,AAA),腔内修复(endovascular aortic repair,EVAR)因创伤小、住院周期短、围手术期并发症少[1]等特点已成为临床一线治疗方法。支架相关内漏是影响预后的重要因素之一,其中Ⅰ型和Ⅱ型内漏多见。Ⅰ型内漏发现就即刻处理,Ⅱ型内漏的发生术中不易判断,但术后造成瘤腔内压力持续增高,存在动脉瘤破裂的风险[2,3]。Ⅱ型内漏发生率国内外各中心报道差异较大,处理方法也多种多样[4]。我们回顾性分析2014年6月~2018年6月312例EVAR资料,术前和术后均在我院行主动脉CTA检查的268例中,经主动脉CTA证实存在Ⅱ型内漏34例(34/268,12.7%),主要参与的责任血管为腰动脉7例、骶正中动脉3例、肠系膜下动脉(inferior mesenteric artery,IMA)24例,随访期间,7例腰动脉、3例骶正中动脉及19例IMA Ⅱ型内漏自行消失(29/34,85.3%),自行消失时间1~12个月,平均6个月,另5例为持续性Ⅱ型内漏,行责任血管分支动脉栓塞,近期效果满意,报道如下。
1 临床资料与方法
1.1 一般资料
本组5例,均为男性,年龄54~75(64.8±10.0)岁。主动脉CTA确诊为肾下型腹主动脉瘤,肠系膜上动脉(superior mesenteric artery,SMA)和腰动脉通畅,行EVAR,均未做IMA和腰动脉预栓塞处理。术后1例有腰腹不适(例1),4例无明显症状。EVAR术后1、3、6、12个月及以后每年常规复查主动脉CTA,基于术后主动脉CTA轴位延迟期图像,若见支架外动脉瘤瘤腔内存在对比剂填充或瘤腔内CT值较平扫增高10 HU[5,6],则考虑存在Ⅱ型内漏。本组5例EVAR术后随访13~41(21.8±11.1)个月,主动脉CTA显示瘤腔内均可见对比剂填充,主动脉瘤腔直径增大4~12(6.4±3.2)mm,体积增大率14%~48%[(24.9±14.2)%]。其中1例出院时复查主动脉CTA即发现Ⅱ型内漏,随诊13个月后行弹簧圈栓塞术。明确发生Ⅱ型内漏者,根据瘤腔内对比剂出现位置确定参与形成Ⅱ型内漏的责任血管(IMA、腰动脉、副肾动脉、骶正中动脉),与术前CTA图像对照,确定责任血管开口处的管腔直径,本组5例责任血管均为IMA,开口处管腔直径2.5~3.3(2.68±0.35)mm。合并高血压4例,冠心病2例,糖尿病1例,脑血管疾病1例。
病例选择标准:对于发生Ⅱ型内漏者,每半年复查主动脉CTA,测量动脉瘤瘤腔体积及瘤腔最大径,对比术前CTA测量值,术后瘤腔体积持续增大≥5%或瘤腔最大径增加超过5 mm者认为瘤体有明显变化,行责任血管分支动脉栓塞术。
1.2 方法
局麻加强化麻醉下,穿刺股动脉置入动脉鞘,送入5F猪尾导管行腹主动脉造影再次明确责任血管,置换导管行腹腔干动脉或SMA超选择性血管造影,确定腹腔干动脉分支(2例)或SMA分支(3例)与IMA交通使瘤腔着色充盈。明确IMA责任血管后,送入微导管(Renegade STC, Boston Scientific)和微导丝,避让交通血管通路分支血管后,超选择IMA开口处,沿微导管依次送入弹簧圈行栓塞治疗,即刻造影显示责任血管IMA开口处栓塞完全,无对比剂显影。弹簧圈栓塞术后1、3、6个月主动脉CTA随访观察瘤体缩小情况。
2 结果
术前主动脉CTA和术中DSA明确Ⅱ型内漏的责任血管均为IMA,其中3例起源于SMA分支沟通,2例起源于腹腔干动脉分支沟通。均成功行Ⅱ型内漏弹簧圈栓塞治疗,采用可控弹簧圈Interlock(Boston Scientific)和不可控弹簧圈(COOK)结合进行IMA开口处栓塞,均获成功。植入弹簧圈3枚1例、4枚2例、5枚1例、8枚1例。栓塞术后随访3~18个月,平均11个月,未见严重并发症,未出现心、脑血管意外。复查主动脉CTA,未见瘤腔内对比剂着色,5例瘤腔体积不同程度减小[体积缩小率4.8%~25.5%,(12.7±8.1)%],具体数据见表1。弹簧圈栓塞术前和术后主动脉CTA及术中DSA影像资料见图1~5。
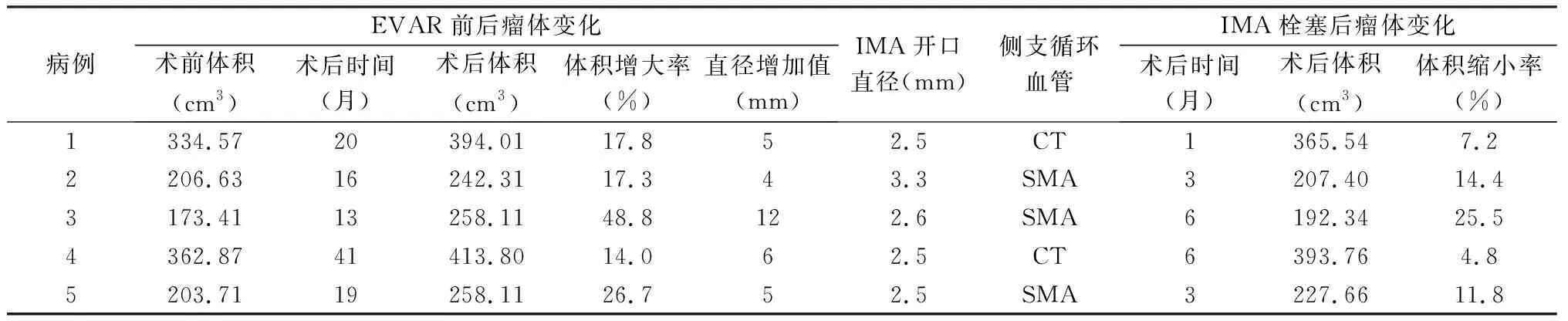
表1 EVAR术后Ⅱ型内漏治疗前后资料

图1 EVAR术后腹腔干-肠系膜下动脉Ⅱ型内漏栓塞治疗前后CTA对比(例1):栓塞前三维重建(A)显示肠系膜下动脉为内漏责任血管(箭头为内漏部位),横轴位图像(B)显示瘤腔内对比剂着色(箭头为内漏部位);栓塞后1个月三维重建(C)和横轴位图像(D)显示弹簧圈栓塞肠系膜下动脉开口处,内漏消失(箭头为弹簧圈栓塞部位) 图2 EVAR术后肠系膜上动脉-肠系膜下动脉Ⅱ型内漏栓塞治疗前后CTA对比(例2):栓塞前三维重建(A)显示肠系膜下动脉为内漏责任血管,横轴位图像(B)显示瘤腔内对比剂着色(箭头);栓塞后3个月CTA三维重建图像(C)和横轴位图像(D)显示内漏消失 图3 例1弹簧圈栓塞前后DSA图像:栓塞术前DSA(A)明确内漏部位(箭头),弹簧圈栓塞肠系膜下动脉开口处,即刻DSA(B)显示内漏消失(箭头显示弹簧圈) 图4 例3弹簧圈栓塞前后DSA图像:栓塞前DSA(A)显示瘤腔对比剂着色(箭头),弹簧圈栓塞肠系膜下动脉开口处,即刻DSA(B)显示内漏消失(箭头显示弹簧圈) 图5 例2 CTA横轴位图像测量动脉瘤瘤腔体积:A.腹主动脉瘤EVAR术前动脉瘤瘤腔体积206.63 cm3;B.腹主动脉瘤EVAR术后16个月出现Ⅱ型内漏动脉瘤瘤腔体积242.31 cm3;C.责任血管分支动脉栓塞术后3个月动脉瘤瘤腔体积207.40 cm3
3 讨论
Ⅱ型内漏的发生是EVAR术后主动脉重塑不良的主要因素之一[8~10]。引起Ⅱ型内漏血流持续逆灌注瘤腔的主要分支血管包括IMA、腰动脉、骶正中动脉和副肾动脉,主要见于IMA和腰动脉。Gelfand等[11]报道EVAR术后Ⅱ型内漏的发生率8%~44%,各中心报道发生率差异较大可能与随访病例数,诊断方法选择(超声、CT和动脉造影)以及诊断标准不同(EVAR术中覆膜支架植入后即刻主动脉造影确诊还是EVAR术后随访主动脉CTA确诊)有关。本研究均为EVAR术后常规复查主动脉CTA确诊。
Fabre等[12]报道,除老年、女性患者EVAR术后Ⅱ型内漏发生率较高外,解剖特点符合下列条件者EVAR术后Ⅱ型内漏发生率高:瘤腔内径大但瘤周血栓少,IMA通畅且开口处直径≥2.5 mm或腰动脉≥2对。吸烟、合并冠心病或外周血管疾病者Ⅱ型内漏发生率较低,这可能与动脉粥样硬化IMA或腰动脉狭窄甚至闭塞有关。不同于Ⅰ型和Ⅲ型内漏一旦发现要即刻处理,对于Ⅱ型内漏的处理时机选择,各中心报道不一。Wyss等[13]的研究显示,EVAR术后单纯Ⅱ型内漏引起瘤腔持续增大甚至破裂的发生率较低,随访期间5%~30%的患者Ⅱ型内漏消失。Sidloff等[8]对904例EVAR术后患者长达18年的随访研究显示,175例(19%)术后发生Ⅱ型内漏,平均随访半年后,约54%的Ⅱ型内漏消失,仅随诊观察而非积极二次干预的预后效果满意。因此,部分学者认为,对于Ⅱ型内漏的处理,在无瘤腔持续增大的前提下,可以采用保守治疗,控制血压和心率。
然而,也有学者认为瘤腔内存在持续的血流灌注会造成瘤腔压力增高、瘤腔容积增大,最终导致瘤体破裂,故Ⅱ型内漏一经发现需要积极处理[14,15]。Ⅱ型内漏的发生与存在持续通畅的IMA和腰动脉有关,理论上EVAR术中预防性栓塞IMA或腰动脉可以有效降低内漏的发生。然而,对于Ⅱ型内漏的处理方法选择仍存在争议,是采用EVAR术中预防性栓塞分支血管(IMA或腰动脉),还是覆膜支架植入后即刻瘤腔内弹簧圈或生物胶填塞,亦或是术后二次介入干预栓塞责任血管,甚至外科或腹腔镜下结扎责任血管等,各中心报道不一。Ultee等[4]对59篇1073例EVAR术后持续性Ⅱ型内漏的meta分析显示,不同方法(经股动脉、腰动脉或腔静脉途径栓塞术,经腹腔镜或开腹分支血管结扎术等)治疗Ⅱ型内漏总体手术成功率高(87.9%),但不同处理方法之间成功率略有差异(83.1%~92.1%),围手术期相关死亡率发生率低(1.8%)。Manunga等[16]报道EVAR术前预防性栓塞直径>3 mm的IMA可以有效降低术后Ⅱ型内漏发生率,减少二次手术干预并提高生存质量。但Fabre等[12]认为腹主动脉瘤使分支血管原有解剖学特点改变,预防性栓塞IMA不仅耗时且成功率低,同时处理过程中存在瘤腔血栓脱落造成远端血管栓塞风险。此外,Sheehan等[17]研究显示EVAR术前选择性栓塞IMA或腰动脉对预防Ⅱ型内漏发生和诱导瘤腔缩小效果无显著统计学差异。Ultee等[4]报道预防性栓塞责任血管对降低Ⅱ型内漏发生率的远期效果随着时间延长而减低。Solis等[18]认为Ⅱ型内漏发生的病因复杂多样,瘤腔逆灌注的持续增加可能由多支供血动脉和(或)引流静脉引起,这也解释了预防性栓塞单一分支动脉长期效果欠佳。
因此,EVAR术前准确评估通畅的分支血管数量和动脉开口处的直径测量很重要,但分支血管栓塞标准仍值得商榷。Otsu等[19]的研究显示,IMA直径>2.5 mm和(或)腰动脉直径>1.9 mm预示EVAR术后发生持续Ⅱ型内漏。Manunga等[16]的研究显示,发生持续性Ⅱ型内漏的IMA平均直径>3.02 mm,栓塞IMA可以有效预防其发生。但Guntner等[20]报道IMA直径与持续性Ⅱ型内漏发生并无统计学相关性。自1997年Van Schie等[15]首次报道EVAR术中栓塞瘤腔预防Ⅱ型内漏的发生,多家中心分别报道了应用弹簧圈或生物胶等不同栓塞材料单纯填塞瘤腔预防Ⅱ型内漏发生的方法。相比选择性栓塞责任血管(IMA或腰动脉),单纯瘤腔内填塞弹簧圈的方法技术操作简单,成功率更高。但Buckenham等[21]认为瘤腔内注射生物胶替代弹簧圈栓塞的方法短期效果更好,甚至Muthu等[22]报道EVAR术中预防性弹簧圈栓塞IMA结合瘤腔内填塞的方法更能有效预防Ⅱ型内漏发生。然而,除去这些技术延长手术时间、增加射线量和增高住院费用外,这些方法也增加了结肠缺血和截瘫等严重并发症的可能。
本研究回顾性分析我中心4年间312例EVAR资料,268例术前和术后检查均为本院CTA,随访期间确诊Ⅱ型内漏34例(34/268,12.7%),最终需要处理的共5例(5/268,1.9%)。欧洲血管外科协会指南[23]指出,当瘤腔直径增加大于1 cm时,建议积极干预治疗,EVAR术后瘤腔的再扩张更需要积极处理。Wyss等[13]认为EVAR术后瘤腔直径持续增大超过5 mm即需要积极干预。本组5例中4例瘤腔直径增大超过5 mm;另1例随访1年瘤腔缓慢增大4 mm,患者随诊期间心理压力较大,沟通后予以积极处理。我们认为,对Ⅱ型内漏存在风险高的患者应密切随访,出现Ⅱ型内漏且瘤腔持续增大者要积极干预。IMA常为Ⅱ型内漏的责任血管,本组5例均为此,平均直径2.68 mm,与文献报道类似。采用可控弹簧圈和非可控弹簧圈组合方式栓塞责任血管IMA,弹簧圈释放尽可能接近瘤腔,尽量保留侧支循环通路上分支血管以预防结肠缺血发生。
理论上,供应责任血管IMA的血流常来源于SMA,即通过SMA和IMA间的Riolan弓形成的侧支循环逆灌注瘤腔[24]。但栾景源等[5]报道EVAR术前有无Riolan弓与Ⅱ型内漏无关,EVAR术后IMA灌注压力减低促使SMA和IMA间潜在交通支开放很快会形成侧支循环,这同时也解释了EVAR术后左半结肠很少发生缺血。本组3例IMA侧支循环来源于SMA,其余2例来源于腹腔干,临床报道少见,可能与动脉粥样硬化致腹腔干和SMA起始部直径较小,而腹腔干、SMA和IMA间潜在交通支开放有关,具体原因有待积累更多病例后进一步研究。
综上所述,考虑到Ⅱ型内漏发生率不高,大部分病例随访期间内漏自行消失,我们认为对于术中即刻造影以及术后早期(<1个月)发现的Ⅱ型内漏,可以密切随诊观察辅助药物治疗;随访期间瘤腔持续增大(瘤腔体积增大和瘤体直径增加)的Ⅱ型内漏要积极处理,经动脉入路栓塞分支血管的方法安全有效。
