诱导型神经干细胞移植抑制颅脑创伤后补体活化的影响
2019-02-28高谋徐如祥王文佳董勤丁柏匀姚慧杨志军
高谋 徐如祥 王文佳 董勤 丁柏匀 姚慧 杨志军
补体系统是免疫系统的重要组成部分,补体系统激活可产生多种生物活性物质介导颅脑创伤(traumatic brain injury,TBI)后炎症反应,也可形成补体膜攻击复合物(C5b-9)加重神经细胞损伤[1,2]。近年来,研究发现中枢神经系统(central nervous system,CNS)内星形胶质细胞和小胶质细胞可表达补体调节分子 Crry、Cd46、Cd59a和 Cd55,减轻补体活化介导的细胞损伤[3,4]。然而,由于神经细胞选择性低表达补体调节分子,因此其易遭受补体系统的攻击[3,4]。此外,在CNS疾病模型的脑组织中少见补体调节分子表达,而可见大量补体活化产物C3d和C5b-9沉积于神经细胞上,因而调控TBI后补体活化可减轻补体介导的神经细胞损伤[3-5]。笔者曾报道经立体定向颅内移植的诱导型神经干细胞(induced neural stem cells,iNSCs)可通过调控小胶质细胞活化状态,抑制反应性星形胶质细胞增生,抑制TBI后炎症反应,为神经细胞存活创造适宜的微环境[6,7]。然而,目前国内外少有研究报道iNSCs移植对TBI后补体活化的调节作用。为此,本研究用自由落体脑打击装置制备C57BL/6小鼠TBI模型,并将C57BL/6小鼠iNSCs经静脉注射到TBI小鼠体内,观察脑组织中C3d和NeuN抗体双阳性、C5b-9和NeuN抗体双阳性、C3d和Map2抗体双阳性以及C5b-9和Map2抗体双阳性的神经细胞的分布情况,并用流式细胞仪检测经TBI小鼠血清处理后iNSCs表达补体调节分子的水平,探讨经静脉移植iNSCs对TBI后补体活化的作用及分子机制,现报道如下。
材料与方法
一、实验动物
健康成年雄性C57BL/6小鼠40只,8~10周龄,体质量24~30 g,所有实验动物(无特定病原体级)均购自北京维通利华公司。
二、主要实验仪器和试剂
仪器:CO2细胞培养箱(Thermo公司,美国),超净工作台(ESCO公司,美国),倒置相差显微镜、CM1950冰冻切片机、TCS SP5Ⅱ激光共聚焦显微镜和DM3000荧光显微镜(Leica公司,德国),C6流式细胞仪(BD Biosciences公司,美国)。
试剂:DMEM/F12培养基、Neurobasal培养基、B27、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)、Accutase 酶、左旋谷酰胺和磷酸盐缓冲液(phosphate buffered solution,PBS)(Invitrogen 公司,美国),牛血清白蛋白(bovine serum albumin,BSA)(Sigma 公司,美国),C3d 抗体(工作浓度:5 μg/mL)(R&D Systems公司,美国),C5b-9 抗体(工作浓度:2 μg/mL)、Map2 抗体(工作浓度:2 μg/mL)、Cd46 抗体(工作浓度:10 μg/mL) 和兔 IgG,polyclonal Isotype Control抗体(工作浓度:10 μg/mL)(Abcam 公司,美国),NeuN 抗体 (工作浓度:5 μg/mL)(Millipore 公司,美国),Alexa Fluor®555标记驴抗山羊C3d抗体(工作浓度:2 μg/mL)、Alexa Fluor®555 标记山羊抗兔 C5b-9 抗体(工作浓度:2 μg/mL)、Alexa Fluor®633标记山羊抗鸡 Map2抗体 (工作浓度:2 μg/mL)和Alexa Fluor®633标记山羊抗小鼠NeuN抗体(工作浓度:2 μg/mL)(Life Tech 公司, 美国),4’,6-二脒基-2-苯 基 吲 哚 (4’,6-diamidino-2-phenylindole,DAPI)(SouthernBiotech 公司,美国),Crry 抗体(工作浓度:5 μg/mL)、 大鼠 IgG2α,κ Isotype Control抗体(工作浓度:5 μg/mL)和APC标记山羊抗大鼠IgG抗体 (工作浓度:2 μg/mL)、PE 标记仓鼠抗小鼠Cd55抗体 (工作浓度:2 μg/mL)和 PE标记仓鼠IgG3,λ1 Isotype Control抗体 (工作浓度:2 μg/mL)(BD Biosciences公司,美国),APC标记山羊抗兔IgG 抗体(工作浓度:5 μg/mL)(Thermo 公司,美国),PE标记抗小鼠Cd59a抗体 (工作浓度:2 μg/mL)和PE标记小鼠IgG1,κ Isotype Control抗体 (工作浓度:2 μg/mL)(Biolegend 公司, 美国),PE 标记仓鼠抗小鼠 Cd55抗体(工作浓度:2 μg/mL)和 PE标记仓鼠 IgG3,λ1 Isotype Control抗体(工作浓度:2 μg/mL)(Biolegend 公司,美国)。
三、C57BL/6小鼠iNSCs体外培养
C57BL/6小鼠 iNSCs用含 2%B27、20 ng/mL bFGF、20 ng/mL EGF、0.05%BSA 和 2 mmol/L 左旋谷酰胺的DMEM/F12与Neurobasal等体积混合培养基培养。
四、C57BL/6小鼠TBI模型制备和iNSCs移植
用异氟烷气体麻醉剂麻醉小鼠,并将其固定于脑立体定向仪上,备皮消毒,铺无菌洞巾,切开皮肤,暴露前囟,以lambda缝向喙侧2.0 mm、中线偏右侧2.0 mm为撞击点。用自由落体脑打击装置,撞针直径3.0 mm,制备TBI模型。设置假手术(sham)组(10只),仅切开头皮,不实施撞击。于伤后1 h对TBI小鼠进行神经功能缺损评分 (neurologicalseverityscore,NSS),将 NSS 为 4~8 分者(30 只)纳入 TBI组,按照随机数字表法选取10只用于制备TBI小鼠血清和热灭活TBI小鼠血清;余下20只按照随机数字表法分为:iNSCs移植组(10只)和 PBS处理组(10只)。于TBI后12 h,用Accutase酶消化法制备iNSCs单细胞悬液,并用PBS漂洗3遍,用PBS重悬细胞,并分别将200 μL含5×106个iNSCs单细胞悬液或等体积PBS经尾静脉注射到TBI小鼠体内。
五、脑组织冰冻切片、病理染色和双重免疫荧光染色
细胞移植后7 d采用随机数字表法从各组中选取6只动物进行处死,灌注固定后取出大脑,并作大脑冠状面连续冰冻切片,切片厚度为10 μm。用苏木素-伊红染色观察脑组织病理形态学特征。根据病理染色结果挑选脑组织切片进行双重免疫荧光染色,用10%BSA/0.3%TritonX-100封闭1 h后,分别加入 C3d 抗体(工作浓度:5 μg/mL)、C5b-9 抗体(工作浓度:2 μg/mL)、Map2 抗体 (工作浓度:2 μg/mL)和NeuN 抗体(工作浓度:5 μg/mL)在 4℃孵育过夜。用PBS漂洗后,分别加入Alexa Fluor®555标记驴抗山羊 C3d 抗体 (工作浓度:2 μg/mL)、Alexa Fluor®555标记山羊抗兔C5b-9抗体(工作浓度:2 μg/mL)、Alexa Fluor®633标记山羊抗鸡Map2抗体(工作浓度:2 μg/mL) 和 Alexa Fluor®633标记山羊抗小鼠NeuN 抗体(工作浓度:2 μg/mL),室温避光孵育 2 h。用DAPI染细胞核,封片后,在荧光显微镜下观察,在20×镜下随机选取6个视野,计数阳性细胞数(特异性抗体标记)和总细胞数(DAPI标记),阳性细胞百分率(%)=阳性细胞数/总细胞数×100%。
六、流式细胞仪检测
于TBI后12 h,分别制备TBI小鼠血清和热灭活TBI小鼠血清。用Accutase酶消化法制备iNSCs单细胞悬液,用PBS漂洗后离心弃去上清,分别用250 μL的TBI小鼠血清和热灭活TBI小鼠血清重悬细胞,接种于24孔板(细胞密度为1×105个/孔),置于37℃培养箱中处理45 min。随后收集细胞悬液,离心后弃去上清。用PBS漂洗3次,分别加入Crry 抗体 (工 作 浓度 :5 μg/mL)、 大 鼠 IgG2α,κ Isotype Control抗体(工作浓度:5 μg/mL)和 APC 标记山羊抗大鼠 IgG抗体(工作浓度:2 μg/mL),避光放置在4℃冰箱。反应20~30 min后,用PBS漂洗3次,并用PBS重悬细胞。用C6流式细胞仪检测,每个样品收集10 000~20 000个细胞。计算平均荧光强度分析iNSCs表达Crry水平。
七、统计学分析
采用SPSS17.0软件进行统计学分析。小鼠脑内C3d和NeuN抗体双阳性、C5b-9和NeuN抗体双阳性、C3d和Map2抗体双阳性以及C5b-9和Map2抗体双阳性的神经细胞数量以及iNSCs中Crry平均荧光强度以均数±标准差(±s)表示,资料先进行正态性检验和方差齐性检验,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,各组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
一、INSCs移植物抑制 TBI小鼠脑内 C3d和C5b-9沉积于NeuN和Map2抗体阳性的神经细胞
在TBI后7 d,sham组小鼠脑组织中少见C3d和NeuN抗体双阳性、C5b-9和NeuN抗体双阳性、C3d和Map2抗体双阳性以及C5b-9和Map2抗体双阳性的神经细胞(图1)。与之相比,TBI小鼠脑组织中明显可见C3d和C5b-9沉积于NeuN和Map2抗体阳性的神经细胞 (图1)。经统计分析发现:与sham组相比,PBS处理组和iNSCs移植组小鼠脑组织中C3d和NeuN抗体双阳性、C5b-9和NeuN抗体双阳性、C3d和Map2抗体双阳性以及 C5b-9和Map2抗体双阳性的神经细胞数量明显增加,差异有统计学意义(P<0.05);与 PBS 处理组相比,iNSCs移植组小鼠脑组织中C3d和NeuN抗体双阳性、C5b-9和NeuN抗体双阳性、C3d和Map2抗体双阳性以及C5b-9和Map2抗体双阳性的神经细胞数量明显减少,差异有统计学意义(P<0.05)(表 1)。

图1 颅脑损伤7 d后的PBS处理组、iNSCs移植组和sham组小鼠脑组织双重免疫荧光染色检测(×400)
二、流式细胞仪检测iNSCs表达补体调节分子水平
TBI小鼠血清组和热灭活TBI小鼠血清组中iNSCs表达补体调节分子Cd46、Cd59a和Cd55水平差异无统计学意义(P>0.05)。与热灭活TBI小鼠血清组相比,TBI小鼠血清组中iNSCs表达补体调节分子Crry水平明显上调,差异具有统计学意义(P<0.05)(表 2)。
讨 论
TBI是CNS损伤性疾病,其流行病学特点呈现为高发病率和高致死、致残率,严重危害人类生命健康[8]。有研究表明,TBI后继发性脑损伤是由多种因素参与的复杂病理过程,直接影响患者预后,如何有效防治TBI后继发性脑损伤是医学研究的热点和难点[8,9]。补体系统作为免疫系统的重要组成部分,可参与机体的免疫调节和病理损伤反应,因此调控TBI后补体活化可减轻补体介导的神经细胞损伤,为防治TBI后继发性脑损伤提供帮助[10,11]。目前,调控补体活化的方法主要是补体抑制剂和基因靶向药物的应用,然而其抑制TBI后补体活化的疗效并不理想[12,13]。为此,本课题组探讨了iNSCs移植对TBI后补体活化的影响,结果发现:与既往文献报道相符,在正常动物CNS内,即在sham组小鼠脑组织中,补体活化产物C3d和C5b-9表达量较低[14,15]。而当CNS损伤后,即在TBI小鼠脑组织中,可观察到大量补体活化产物C3d和C5b-9沉积于神经细胞上。补体活化产物C3d和C5b-9来源广泛,可从外周血液循环中经功能紊乱的血脑屏障渗漏,也可由浸润的免疫细胞或CNS内固有细胞合成[5]。此外,本研究发现,各组内NeuN阳性和Map2阳性的神经细胞上沉积的补体活化产物C3d和C5b-9具有一致性,说明TBI后神经细胞的胞体与轴突均遭受补体系统的攻击。值得注意的是,接受经静脉移植iNSCs的TBI小鼠脑组织中,NeuN阳性和Map2阳性的神经细胞上沉积的补体活化产物C3d和C5b-9均明显少于接受PBS处理的TBI小鼠。由此可见,iNSCs移植物可抑制TBI后补体活化,减轻补体活化对神经细胞的损伤。
为探讨经静脉移植iNSCs抑制TBI后补体活化的分子机制,本研究制备了TBI小鼠血清和缺乏补体活性成分的热灭活TBI小鼠血清分别在体外处理iNSCs,而后用流式细胞仪检测iNSCs表达补体调节分子的水平。与既往文献报道“干细胞可表达补体受体 CR2、C3aR和 C5aR以及补体调节分子 Crry、Cd46、Cd55和Cd59”一致,本研究发现 TBI小鼠血清处理后,iNSCs表达补体调节分子Crry的水平明显上调[16,17]。Crry是啮齿类动物调节补体活化的重要成分,类似于人类补体调节分子Cd46和Cd55[18,19]。可见Crry具有抑制C3转化酶的作用,从而调控补体系统激活,并减少下游补体活化产物C3d和C5b-9的形成[20-22]。本研究结果提示:经静脉移植iNSCs可能通过增加Crry的表达量,发挥抑制补体活化的作用。此外,经TBI小鼠血清处理的iNSCs选择性上调Crry的表达量也是本研究的新发现。
表1 颅脑损伤7 d后的各组小鼠脑内特异性抗体标记细胞的百分率(±s,%)
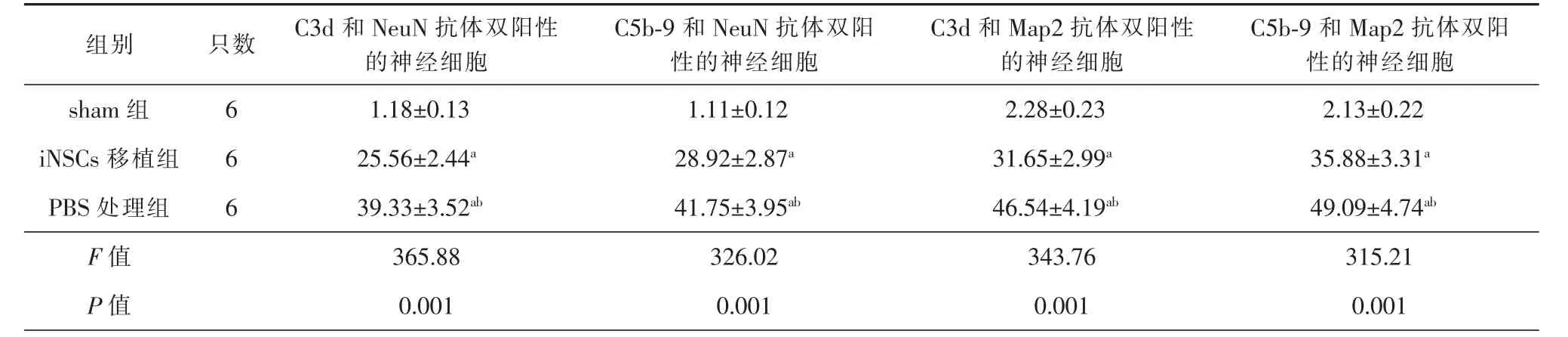
表1 颅脑损伤7 d后的各组小鼠脑内特异性抗体标记细胞的百分率(±s,%)
与 sham 组比较,aP<0.05;与 iNSCs移植组比较,bP<0.05
?
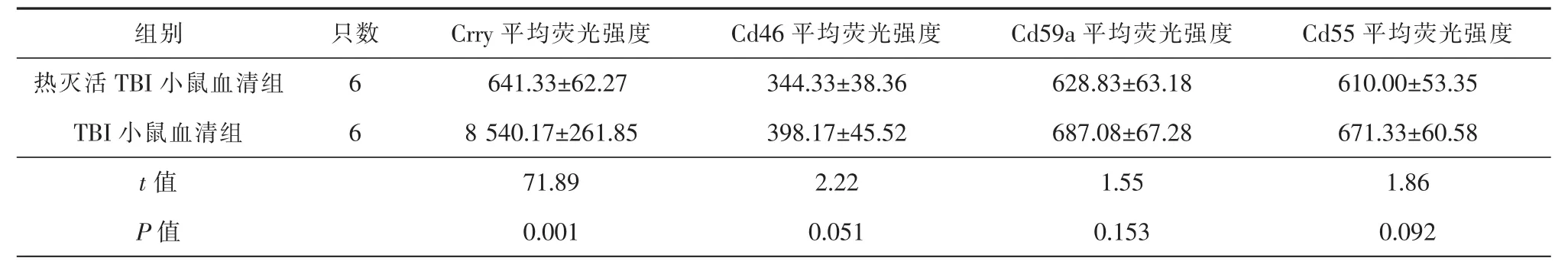
表2 流式细胞仪检测iNSCs表达补体调节分子的水平
综上所述,经静脉移植iNSCs可抑制TBI后补体活化,减少补体活化产物C3d和C5b-9沉积于神经细胞的胞体和轴突,从而减轻补体活化介导的神经损伤。通过体外实验,笔者注意到iNSCs可接受TBI小鼠血清刺激,选择性上调补体调节分子Crry的表达量,而理论上补体调节分子Crry可发挥抑制补体活化,减少补体活化产物C3d和C5b-9形成的作用,为进一步探讨经静脉移植iNSCs抑制TBI后补体活化的作用机制提供了新的方向。因此,在后续研究中,笔者仍将重点关注iNSCs选择性上调补体调节分子Crry表达量的分子机制,以及Crry表达量与TBI后补体活化水平间的量效关系,进而揭示iNSCs移植物抑制TBI后补体活化的分子机制。
