动物源性食品中氟喹诺酮类药物残留色谱质谱检测技术研究进展
2019-02-26郭亚文卜晓娜刘楚君王雅娟赵霞王波谢恺舟
郭亚文,卜晓娜,刘楚君,王雅娟,赵霞,王波,谢恺舟*
(1.扬州大学动物科学与技术学院,江苏扬州 225009;2.教育部农业与农产品安全国际合作联合实验室,江苏扬州 225009)
兽药在保证动物源性食品的供应方面发挥着巨大作用,但由于饲养人员专业知识的缺乏造成药物过量使用,以及不遵循休药期,甚至片面地追求经济利益而在养殖、加工贮存等过程中投入过量的抗菌药物导致兽药残留超标[1],后通过食物链进入人体造成中毒、过敏、“三致”(致癌、致畸、致突变)等严重伤害。因此,在动物源性食品进入市场前进行药物残留检测是十分必要的,需严格控制药物残留达到最高残留限量(Maximum residue limits,MRLs)以下。喹诺酮类药物(Quinolones,QNs)是人工合成的含4-喹诺酮基本结构的抗菌药,对DNA回旋酶有选择性的抑制作用,从而对细菌DNA造成不可逆损害,对多种革兰阴性菌杀菌效果明显[2]。氟喹诺酮类药物(Fluoroquinolones,FQs)是喹诺酮药物发展到第三代的产物,在喹诺酮结构的6位上加上一个氟(F),脂溶性增加,对组织细胞的穿透力加强,因而吸收好,组织浓度高,半衰期长,抗菌谱和杀菌效果增强。主要包括恩诺沙星(Enrofloxacin, ENR)及其代谢物环丙沙星(Ciprofloxacin,CIP),恩诺沙星在动物体内脱乙基生成环丙沙星,如猪体内ENR和CIP均有残留,牛、家禽体内残留形式以CIP为主,因此,动物性食品中ENR残留检测的标示物多是原药及其代谢产物CIP之和,也包括诺氟沙星(Norfloxacin, NFX)、氧氟沙星(Ofloxacin,OFL)、单诺沙星(Danofloxacin,DAN,又名丹诺沙星、达氟沙星)、沙拉沙星(Sarafloxacin, SAR)等。此类药物可用于泌尿生殖系统疾病、胃肠疾病以及呼吸道、皮肤组织的革兰阴性菌感染的治疗[3],且价格低廉,已广泛应用于动物养殖和兽医学中。
近年来由于致病菌耐药性和某些FQs的潜在致癌性,其残留问题引起广泛关注。为保证动物源性食品的安全,欧盟对ENR的MRLs已有规定,肝脏200 μg/kg,肌肉100 μg/kg,肾脏200 μg/kg;加拿大允许ENR用于治疗牛呼吸道疾病,其MRLs为肾脏400 μg/kg和肌肉20 μg/kg;日本对进口生鳗鱼及其制品进行ENR、CIP、NFX残留检测,并且将MRLs控制在50 μg/kg;世界卫生组织对ENR的MRLs推荐值为40 μg/kg,粮农组织/世界卫生组织食品添加剂联合专家委员会推荐鸡肝组织中SAR的MRLs为80 μg/kg,猪肝组织中DAN的MRLs为50 μg/kg[4];中国对于ENR+CIP规定见表1[5]。目前FQs残留的检测方法较多,如微生物法、酶联免疫法、毛细管电泳法等。由于FQs在动物源性食品中的残留量通常很低,需要灵敏度高的检测方法来测定,色谱法分离效率高,质谱法灵敏度、特异性高,适于低残留药物的检测。本文综述了色谱和质谱检测方法,以期为动物源性食品中FQs的残留检测提供参考。
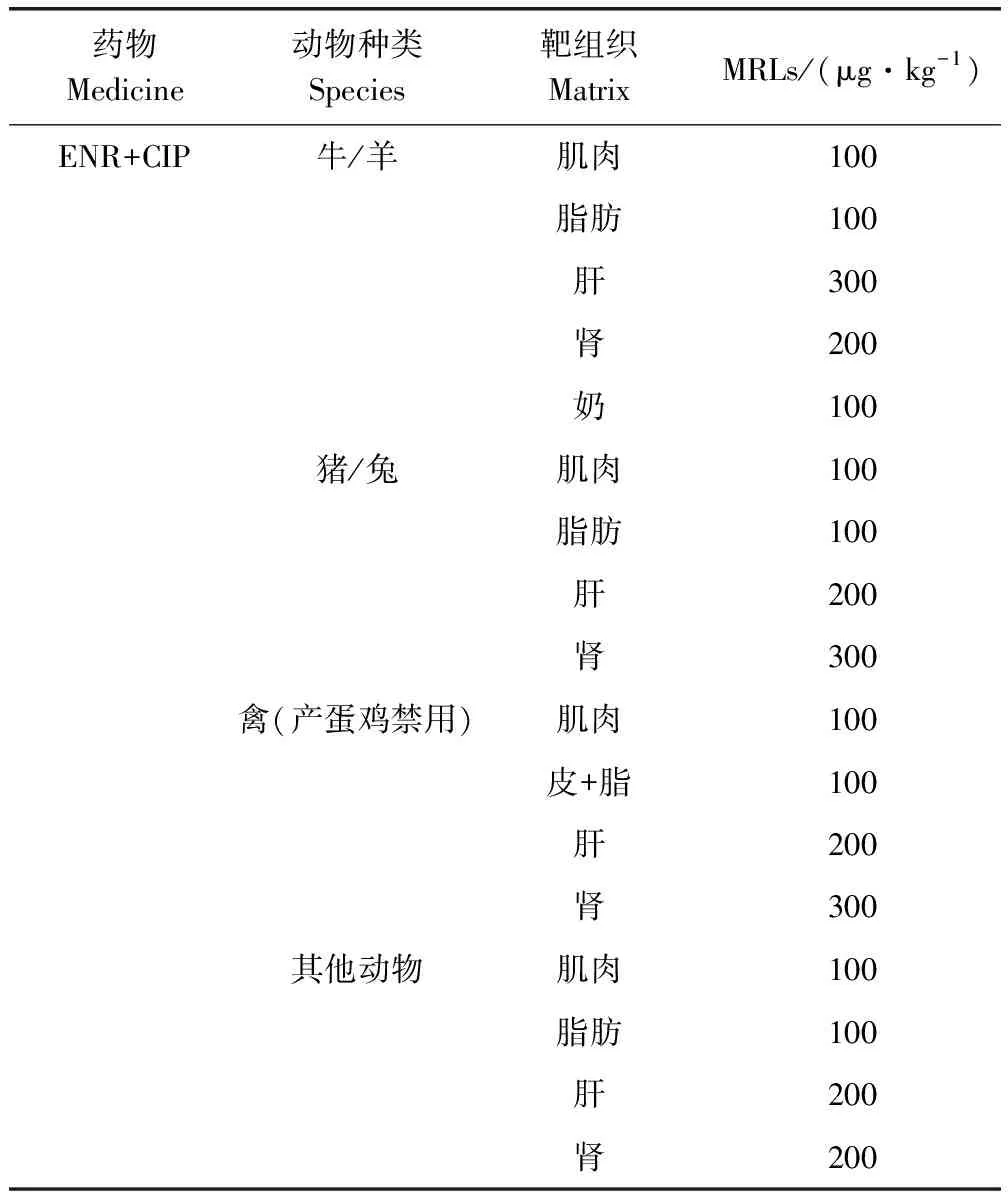
表1 中国关于动物源性食品中恩诺沙星、环丙沙星最大残留限量的规定Tab 1 Maximum residue limits (MRLs) values for ENR, CIP in animal food established by China
1 液相色谱法
1.1 液相色谱法 液相色谱系统包括流动相和固定相,其中固定相可以是固体,也可以是被固体或凝胶所支持的液体,液相色谱法(Liquid chromatography, LC)利用混合物在液-固或互相不溶的两种液体之间分配比的差异进行分离,而后分析鉴定。
Cho等[6]以LC法研究了猪肌肉、鸡蛋、全脂牛奶中7种FQs残留,定量限(Limit of quantitation, LOQ)为0.3~25 μg/kg,回收率为61.12%~115.93%。Roybal等[7]以LC法检测牛奶中的ENR、SAR残留,但色谱峰出现拖尾现象,且保留值不稳定或过长,甚至被长期保留在色谱柱上,导致峰形异常和分离度下降。这是由于FQs结构中某些基团如羧基团会在溶液中发生解离,进而影响固定相表面对FQs分子的吸附作用,因此,LC法检测FQs类残留不够准确。
1.2 高效液相色谱法 大多数金属盐类和高沸点不易挥发、热稳定性差的物质不能用LC分析,此缺点可用高效液相色谱法(High performance liquid chromatography, HPLC)来克服。高效液相色谱仪是在液相色谱系统中加上高压液流系统,使流动相在高压下快速流动,以提高分离效果。HPLC以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测,从而实现对试样的分析。色谱图不能直接给出未知物的定性结果,必须由已知标准作对照定性。当无纯物质对照时,定性鉴定十分困难,需借助检测器的配合。检测器的功能是将从色谱柱中流出的已经分离的组分显示出来或转换为相应的电信号,常见的检测器包括荧光检测器(Fluorescence detector, FLD)、二极管阵列检测器(Diode array detector, DAD或Photo-diode array detector, PDAD)等。HPLC的最大优点是具有优秀的重复性和重现性,利用HPLC来检测FQs残留的方法已被国家标准采用。由于色谱柱的性能会随着使用和不正确的保养而逐渐下降,会造成分离时间与色谱峰面积上的差异,因而在试验过程中要保持色谱柱的良好使用状态[3]。
Liu等[8]利用微波萃取辅助提取法对日本对虾中的3种FQs残留的检测进行了优化,样品加标回收率可达78.40%~96.62%。LV等[9]对蜂蜜中的OFL含量进行了检测,其检测限(Limit of detection, LOD)范围为5.68~9.71 μg/kg。Patyra等[10]用盐酸和乙腈提取样品,然后在pH为4.0的0.01 mol/L草酸中稀释并通过固相提取纯化,LOD和LOQ分别为28.5~74.7 μg/kg和31.7~94.6 μg/kg,平均回收率为89.7%~100.3%。He等[11]检测牛奶、鸡肉和鸡蛋中7种FQs残留,LOD范围在0.05~0.3 μg/kg,标准加标回收率为82.4%~108.5%。Yang等[12]利用搅拌棒吸附萃取方法,结合HPLC法检测9种药物的LOD均在0.1~0.3 μg/kg范围内,回收率为67.4%~99.0%。Bozkurt等[13]利用HPLC-FLD法分析牛奶、鸡蛋、鸡肉、鱼肉、牛肉样品,回收率在70%~100%范围内,LOD分别为:ENR 19.50×10-3μg/L,CIP 8.39×10-3μg/L,OFL 3.23×10-3μg/L。Vakh等[14]用HPLC-FLD法检测婴儿食品样品,LOD、LOQ分别为,NFX、OFL均为1.5 μg/L、5 μg/L,回收率在86%~122%范围内。Mei等[15]采用HPLC-DAD检测技术,测得牛奶样品LOD为0.10~0.216 μg/L,回收率为68.8%~120%。
不同样品基质中FQs残留HPLC、HPLC-FLD、HPLC-DAD、反相HPLC(RP-HPLC)检测方法的比较如表2所示。其中反相HPLC是由非极性固定相和极性流动相所组成的液相色谱体系,正好与由极性固定相和弱极性流动相所组成的液相色谱体系(正相色谱)相反,几乎可用于所有能溶于极性或弱极性溶剂中的有机物的分离。由表2可以看出,应用HPLC检测法所得样品的回收率、LOD、LOQ都很好,说明该检测方法的准确度和灵敏度高。
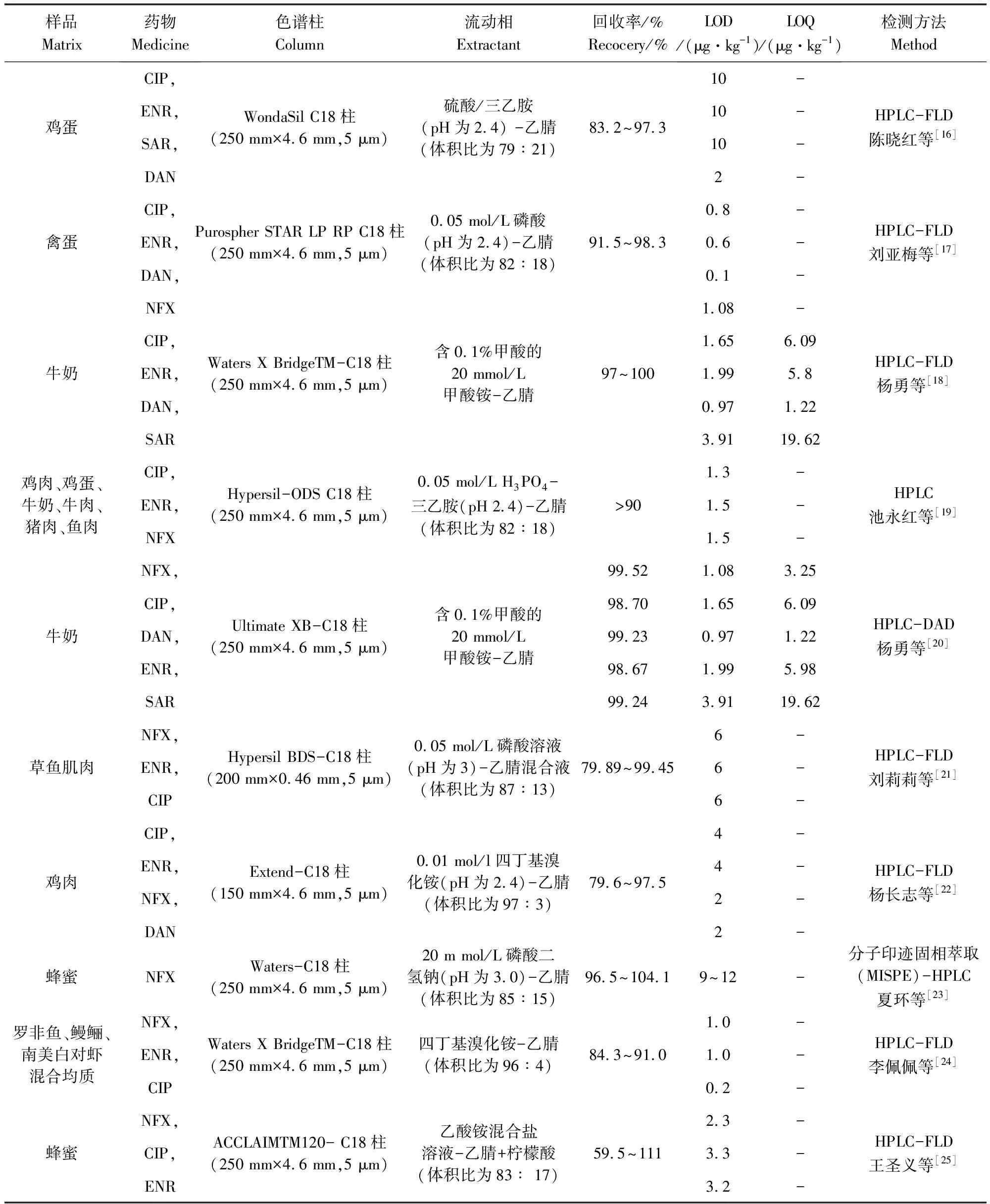
表2 高效液相色谱法检测不同样品基质中氟喹诺酮类药物残留的比较Tab 2 Comparison of HPLC methods for detection of fluoroquinolones in different matrices

续表
表中“-”为没有数据,上标“*”单位为μg/L,下同。
1.3 超高效液相色谱法 超高效液相色谱法(Ultra Performance Liquid Chromatography, UPLC)基于HPLC的理论及原理,涵盖了小颗粒填料、低系统体积及快速检测手段等全新技术,增加了分析的通量、灵敏度及色谱峰容量。在仪器工艺方面,超高效液相色谱仪采用新型的色谱填料及装填技术,配备了优秀的超高压液相色谱泵、自动进样器、高速检测器,并优化了系统的综合设计,使仪器分析能力大大增强。
Aufartová等[32]利用UPLC-FLD测定西班牙Gran Canaria Island鱼类5种FQs,LOD介于0.1~6.0 μg/kg之间,在两个加标浓度水平(25 μg/kg和250 μg/kg)下获得的回收率均大于90%。Vardali等[33]以UPLC-DAD检测鲈鱼肌肉和皮肤组织中DAN,LOD为13.73 μg/kg,回收率为90.2%~101.2%。不同样品基质FQs残留比较结果如表3所示,由表中可知,应用UPLC检测FQs残留时多使用C18柱进行分离,因基质、检测器、流动相等条件的不同,所得回收率、LOD、LOQ差别很大。所搭配的检测器均为FLD,该检测器因其选择性、灵敏度高而被广泛使用,但其只对荧光物质有响应,因而使用也有所受限。

表3 超高效液相色谱法检测不同样品基质中氟喹诺酮类药物残留的比较Tab 3 Comparison of UPLC methods for detection of fluoroquinolones in different matrices
2 液质联用法
质谱分析是先将待测物离子化,按离子的质荷比分离,然后测量各种离子谱峰的强度而实现分析目的的分析方法。色谱质谱的联用将色谱的分离能力与质谱的定性功能结合起来,实现对复杂混合物更准确的定量和定性分析,也简化了样品的前处理过程,使样品分析更简便。
利用液相色谱-质谱联用法(Liquid chromatography-mass spectrometry,LC-MS)检测FQs残留是通过分析样品经液相色谱分离后,进入离子源离子化,通过记录FQs特征离子峰下的分离时间-信号强度谱图,并计算色谱峰面积的方法从而达到定性和定量分析。由于液质联用主要给出待测物的相对分子质量,碎片很少,缺乏结构信息,需要多级质谱技术。
Kantiani等[41]用LC-MS对生牛乳和脱脂牛乳中的15种FQs残留同时定量和确证,LOD分别介于0.01~1.93 μg/L、0.03~4.23 μg/L。Tang等[42]应用固相微萃取(SPME)-LC-MS法快速测定养殖河豚鱼肌肉中FQs残留,LOD为0.3~1.5 μg/kg。Montesano等[43]凭借LC-MS/MS建立了一种快速检测马波沙星(FQs的一种)的方法,利用超滤法完成样品前处理,该法仅需要175 μL的样品便可完成检测,LOD为1 μg/L。Johnston等[44]用LC-MS/MS同时分析了鲑鱼、对虾和鲍鱼中8种FQs的残留量,所有样品均在12 min内出峰,LOD介于1~3 μg/kg。Barreto等[45]使用LC-MS/MS测定家禽、牛、猪和鱼肌肉中9种FQs残留,回收率介于79%~115%,LOD和LOQ分别为5 μg/kg和10 μg/kg。Chen等[46]开发新型多重单片纤维固相微萃取(APDE / MMF-SPME)与HPLC-MS/MS的组合检测牛奶和蜂蜜样品中FQs残留量,LOD分别为:牛奶0.0019~0.018 μg/kg,蜂蜜0.0010~0.0028 μg/kg,回收率在74.5%~116%之间。SM Da等[47]以电场辅助基质固相分散体作为提高氟喹诺酮提取效率和净化的有力工具,利用UPLC-MS/MS法测得牛奶中7种FQs残留,LOQ为20 μg/L,回收率为80.5%~95.7%。Meng等[48]以UPLC-MS/MS法分析牛奶中8种FQs残留,LOQ为0.01~0.29 μg/kg,回收率为61.0%~115.0%。
不同样品基质FQs残留比较结果如表4所示,由表中可知,流动相的选择多用到甲酸,这是因为流动相中加入甲酸、乙酸等,可提高正离子化效率,但是否加酸需根据色谱的分离情况、样品在酸性条件下的稳定性等决定。与液相色谱的常用检测器相比,质谱作为检测器使用,可提供相对分子质量和大量碎片结构信息,在提供保留时间以外,还能提供每个保留时间下所对应的质谱图,相应增加了定性能力。
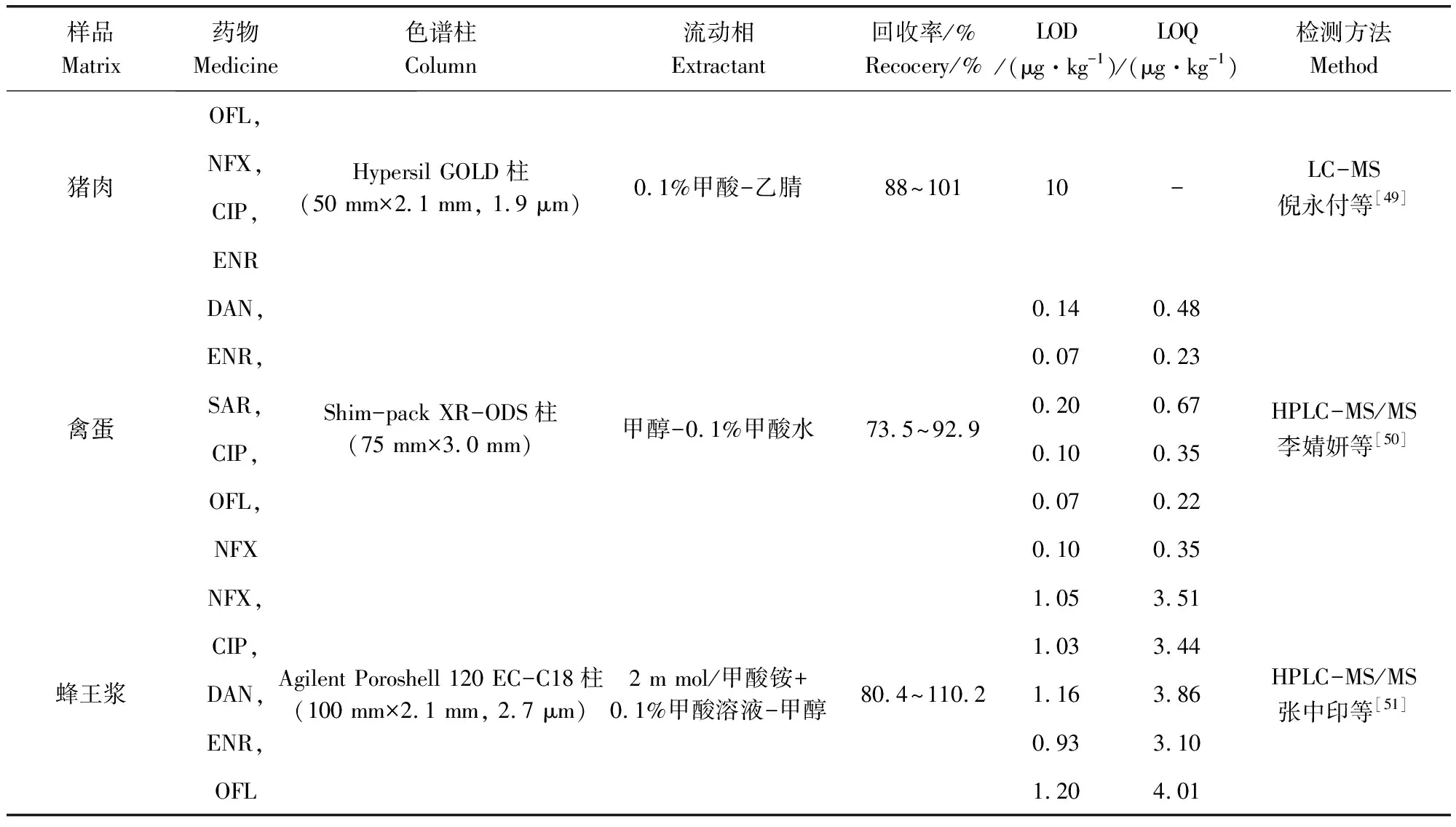
表4 液质联用法检测不同样品基质中氟喹诺酮类药物残留的比较Tab 4 Comparison of LC-MS methods for detection of fluoroquinolones in different matrices
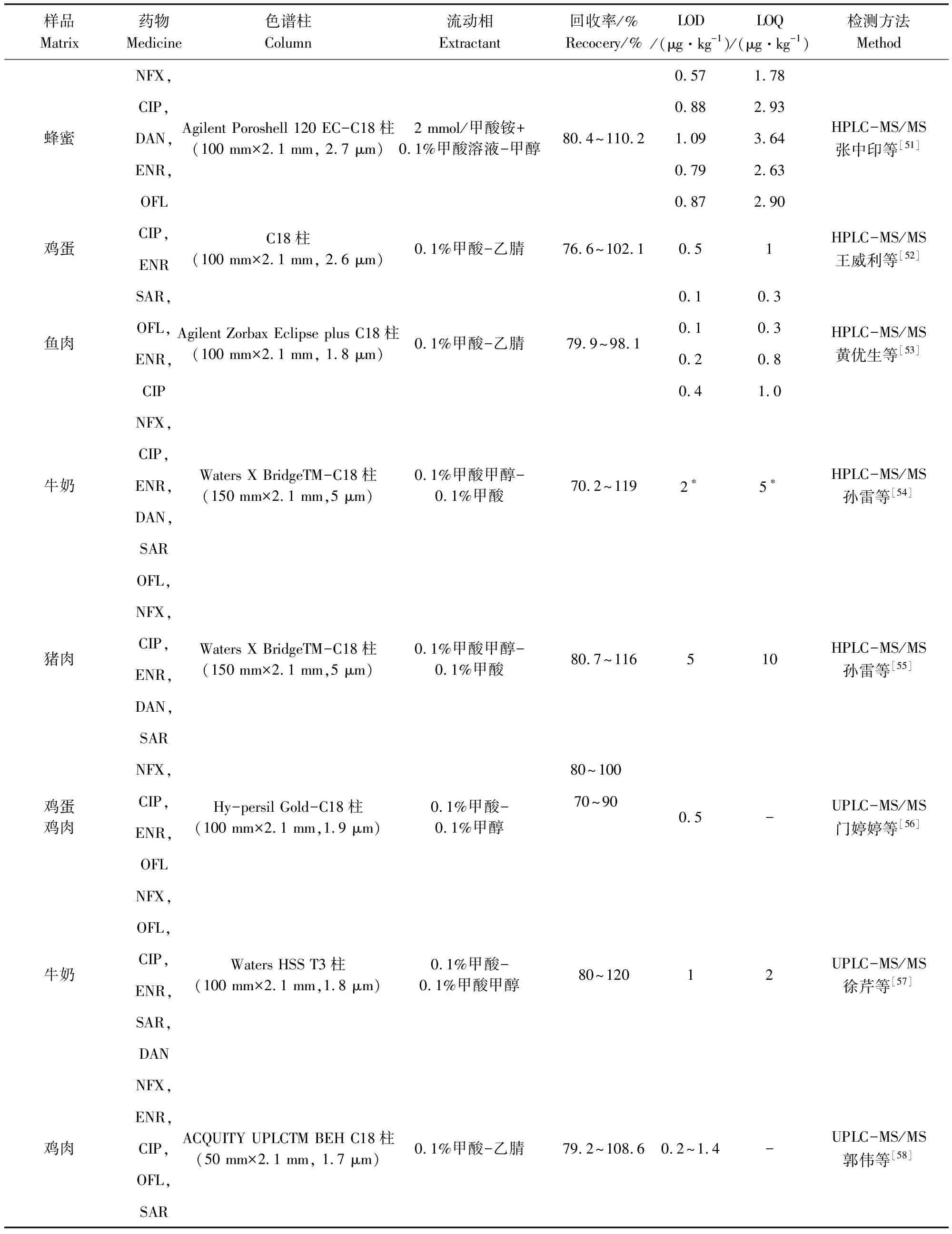
续表
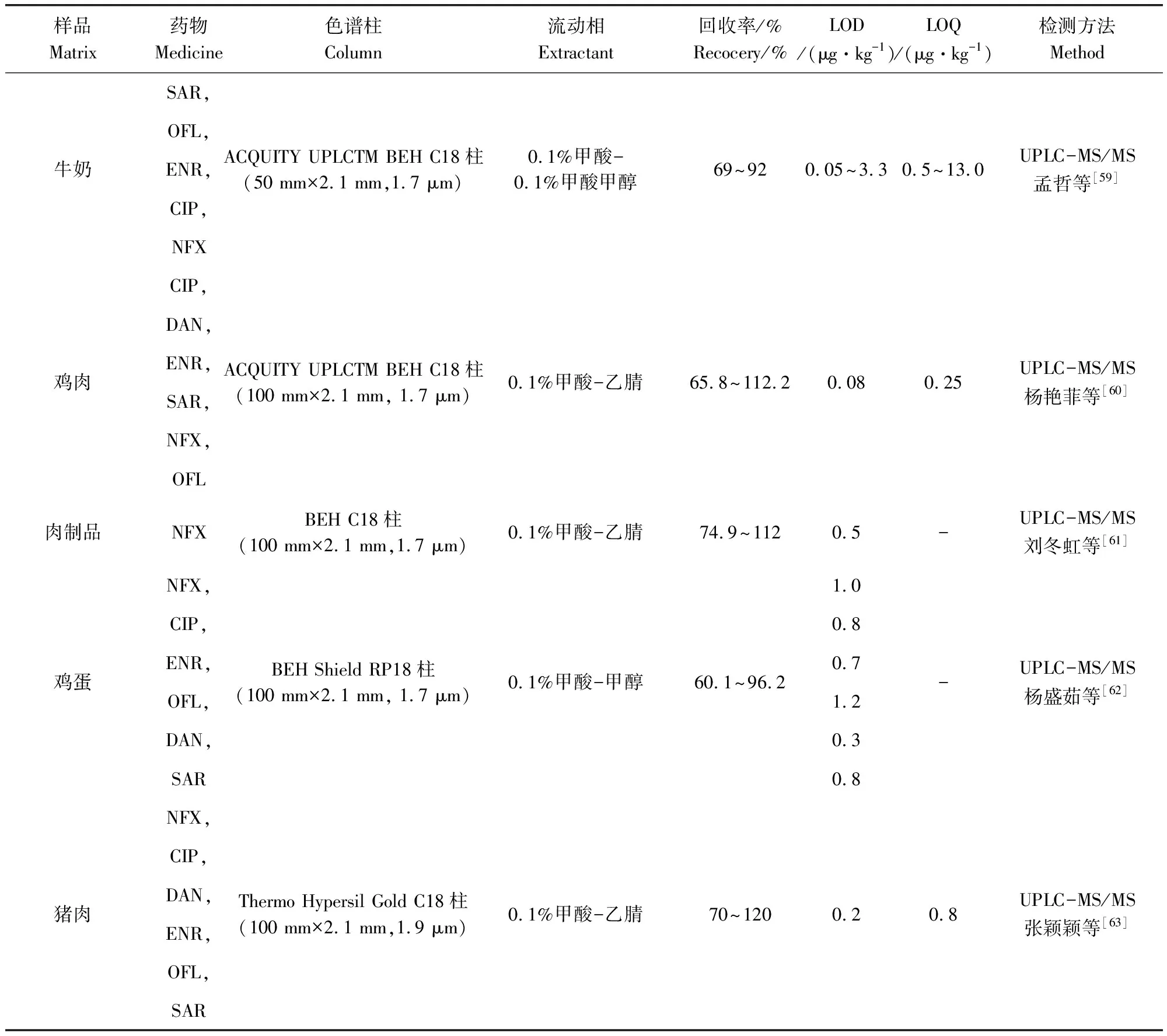
续表
3 展 望
当前,色谱和质谱检测FQs残留已经成为热门。其中HPLC-FLD、UPLC-FLD是FQs残留检测最常用的方法,与HPLC-FLD相比,UPLC-FLD具有分析效率高、流动相消耗少、灵敏度更高等优点,适合批量样品分析。两种方法也有应用局限,FLD只对荧光物质有响应,且基质中可能含有一些内源性荧光物质,从而会对目标物分析造成干扰。
液质联用法的应用已成为趋势,虽然MS可提高检测效率,但分析复杂样品时,有着难以排除基质干扰和共流出化合物的问题,MS串联可解决目标物的定性和定量问题,消除基质干扰,使检测结果更为准确可靠。UPLC-MS涵盖了极小颗粒填料、超低系统体积及超快速检测等新技术,在全面提升HPLC-MS的速度、灵敏度及分离度等诸多重要品质的同时,具有卓越的分离性能和高通量的检测水平,可以成为复杂体系分离分析以及化合物结构鉴定的良好平台,在FQs残留分析中具有独特优势。可以预测,HPLC、UPLC与质谱联用将是FQs残留检测的研究热点。
