复方枫蓼颗粒制备工艺研究
2019-02-26高彪蒋琪向蓉陈文露徐志宏彭新宇
高彪,蒋琪,向蓉,陈文露,徐志宏,彭新宇
(广东省农业科学院动物卫生研究所 农业部兽用药物与诊断技术广东科学观测实验站 广东省畜禽疫病防治研究重点实验室 广东省中兽药工程技术研究中心, 广州 510640)
复方枫蓼是民间防治胃肠道疾病的经典中药复方。由牛耳枫和辣蓼两味中药按2∶1的比例组成[1]。牛耳枫(DaphniphyllumcalycinumBenth.)又称牛耳铃,是属虎皮楠科(Daphniphyllaceae)虎皮楠属植物,具有极高的药用价值,果实及其枝叶均可入药[2]。该药具有活血散瘀、祛风止痛、止痢清热等功效,主治痢疾、风湿骨痛、感冒发热等疾病[3]。辣蓼(polygonumhydropiperL)又称柳蓼,为蓼科(Polygonaceae)蓼属(polygonum)植物[4]。全草可入药,具有止痢、活血化瘀、止痒杀虫等功效。主治腹泻、肠胃炎、风湿性关节痛、跌打损伤等[5]。现代药理研究表明,该复方中含有黄酮类、倍半萜类、生物碱类、有机酸类等化学成分[6-7],具有抗炎、镇痛、抑菌、抗溃疡性结肠炎、保护胃黏膜等多方面的药理作用,临床用其治疗急性胃肠炎、食滞胃痛等症,具有良好效果[8-9]。
牛耳枫、辣蓼临床用于预防及治疗胃肠道时,多为汤剂。但是汤剂煎煮程序麻烦、口服量大、口味不佳,且携带、贮存不变,与现代生活不相符合。而颗粒剂作为一种固体制剂,携带、贮藏及服用均方便,且药物稳定性及生物利用度高。研究通过单因素和正交实验确定了最佳提取工艺。在此基础上采用湿法制粒,考察颗粒剂的制备方法,以吸湿率、粒度合格率及溶化性、外观为考察指标筛选出枫蓼颗粒剂的制备工艺,并进行半成品的质量控制。旨在研究出质量稳定,服用方便的复方枫蓼颗粒。
1 材料与方法
1.1 材料 高效液相色谱仪,美国Waters公司;RE-5399型旋转蒸发仪,上海亚荣生化仪器厂;UV-3100PC型紫外分光光度计,上海美谱达仪器有限公司;SB25-12DT型超声波清洗机,宁波新芝生物科技股份有限公司;Metter-Toledo-xs型十万分之一天平,瑞士梅特勒公司;SHZD-D(Ⅲ)型循环式真空泵,巩义市予华仪器有限责任公司;804R型低温离心机,上海艾本德生物技术有限公司;DZF-6050型真空干燥箱,上海申贤恒温设备厂;HWS-158型恒温恒湿箱,宁波江南仪器厂;101-2型电热鼓风干燥器,上海浦东跃欣科学仪器厂。
牛耳枫药材购于广东茂名(批次201507);辣蓼药材购于广东茂名(批次201508);经广东药学院李书渊教授鉴定为蓼科植物水辣蓼PolygonumhydropiperLinn.和虎皮楠科植物牛耳枫DaphniphyllumcalycinumBench.。药材经低温干燥后,粉碎,过20目筛,按牛耳枫辣蓼2∶1的比例混合均匀,备用。
芦丁,批号100080-201409,中国食品药品检定研究院,纯度≥98%;槲皮素,批号10081-201509,中国食品药品检定研究院,纯度≥98%;乙腈,色谱纯;超纯水,自制;糊精;蔗糖;可溶性淀粉及实验中所用的其他试剂均为分析纯。
1.2 方法
1.2.1 提取液的配制 取枫蓼药粉(牛耳枫∶辣蓼=2∶1)20g,精密称定,置于500 mL圆底烧瓶中,按不同的提取工艺对药物进行回流提取,过滤,减压浓缩,溶剂定容至100 mL。
1.2.2 总黄酮含量的测定[16]精密吸取提取液1 mL,加30%乙醇至6 mL,加5%NaNO2溶液1 mL,摇匀,放置6 min;加10%Al(NO3)3溶液1 mL,摇匀,放置6 min;加4.3%NaOH溶液10 mL,再加30%乙醇溶液定容至刻度,摇匀,放置15 min后,以相应试剂为空白对照,于510 nm处依照UV法测定吸光度,通过总黄酮标准曲线方程计算总黄酮含量。
1.2.3 槲皮素含量的测定[17]色谱条件:Waters Symmetry shield RP18 色谱柱(4.6 mm×250 mm,5.0 μm);流动相:A为乙腈,B为0.4%磷酸水溶液;梯度洗脱:0~13 min,A为20%~45%;13~15 min,A为45%~60%;15~20 min,A为70%~20%;流速:1 mL/min;检测波长:370 nm;柱温:30 ℃;进样量10 μL,理论塔板数按槲皮素峰计算应不低于3000。测定槲皮素峰面积,通过标准曲线方程计算槲皮素含量。
1.2.4 出膏率的测定 精密量取定容后的枫蓼药液50 mL,置于已经干燥至恒定重量的蒸发皿中,将其水浴蒸干后,105 ℃恒温干燥3 h后,置于干燥器中放冷0.5 h后,迅速称重,计算出膏率。
1.2.5 提取工艺优化
1.2.5.1 提取溶剂的考察 水提取法:取枫蓼药粉20 g,精密称定,置于圆底烧瓶中,加水200 mL,浸泡1 h,加热回流1 h,减压浓缩至100 mL,过滤,即得,测定槲皮素、总黄酮含量及出膏率。
乙醇提取法:取枫蓼药粉20 g,精密称定,置于圆底烧瓶中,分别加45%、65%、85%的乙醇200 mL、浸泡1 h,减压浓缩至100 mL,过滤,即得,测定槲皮素、总黄酮含量及出膏率。
1.2.5.2 正交试验 在提取溶剂考察的基础上,选择料液比、乙醇浓度、提取时间及提取次数为影响提取效率的主要因素,设计三个水平,采用正交试验,见表1,以总黄酮、槲皮素的含量及出膏率为考察指标,进行综合评分,优选枫蓼药材最佳提取工艺。
1.2.6 浓缩干燥工艺的研究
1.2.6.1 浓缩工艺 减压浓缩具有浓缩效率高,温度低、有效成分损失少等特点。故本节对浓缩温度进行考察。按最佳提取工艺平行提取9次,制备9份提取液,6000 r/min离心10 min后,分别在0.08 mpa下以50 ℃、60 ℃、70 ℃浓缩至相对密度为1.15~1.25的浸膏,测定总黄酮平均含量。考察最佳浓缩工艺。
1.2.6.2 减压干燥工艺 温度是影响干燥效率的主要因素。故本节采用单因素变量法重点讨论温度的影响。将相对密度为1.15~1.25的浸膏分成9份,每份100 g,于60 ℃、70 ℃、80 ℃下真空干燥,以总黄酮含量为指标,考察最佳减压工艺。
1.2.7 成型工艺
1.2.7.1 辅料的选择 以制粒难易程度,外观、硬度等作为指标,筛选糊精、蔗糖、可溶性淀粉等辅料,找出最佳比例,确定湿法制粒最佳工艺条件。
1.2.7.2 湿法制粒 预实验表明影响制粒的因素主要包括:干燥温度、乙醇浓度、辅料用量及辅料与药粉的比例。故采用四因素三水平L9 (34)正交表(表2)安排正交试验,以吸湿率、粒度合格率、外观溶化性为考察指标进行处方筛选。
取已制备好的干膏粉30 g,以14目筛制颗粒,干燥后取出放冷至室温,14目筛整粒,即得。
吸湿率 精密称定枫蓼颗粒2 g,置于干燥至恒定重量的称量瓶底部,将称量瓶放置在相对湿度为75%干燥器内(瓶盖已打开)25℃放置48 h后称定颗粒重量。按公式(2)计算吸湿率。
吸湿率=(吸湿后颗粒重量—吸湿前颗粒重量)/吸湿前颗粒剂重量 ×100%(2)
粒度合格率 按照2010年版《中国药典》一部附录XIB法,取颗粒50 g于一号筛中,下面放置五号筛。水平往返轻叩3 min,取合格颗粒称重并按公式(3)计算粒度合格率。
粒度合格率(%)=合格的颗粒重量/过筛前重量×100%(3)
外观溶化性 外观根据颗粒硬度、均匀度及色泽进行判断;溶化性按照2010年版《中国药典》一部附录ⅠC项下溶化性检查法进行考察。二者共同采用十分制进行打分。
1.2.5.3 提取工艺验证试验 取枫蓼药粉3份,每份10 g,按照最佳提取工艺,以10倍量65%的乙醇回流提取2次,每次60 min,收集合并提取液,过滤,测定总黄酮含量、槲皮素含量及出膏率,计算RSD,对最佳提取工艺进行验证。
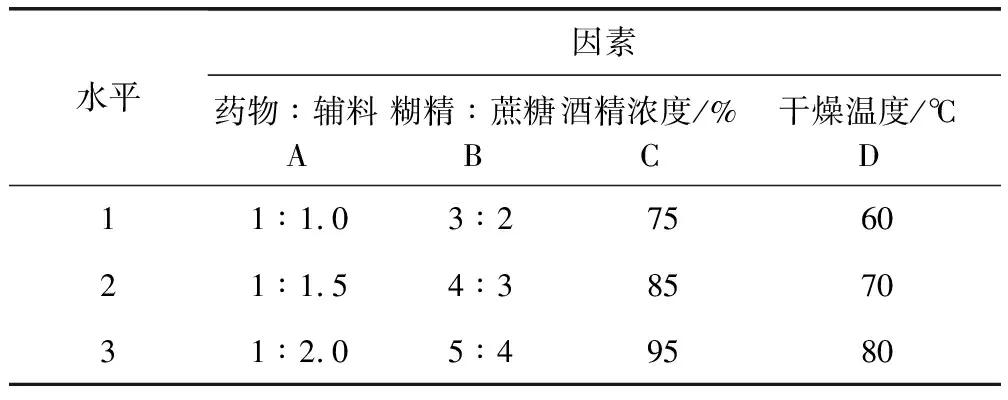
表2 制剂成型工艺因素水平表Tab 2 Factors of level of orthogonal test
1.2.7.3 制备工艺验证试验 按优选出的最佳工艺进行重复性试验验证。
1.2.8 半成品质量控制 为了保证成品颗粒制剂的稳定性及一致性,在制剂的制备过程中需要对颗粒剂半成品进行质量控制,故本研究考察了溶化性、休止角及临界相对湿度。
1.2.8.1 溶化性 照2010年版《中国药典》一部附录ⅠC项下溶化性检查法进行考察。5 min内,三批样品全部溶解,达到药典标准。
1.2.8.2 休止角 休止角是考察粉体或颗粒流动性的指标,通常采用漏斗法测定其角度。将漏斗置绘图纸上方一定的距离H,把制备好的颗粒从漏斗中倒入,直至颗粒形成的圆锥顶端与漏斗的出口处接触,圆锥体的直径为2R,锥体高度H,根据公式tanα=H/R即可求出休止角α,α越小流动性越好。
1.2.8.3 临界相对湿度 为了确定环境湿度对颗粒制剂生产及贮存的影响,故本节需对颗粒的临界相对湿度作出考察。
取干燥至恒重的成品颗粒2 g,平行取三份,放入相对湿度为20%、30%、40%、50%、60%、70%、80%、90%的环境中,25℃下放置96 h后取出,测定吸湿前后颗粒重量变化。
吸湿率=(吸湿后颗粒重量—吸湿前颗粒重量)/吸湿前颗粒重量×100% (4)
1.2.9 数据处理 采用SPSS20. 0 统计软件对所得所有数据进行处理,正交试验结果进行单因素方差分析。
2 结果与分析
2.1 提取溶剂的考察结果 分别考察了水回流提取以及45%、65%、85%乙醇提取的提取效率,结果见表3。以乙醇为提取溶剂时的提取效率优于以水为提取溶剂时的提取效率。故选择乙醇作为提取溶剂。

表3 不同提取溶剂试验结果Tab 3 Different extraction solvent tests
2.2 方差分析结果 由正交试验和方差分析结果(表4和表5)可知,A、B因素对提取效果具有显著性意义(P<0.05),C因素差异不显著,极差A>B>C>D,故对实验结果影响主次顺序为A(乙醇浓度)>B(提取次数)>C(提取时间)>D(加醇量),A因素中A2>A3>A1,B因素中B2>B3>B1,C、D为次要因素,故从节约时间原则上确定最优综合评分方案为A2B2C1D2。综合以上分析,确定本次试验最佳工艺为:10倍量65%的乙醇回流提取2次,每次60 min。

表4 正交试验结果表Tab 4 The results of the orthogonal
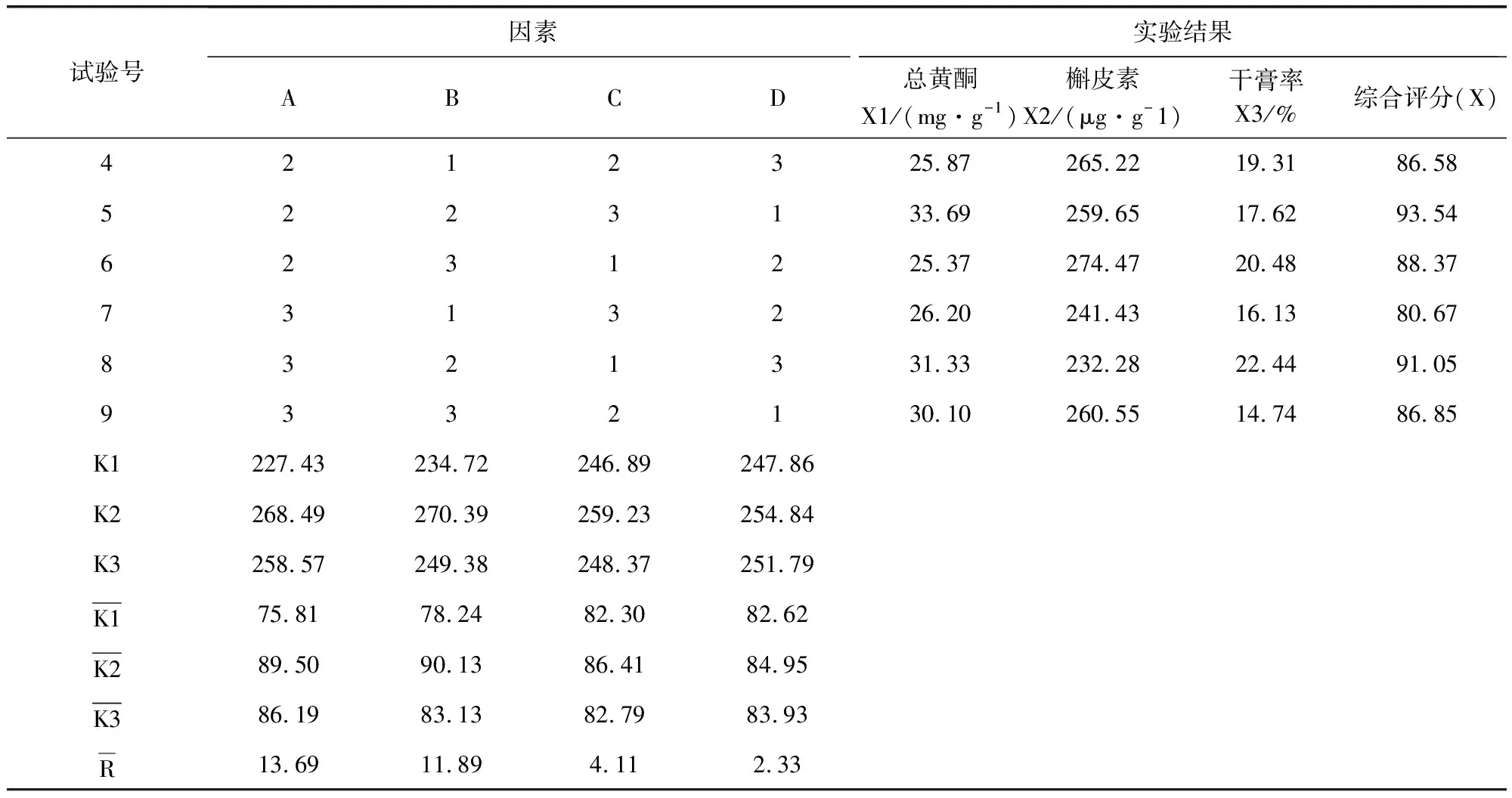
续表
X=(X1/X1mas)×40+(X2/X2mas)×40+(X3/X3mas)×20

表5 醇提取结果方差分析表Tab 5 Ethanol extraction of variance results
F0.05(2,2)=19
2.3 提取工艺验证结果 由表6可知,总黄酮RSD为0.88%、槲皮素RSD为0.14%,出膏率RSD为1.85%,说明该法重复性好。

表6 提取工艺验证结果表Tab 6 Confirming test of the technology
2.4 浓缩干燥工艺结果
2.4.1 浓缩工艺结果 将相对密度为1.15~1.25的浸膏分成9份,每份100 g,于60 ℃、70 ℃、80 ℃、90 ℃下真空干燥,计算干燥后总黄酮含量,由表7可知50 ℃时总黄酮含量最高,70 ℃时总黄酮含量最低,50 ℃和60 ℃含量差别不大,而70 ℃和60 ℃含量差别相对较大,因温度越高,浓缩时间越短,故选择浓缩温度为60 ℃减压浓缩。

表7 浓缩试验结果表Tab 7 The results of concentrate test
2.4.2 减压干燥工艺结果 由表8可知70 ℃总黄酮含量最高,80 ℃时次之,90 ℃最低,可能原因是60 ℃干燥时间过久,90 ℃温度过高导致成分损失。80 ℃相比之下干燥时间断,成分损失相对较少,故选择干燥温度为80 ℃。

表8 减压干燥试验结果表Tab 8 The results of decompression drying
2.5 成型工艺
2.5.1 辅料的选择结果 对于颗粒剂来说,目前常用的赋形剂包括乳糖、可溶性淀粉、蔗糖、糊精等。常用的润湿剂包括水和不同浓度的乙醇。预实验中考察了糊精、可溶性淀粉、蔗糖的吸水性。由图1知,糊精与蔗糖吸湿性较低。糊精具有价格低廉,且易溶于水,成型性好等特点,蔗糖用于药用辅料时具有矫味及粘合的作用。综合制粒效果及成本方面的考虑,故决定采用糊精及蔗糖组成混合的辅料。
2.5.2 湿法制粒 以干燥温度,乙醇浓度,辅料用量及辅料与药粉的比例为考察因素,选择三个水平,以吸湿率、粒度合格率,外观溶化性作为考察指标进行处方筛选,根据正交试验结果表(表9)及方差分析表(表10-表12)可知,在吸湿率测定中,C因素对试验结果具有显著性影响,A、B因素影响不显著,极差C>B>A>D,故影响吸湿率的主次顺序是C(酒精浓度)>B(糊精:蔗糖)>A(药物:辅料)>D(温度),C因素中C2>C1>C3,最优组合为处A3B1C2D1 。 在粒度合格率测定中,A因素对试验结果具有显著性影响,B、C因素影响不显著,极差A>B>C>D,故影响吸湿率的主次顺序是A(药物:辅料)>B(糊精:蔗糖)>C(酒精浓度)>D(温度),A因素中C2>C1>C3,最优组合为处A2B2C2D1。 在溶化性、外观测定中,A、B、C、D各因素差异均不显著,所以根据极差A>C>B=D,最优组合为A2B3C1D1。由表13综合分析可知,优选工艺为A2B1C2D1。即85%乙醇作润湿剂,药物与辅料比例为1∶1.5,糊精与蔗糖比例为3∶2,干燥温度为60 ℃。

图1 辅料吸湿性考察Fig 1 Hygroscopicity test

表9 制剂成型工艺正交试验结果表Tab 9 Results of orthogonal test
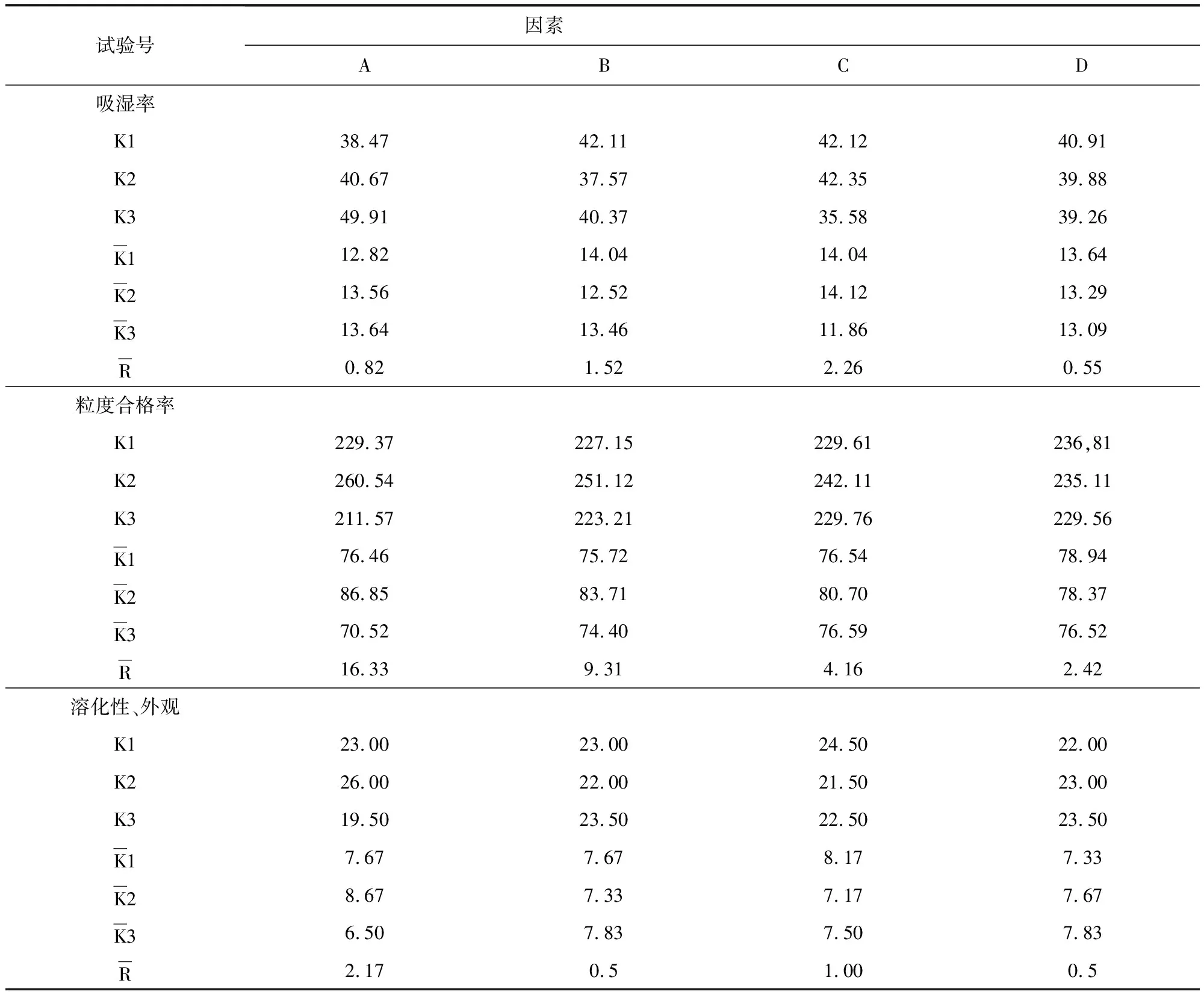
续表
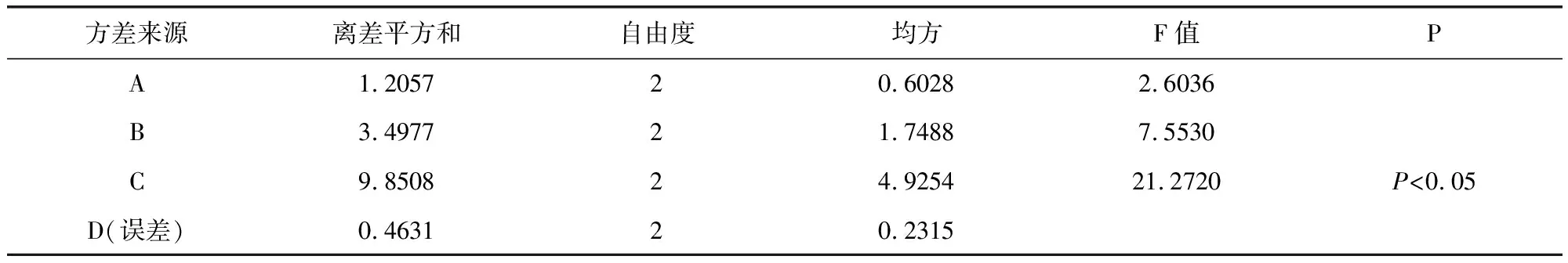
表10 吸湿率方差分析表Tab 10 Hygroscopicity of variance results
F0.05(2,2)=19

表11 粒度合格率方差分析表Tab 11 Granule pass rate of variance results
F0.05(2,2)=19

表12 溶化性、外观方差分析表Tab 12 Solubility and exterior of variance results
F0.05(2,2)=19

表13 工艺优化综合分析表Tab 13 The results of process optimization
2.5.3 制备工艺验证试验 由表14可知,吸湿率RSD为1.72%,粒度合格率RSD为90.99%,溶化性、外观RSD为0%,制备工艺重复性好。
2.6 半成品质量控制结果
2.6.1 溶化性 照2010版本《中国药典》一部附录ⅠC项下溶化性检查法进行考察。5 min内,三批样品全部溶解,达到药典标准。
2.6.2 休止角 为锥体直径为2R,锥体高度为H,tanα=H/R,计算α。由表13可知:平均休止角为34.2°<40°,表明颗粒流动性较好。

表14 验证试验结果表Tab 14 Verification of moulding technology

表15 止角试验结果表Tab 15 Angle of repose granule
2.6.3 临界相对湿度 不同湿度条件下颗粒平均吸湿率见表16。以环境相对湿度RH%为横坐标,平均吸湿率(%)为纵坐标作图。 由图2知,临界相对湿度在67%以上时,吸湿率明显加大。因此在制粒、包装、贮藏时,外界湿度应控制在67%以下。

表16 颗粒吸湿平衡试验结果表Tab 16 Moisture absorption rate of granule
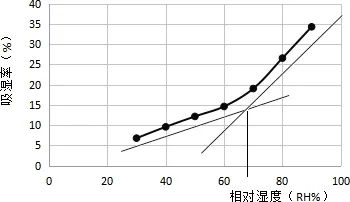
图2 不同相对湿度下浸膏粉的吸收率Fig 2 Hygroscopic rates in different RH
3 讨论与结论
中药颗粒剂是指中药材经过不同溶剂的提取,再与适宜的辅料或不封药材细粉以一定比例混匀,制成的感颗粒状剂型。颗粒剂的制备过程通常包括药材提取纯化、浓缩、干燥以及成型等工艺流程。是一种便于携带和服用的疗效显著提高的新剂型,具有易溶解、易吸收,生物利用度高、服用方便等特点[11]。
提取工艺是制剂过程中最重要的环节之一,对中药制剂的处方筛选及药物疗效起着根本性作用,传统提取方法提取效率低,目前中药复方提取工艺优化主要有正交设计、均匀设计及响应面设计等方法,安排多因素、多水平试验,设计合理试验方案[12-13]。本研究先采用单因素变量法考察提取溶媒的种类,再运用正交实验法以总黄酮含量、槲皮素含量以及出膏率为指标进行综合评价,筛选出最佳提取工艺为10倍量65%的乙醇回流提取2次,每次60 min。优选工艺稳定、可靠。苏春梅等[15]研究益母草颗粒的制备工艺时,采用正交试验优选出了最佳提取工艺。乔鹏等[16]在研究瓦松颗粒剂制备工艺时,也采用了乙醇连续回流提取法提取黄酮类有效成分。中药提取后,要进行浓缩成浸膏,是关系到制粒工艺的关键技术之一,浸膏相对密度越大,制粒时辅料加入量越少,服用剂量越少。通常采用简易的真空浓缩。该方法具有高效且有效成分损失小的特点。单因素变量法考察了浓缩温度对总黄酮含量的影响,确定最佳浓缩温度为60℃。干燥工艺采用真空减压干燥工艺,该法具有干燥时间短及干燥温度低等特点,能有效降低有效成分的。单因素变量法考察了干燥温度对总黄酮含量的影响,结果表明,80℃下干燥效率最高。
辅料是制备制剂时必要的物质,颗粒剂常用的辅料有乳糖、糊精、蔗糖。许玲玲等[17]在研究杉斛颗粒剂制备工艺时,考察了不同的辅料对颗粒剂的影响,发现淀粉和糊精(1∶1)混合制成的颗粒剂合格率最高。枫蓼颗粒剂的成型工艺辅料筛选中,考虑到成本因素及颗粒的成型性等因素,本研究选用了糊精和蔗糖。采用正交因素试验进行处方筛选出最佳成型工艺为85%乙醇作润湿剂,药物与辅料比例为1∶1.5,糊精与蔗糖比例为3∶2制软材,过14目筛,干燥温度为60 ℃,14目筛整粒即得。中间体质量控制考察了颗粒的溶化性、休止角及临界相对湿度。休止角测量法为评价颗粒流动性的常用且简便的方法,此法精确度不高,容易形成误差,因此要做平行试验3次,且注入物料是要尽量使其与标准圆锥形状接近,以减少试验误差。王秀丽等[18]在研究慈姑多糖部位颗粒剂制备工艺时,休止角测量3次,平均值为39°,流动性符合要求。本次结果显示颗粒全部溶解,休止角平均数为34.2°,流动性良好,临界相对湿度为67%。
