鼠李糖乳杆菌在防御鼠伤寒沙门菌感染中的保护作用
2019-02-26邵丽娜冯博廖野段冰洁杨文涛王春凤胡静涛
邵丽娜,冯博,廖野,段冰洁,杨文涛,王春凤,胡静涛
(吉林农业大学动物科学技术学院,吉林省动物微生态制剂工程研究中心,动物生产及产品质量安全教育部重点实验室,长春 130118)
乳酸菌(lacticacidbacteria,LAB)是一类无芽孢的、革兰氏阳性细菌,作为FAO和WHO定义的益生菌重要代表成员,在动物体内发挥着益生功能。一方面,乳酸菌本身能在肠道内定植、维护肠道菌群平衡,通过产生有机酸、细菌素等抗菌物质抑制肠道内有害菌的生长[1];另一方面,乳酸菌在肠道黏膜免疫调节中也发挥了重要作用,因其特有的定植位置和益生功能与肠道黏膜底层细胞关系密切、参与免疫细胞的调节和活化。因此,乳酸菌常应用于预防和治疗肠道病原菌感染引起的炎症和腹泻[2-3]。由于乳酸菌成员众多、菌株作用复杂多样,因此在影响机体免疫调节效应方面具有很强的菌株依赖性。部分菌株在宿主病理条件下(如坏死性小肠结直肠炎和过敏性机体)发挥抑制炎症效应;而某些菌株在体外实验中发现,其能通过促进TNF-α、IL-12和IL-8等细胞因子从而促进炎症发生。这些有免疫调节活性的菌株在活菌或灭活的情况下,均得到了相似的结果[4]。尽管如此,已知免疫活性较好的菌株仍然有限,本实验以在抑制慢性肠炎等方面具有潜在效应的LGG作为模式菌株[5],深入研究LGG参与机体的免疫调节作用,以开发更多益生菌株的潜在作用。
鼠伤寒沙门菌为革兰氏阴性菌,通过食入被污染的水造成人和动物胃肠道系统疾病[6]。该病原能够耐受胃肠道的酸性环境,进入小肠后,侵入肠道粘液层,入侵的细菌可被消化酶、分泌型IgA、抗菌肽以及其它固有免疫防御分子所清除。作为一种肠道模式病原菌,能在肠道中大量繁殖破坏肠黏膜上皮细胞屏障及菌群的平衡从而引发肠道类疾病。此外,它还能够通过巨噬细胞摄取从而破坏细胞紧密连接,进而转移到黏膜下层,造成动物肠道疾病。这种逃逸免疫系统是沙门菌存活的重要机制[7]。而LGG在建立黏膜屏障,提高免疫机能和活化抗原递呈细胞如巨噬细胞(Macrophage,Mφ)等方面具有突出优势[8]。本实验通过构建鼠伤寒沙门菌的肠炎模型,以评价LGG对该模型的防御保护作用,为LGG在预防和治疗肠道病原菌感染方面奠定基础。
1 材料与方法
1.1 实验动物及菌株
1.1.1 实验动物 6~8周龄SPF级雌性C57BL/6小鼠,购买于长春亿斯试验动物技术有限公司,均饲养在恒温(21~22 ℃)房间。
1.1.2 实验菌株 鼠李糖乳杆菌(LactobacillusrhamnosusGG, LGG)ATCC53103由吉林省动物微生态制剂工程研究中心实验室保存,鼠伤寒沙门菌(S.typhimurium,Sty)SL1344由河南科技大学程相朝教授惠赠并于吉林省动物微生态制剂工程研究中心实验室保存。
1.2 主要试剂和仪器 硫酸链霉素(山东鲁抗医药股份有限公司);琼脂粉、无水乙醇、二甲苯、中性树胶、苏木精-伊红染色(北京化学制剂公司);4%多聚甲醛(solarbio); PBS缓冲剂(HyClone); mouse NO Elisa试剂盒、IL-10 Elisa试剂盒、IL-12 Elisa试剂盒(上海朗顿)。高温烘箱DHG-9240A (上海一恒公司);低温超速离心机3V3O(德国SIGMA公司);电子分析天平ME204(岛津国际贸易(上海)有限公司);培养箱LRH-250F(上海一恒公司);漩涡振荡器MX-S(大龙兴创公司);全波长酶标仪Multiskan Go(Thermo Fisher Scientific)。
1.3 鼠伤寒沙门菌感染肠炎模型的建立及分组
1.3.1 肠炎模型建立 6~8周龄SPF级雌性C57BL/6小鼠口服硫酸链霉素20 mg/100μL,提供饮水和饮食。链霉素处理24 h后,给小鼠口服5×107CFU/100μL的鼠伤寒沙门菌[9]。感染后48 h无菌收取肠系膜淋巴结、肝脏、脾脏进行器官指数和沙门菌荷菌数检测,H&E染色检测肠道的病理变化,ELISA检测肠道细胞因子分泌水平等。
1.3.2 实验分组 将小鼠随机分为4组,每组5只。第1组为生理盐水对照组(命名为Saline):每天灌胃100 μL生理盐水,连续灌胃9 d。第2组为鼠李糖乳杆菌对照组(命名为LGG):在造模前提前7 d灌胃5×108CFU/100μL鼠李糖乳杆菌,此后灌胃等量生理盐水直到第9天;第3组为沙门菌感染模型组(命名为Sty):在造模前提前7 d灌胃100 μL生理盐水;第4组为鼠李糖乳杆菌干预组(命名为LGG+Sty):造模前提前7 d灌胃5×108CFU/100μL鼠李糖乳杆菌,Sty组和LGG+Sty组第8天开始按照1.3.1方法感染鼠伤寒沙门菌,实验重复3次,实验过程中无小鼠死亡。
1.4 肠道病理分析 无菌PBS冲洗盲肠、结直肠内容物,截取1 cm肠段固定于4%多聚甲醛中,石蜡切片及苏木精-伊红染色:梯度脱水-透明-浸蜡-包埋-切片-烤片-脱蜡-水化-苏木精染核-1%盐酸分化-0.5%氨水反蓝-伊红染色-梯度脱水-透明-封片。具体参考Myunghoo Kim[10]的步骤,并对病理损伤进行分析。
1.5 器官指数分析 取小鼠脾脏、肝脏、盲肠、结直肠样品进行称重,按照器官重量/尸重,计算器官指数,进行统计。
1.6 器官中沙门菌荷菌数的检测 无菌取脾脏、肝脏,称重后将样品用预冷PBS进行研磨并稀释。取100 μL稀释好的样品涂布在浓度为20 mg/mL硫酸链霉素的LB琼脂板上,37 ℃培养过夜,观察菌落状态并计数。
1.7 细胞因子检测 PBS冲洗取盲肠内容物并置于研钵中液氮研磨,4 ℃ 3500 r/min离心20 min,取上清用于检测组织中分泌的细胞因子水平,检测方法按照eBioscience ELISA试剂盒说明书方法操作,并在酶标仪450nm处读取吸光值。
1.8 体重及存活率检测 采取1.3.1和1.3.2方法进行模型建立及分组,监测小鼠体重并观察小鼠一般状态及记录死亡情况。
2 结果与分析
2.1 LGG对沙门菌引起肠道损伤的缓解作用 病理检测结果如图1显示,LGG和Saline组结直肠和盲肠腺体完整,无出血点;Sty组肠道的大部分腺体被破坏,肠黏膜脱落,有大量的炎性细胞浸润以及出血点;而LGG+Sty组腺体结构较完整,有少量炎性细胞浸润和出血点。结果表明LGG可以有效缓解鼠伤寒沙门菌造成的肠道病理损伤。
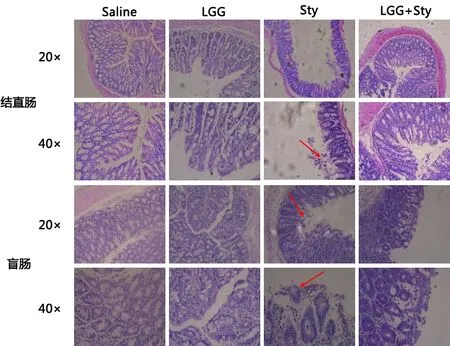
图1 结直肠和盲肠的病理变化Fig 1 Colon and cecum pathology change
2.2 LGG能改善沙门菌引起小鼠的器官损伤 检测脾脏器官指数如图2a、2b所示,Sty组脾脏眼观明显比Saline组肿大且器官指数显著增加(P<0.01),而LGG+Sty组脾脏肿大有所缓解,并且器官指数较Sty组明显下降(P<0.05)。盲肠器官指数如图2c所示,Sty组盲肠内容物减少且重量减轻。 Sty与LGG+Sty组比较差异显著(P<0.05),LGG和LGG+Sty组盲肠器官指数较Sty组有所改善。结果表明LGG能缓解沙门菌引起小鼠的器官损伤。
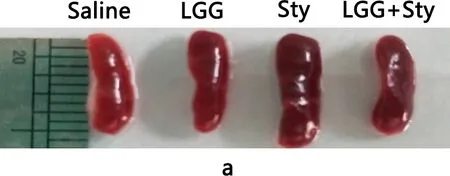

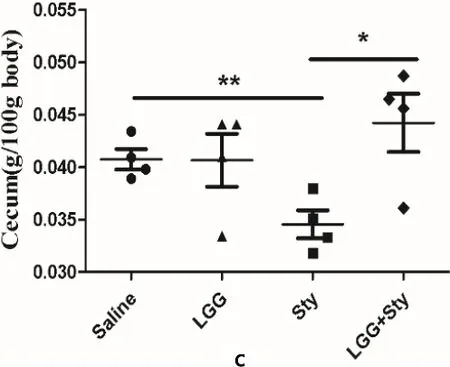
a:脾脏眼观病理变化程度;b:脾脏的器官指数;c:盲肠的器官指数a: Degree of pathological changes in the spleen eye; b: Organ index of the spleen; c: Organ index of the cecum图2 脾脏及盲肠的器官指数Fig 2 Organ index of the cecum and spleen
2.3 LGG对沙门菌侵袭器官组织的影响 对小鼠盲肠、脾脏、肝脏以及肠系膜淋巴结的沙门菌荷菌数检测,结果如图3所示。Saline和LGG组器官中并未检测到沙门菌,而LGG+Sty比Sty组脾脏和肝脏的荷菌数显著减少(P<0.001),肠系膜淋巴结的荷菌数显著减少(P<0.01),说明LGG能有效抑制沙门菌侵袭其他器官组织。

图3 沙门菌在体内器官定植分布数量检测Fig 3 Detection of S.typhimurium loads in tissue
2.4 LGG对细胞因子分泌水平的影响 如图4a、4b所示LGG+Sty组一氧化氮(NO)和白细胞介素-12(IL-12)分泌水平显著降低 (P<0.001)。而如图4c所示白细胞介素-10(IL-10)分泌显著增加(P<0.05)。初步表明LGG可能通过调节Th2型细胞因子的分泌,维持肠道免疫平衡,缓解肠道炎症反应。
2.5 LGG对小鼠体重及死亡情况的影响 小鼠体重监测结果如图5a所示,Saline和LGG组小鼠体重缓慢上升,LGG+Sty比与Sty组体重丢失有所缓解。小鼠存活率监测如图5b可见Saline和LGG组无小鼠死亡。Sty组在第11天全部死亡,而LGG+Sty与Sty组相比死亡率有所降低。结果表明,LGG对感染鼠伤寒沙门菌的小鼠体重丢失有一定的改善,并且能缓解沙门菌引起的小鼠死亡。
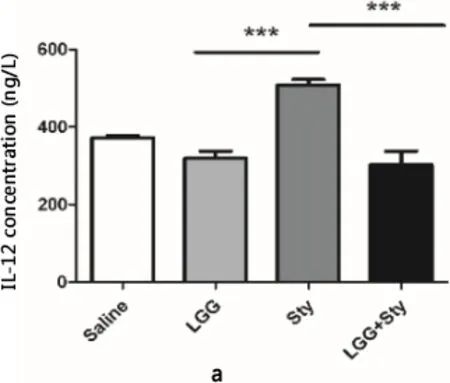

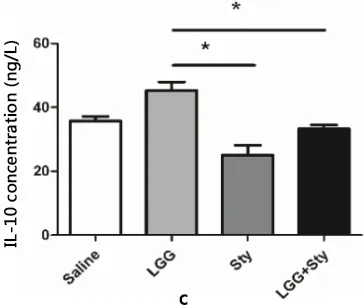
a:促进炎性细胞因子IL-12分泌水平; b:炎性介质细胞因子NO分泌水平;c:抑制炎性细胞因子IL-10分泌水平a: Promote inflammatory cytokine IL-12 secretion level; b: Inflammatory mediator cytokine NO secretion level;c: Inhibit inflammatory cytokine IL-10 secretion level图4 盲肠组织细胞因子检测Fig 4 Cecal tissue cytokine detection
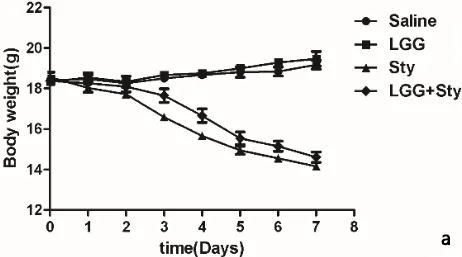
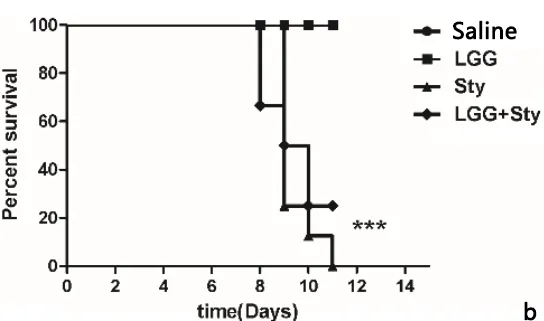
a:小鼠的体重情况监测;b:小鼠的死亡情况监测a: Detection of body weight in mice; b: Detection of death in mice图5 小鼠体重变化及存活率的监测Fig 5 Detection of body weight change and survival rate in mice
3 讨论与结论
鼠伤寒沙门菌是一种胞内寄生的肠道病原菌,能引起人和动物肠道疾病。近年来,滥用抗生素增强了细菌的耐药性,破坏了微生态环境。为寻找抗生素的替代物,益生菌以能在肠道定植的优势逐渐成为研究热点。本实验评估了LGG在鼠伤寒沙门菌诱导肠炎模型中的作用,发现LGG+Sty组能改善肠道组织的病理损伤,减少鼠伤寒沙门菌侵袭器官组织的能力,改善小鼠的体重及死亡率,说明LGG能缓解鼠伤寒沙门菌引起的肠道炎症,这与Jian Ji等[12]的研究一致。这一过程可能与LGG参与激活机体的免疫防御功能、缓解机体的炎症反应有关。本实验也发现LGG能调节肠道Th1和Th2细胞因子的分泌水平,减少NO和IL-12分泌以及增强IL-10分泌,这与Trine Eker Christoffersen等[13]的研究一致,表明乳酸菌在调节和维持肠道免疫平衡方面具有重要作用[14]。这些研究为LGG在缓解鼠伤寒沙门菌诱导肠炎的机制研究奠定基础。
乳酸菌对机体的免疫调节机制十分复杂,免疫细胞(如Mφ)在免疫调节的过程中也扮演着重要角色。LGG与Mφ共作用,使Mφ产生NO、IL-12和IL-10等细胞因子,调节Mφ的免疫功能及吞噬能力,参与模式识别受体(PRRs)包括ToLL样受体(TLRs)、Notch、核因子κB(NF-κB)信号通路等,这些通路之间的相互作用调节Mφ的免疫功能,降低机体的炎症反应。因此我们有必要对LGG缓解鼠伤寒沙门菌诱导的肠炎作用机制进一步探索,从而为炎症疾病提供新的治疗方向。
