LPS和嗜水气单胞菌胁迫下东北林蛙不同组织内TBK1转录产物表达动态的研究
2019-02-26曲俐俐柴龙会王伯驹肖向红
曲俐俐 柴龙会 王伯驹 许 晴 肖向红
(东北林业大学,哈尔滨,150040)
两栖类由于其生物学特性,更容易受到病原微生物的侵袭[1-2],其中以嗜水气单胞菌(Aeromonashydrophila,Ah)引起的以“红腿病”为特征的败血症是导致两栖类种群数量锐减的主要原因[3-4]。东北林蛙(Ranadybowskii)作为东北地区的优势两栖类物种[5],对其感染后先天性免疫应答的研究尤为重要。Toll样受体(Toll-like recepters,TLRs)是近年来备受关注的一类模式识别受体(pattern recognition receptor,PRR),其能选择性识别侵入机体的病原微生物的病原相关分子模式(pathogen associated molecular pattern,PAMP),继而激活相应的信号转导通路,完成免疫应答[6]。TLRs通过识别不同的PAMPs来激活天然免疫,其中TLR4特异性地识别革兰阴性菌的细胞壁成分脂多糖(lipopolysaccharides,LPS)[7]。LPS为Ah细胞壁的重要组成成分。LPS是一种特异性的PAMP,该分子可被TLR4分子所识别,并通过髓样分化因子(myeloid differentiation factor 88,MyD88)和IκB激酶(inhibitor of nuclear factor kappa-B kinase,IKKs)等接头蛋白将信号传递入细胞核,进而激活效应分子白细胞介素等的表达,完成免疫应答反应[8]。有研究证实,TANK结合激酶1(TANK binding kinase-1,TBK1)是TLR4信号通路中激活并调节效应分子表达的重要调控因子[9-10]。TBK1可以磷酸化IRF3,诱导干扰素的表达,在机体先天免疫应答系统中发挥着重要作用[11]。
本研究以东北地区优势两栖类物种东北林蛙为研究对象,通过荧光定量PCR技术检测东北林蛙在Ah和LPS胁迫下,其肝脏、肾脏、脾脏和肺脏的TBK1 mRNA表达量变化。通过TBK1分子的表达量的变化,推测东北林蛙不同脏器中不同刺激源对TLRs的影响。
1 材料与方法
1.1 材料
1.1.1 试验用动物及菌株
东北林蛙,雄性,3龄,2017年9月捕获于黑龙江省伊春地区。室温驯养一周。嗜水气单胞菌株(1.1801)购自中国科学院微生物研究所,由实验室保存。
1.1.2 主要试剂
TRIzol@Reagent为Life Technology公司产品;2.5×Real Master Mix(SYBR Green)、2000 DNA Ladder天根生化科技有限公司;样品保存液、Prime Script RT reagent Kit为宝生物工程有限公司,脂多糖(LPS:E coli O55:B5)购自sigma-aldrich。
1.2 方法
1.2.1 Ah悬浮液的制备
将冻存菌液复苏、平板划线培养。挑取单菌落植于LB液体培养基中,180 r/min,28℃条件下摇床培养,OD600检测菌液浓度范围为0.4~0.6,将其菌悬液稀释为107CFU/mL,4 ℃备用。
1.2.2 总RNA提取和RT-PCR扩增
本试验设嗜水气单胞菌(Ah)组、LPS组和LB组(对照),根据实验室前期研究,分别于腹腔注射LB培养基、嗜水气单胞菌液(1×107cfu/mL)和LPS溶液(1 mg/mL,溶于灭菌的LB培养基中)各1 mL。分别取刺激后4 h、6 h、8 h、12 h、24 h、36 h、72 h时东北林蛙肝、肺、肾及脾组织各0.4 g,置于灭菌离心管中,加1 mL样品保存液,-80℃保存。TRIzol法提取组织总RNA,琼脂糖凝胶电泳和紫外分光光度计检测其浓度及完整性。
1.2.3 引物设计
根据前期高通量测序所获东北林蛙TBK1基因序列,参照非洲爪蟾(Xenopuslaevis)等多物种TBK1基因序列,利用Primer 5.0设计上下游引物(表1)。
按照PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒进行逆转录。以其为模板进行PCR反应,产物通过琼脂糖凝胶电泳进行检测。选取所需条带进行胶回收,并对回收产物进行电泳。将回收所得的DNA片段,插入到pMD18-T载体转化培养,并对阳性克隆进行筛选,最后通过质粒小提试剂盒提取质粒并测序分析。
表1 引物序列
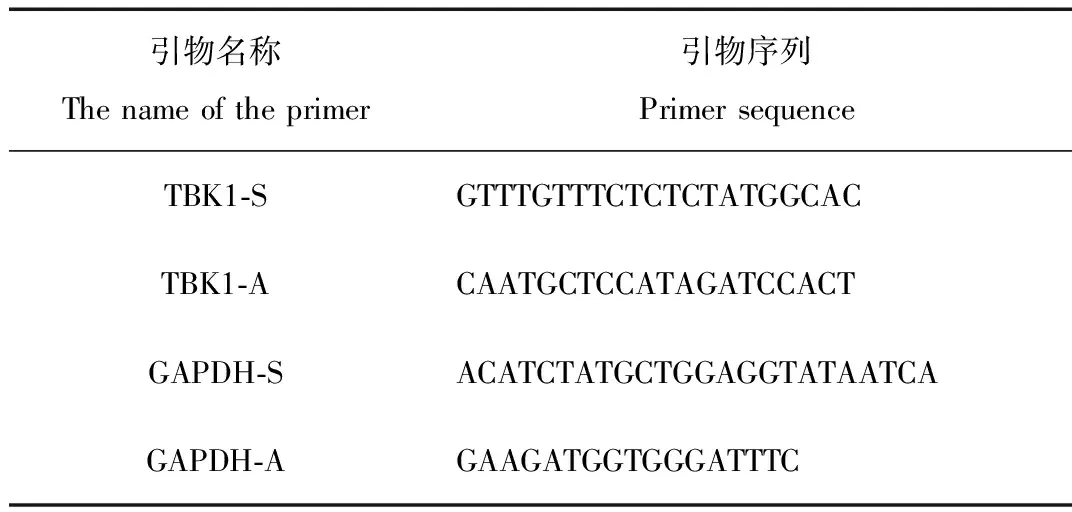
Tab.1 Primer sequence
实时荧光定量PCR用CFX96TM Real-Time System(Bio-Rad Iabora-tories,Inc.)进行。反应体系如下:2.5×Real Master Mix(SYBR Green)12.5 μL,PCR Forward Primer(10 μM)1 μL,PCR Reverse Primer(10 μM)1 μL,DNA模板 2 μL,ddH2O 8.5 μL。每个样品重复3次。PCR反应条件为:94℃ 2 min;94℃ 30 s,54℃ 30 s,72℃ 30 s,40个循环;72℃ 5 min。每1个周期在72℃延伸这一步骤时检测荧光值。
1.2.4 数据收集处理和分析
CFX Manager软件(Bio-Rad Laboratories,Inc.)计算每个反应的平均拷贝数和对应的GAPDH的平均拷贝数,2-△△Ct法分析Ah组、LPS组和对照组的mRNA相对表达量。SPSS(22)的T-test法检验不同样本之间表达量是否有显著差异。
2 结果与分析
2.1 总RNA提取结果
紫外分光光度计检测所提取样品总RNA的OD260/OD280均在1.8~2.0。1.5%琼脂糖凝胶电泳检测总RNA质量,其28S、18S和5S RNA条带清晰(图1),质量符合要求,可进行后续试验。
2.2 RT-PCR扩增结果
用反转录试剂盒获得cDNA后,进行PCR扩增,得到明亮清晰的条带(图2),产物大小与预期片段长度一致,经测序显示该条带与高通量测序结果一致。条带单一无杂带、无引物二聚体及非特异性产物,表明试验所得反转录产物与所设计的引物均满足后续荧光定量试验的要求。
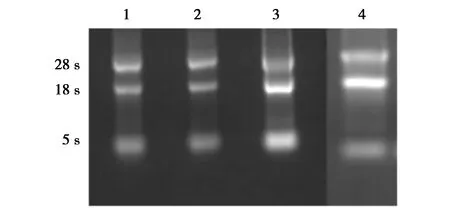
图1 总RNA电泳图Fig.1 Results of total RNA
注:1.肝脏,2.心脏,3.肾脏,4.脾脏RNA
Note:1.The liver,2.The lung,3.The kidneys,4.The spleen RNA
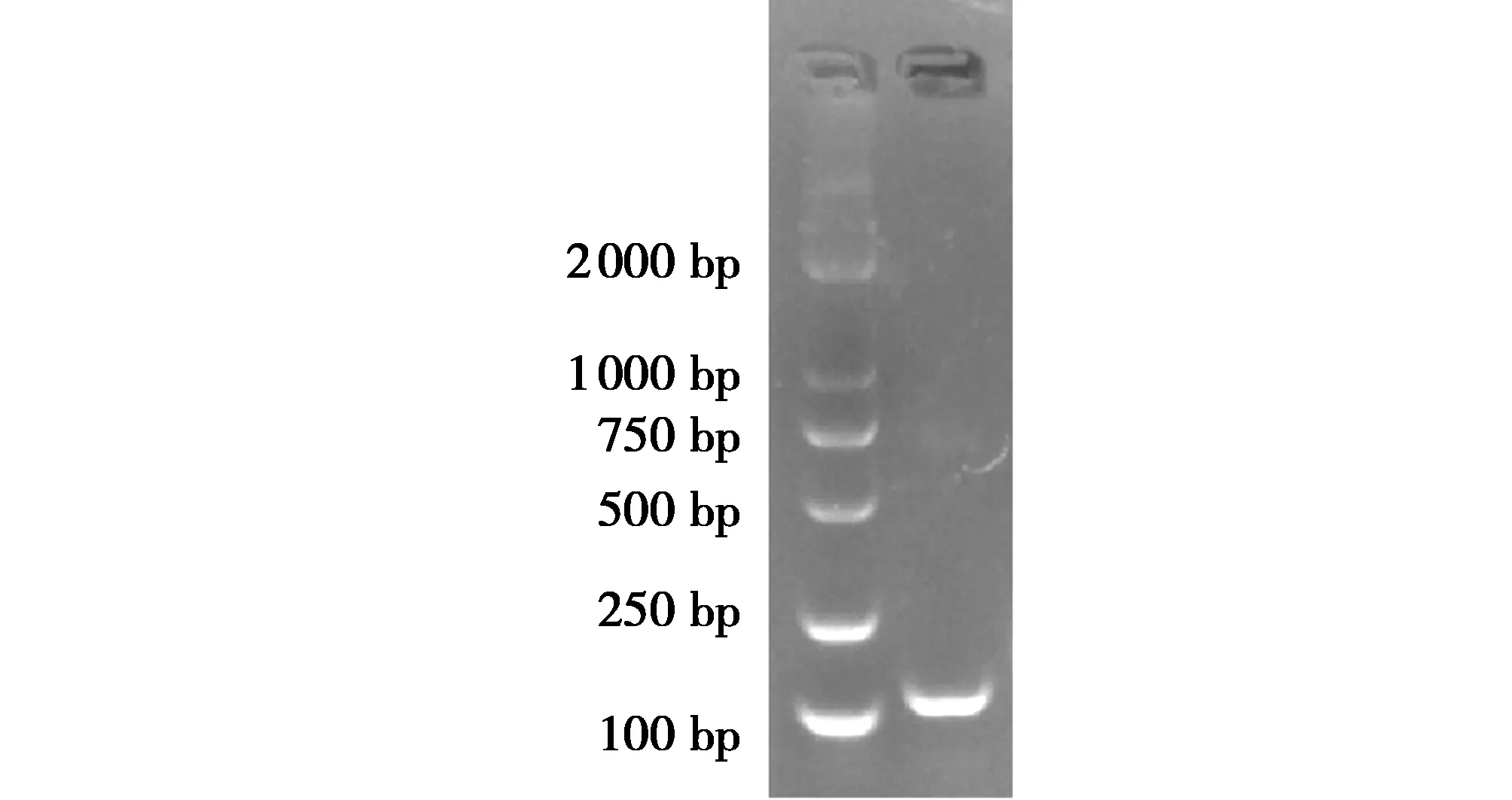
图2 RT-PCR扩增结果Fig.2 Results of RT-PCR
2.3 东北林蛙TBK1 mRNA的熔解曲线
如图3所示,各组TBK1 mRNA的熔解曲线均出现单一峰。结果表明,所设计引物经PCR反应所得产物单一且无引物二聚体产生,其荧光值均来自特异性的扩增产物。
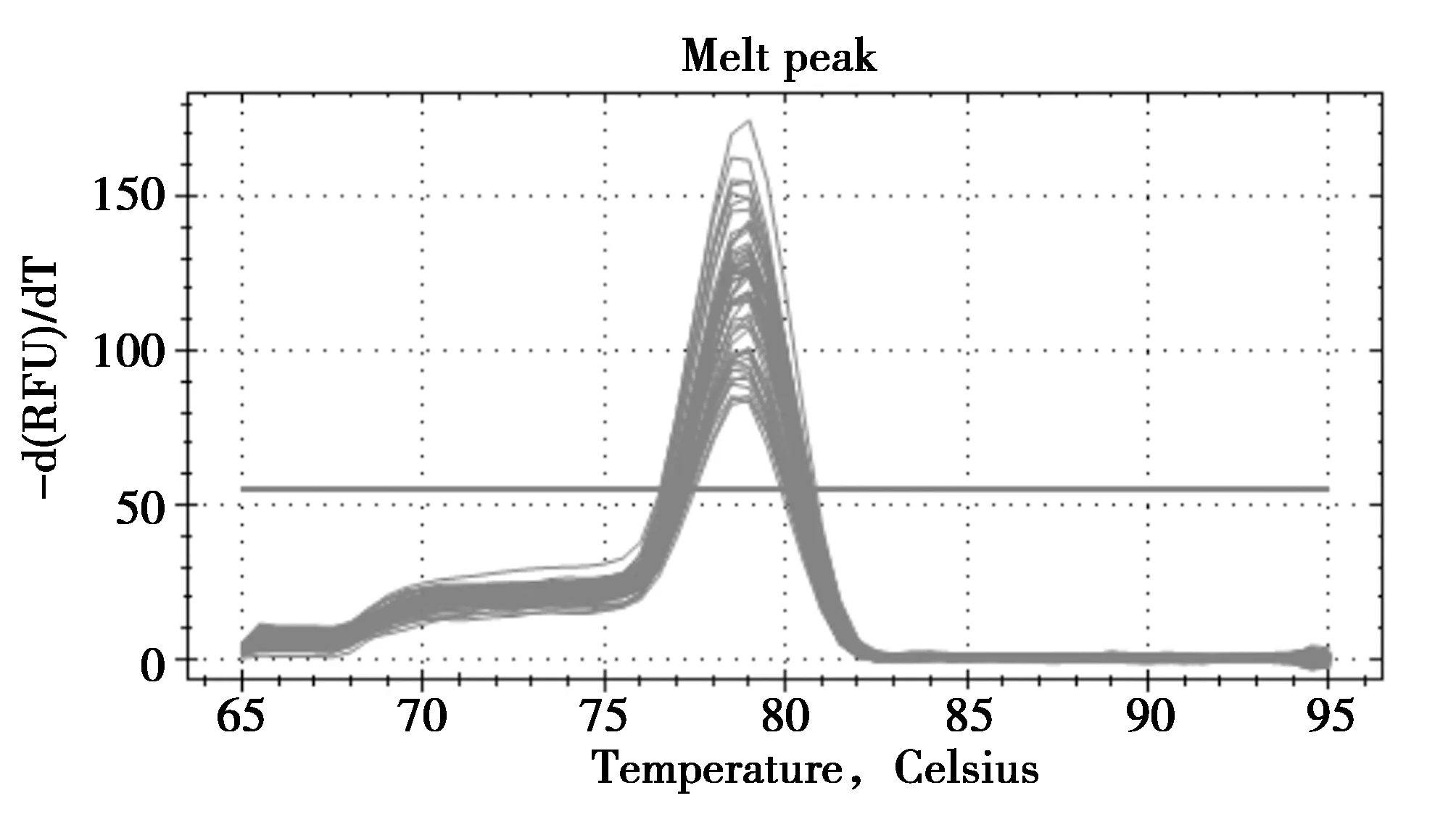
图3 荧光定量PCR溶解曲线图Fig.3 Quantitative dissolution curves
2.4 嗜水气单胞菌与LPS刺激下不同组织TBK1 mRNA转录水平变化
2.4.1 东北林蛙肾脏TBK1转录水平变化
如图4所示,与LB组(对照)比较,Ah和LPS感染肾脏后的TBK1 mRNA表达量变化趋势大致相同,均在6 h和72 h有上调表达,在8~24 h维持低表达水平。LPS组在6 h达到峰值,为对照组12.46倍(P<0.01);Ah组在72 h达峰值,为对照组11.33倍(P<0.01)。

图4 东北林蛙肾脏TBK1转录水平变化(与对照组比,*P<0.05,**P<0.01)Fig.4 Transcript levels of TBK1 in the kidney of Rana dybowskii(Compared with the control group,*P<0.05,**P<0.01)
2.4.2 东北林蛙肺脏TBK1转录水平变化
如图5所示,与LB组(对照)比较,Ah组和LPS组TBK1 mRNA的表达量变化趋势相反。Ah组TBK1 mRNA表达量在4~12 h变化不显著,24 h到达峰值,为对照组的6.7倍(P<0.05),36~72 h表达量虽有下降,但仍远高于本底水平;LPS组则在6 h和12 h表达明显上调,在12 h达峰值,为对照组的10.76倍(P<0.01),24~72 h表达量维持在本底水平。

图5 东北林蛙肺脏TBK1转录水平变化(与对照组比,*P<0.05,**P<0.01)Fig.5 Transcript levels of TBK1 in the lungs of Rana dybowskii(Compared with the control group,*P<0.05,**P<0.01)
2.4.3 东北林蛙肝脏TBK1转录水平变化

图6 东北林蛙肝脏TBK1转录水平变化(与对照组比,*P<0.05,**P<0.01)Fig.6 Changes of liver TBK1 transcription level in Rana dybowskii(Compared with control group,*P<0.05,**P<0.01)
如图6所示,与LB组(对照)比较,Ah组肝脏中TBK1 mRNA呈上调表达,12 h达峰值,为对照组9.81倍(P<0.01),随后迅速下降,待36 h又出现上调,72 h迅速下降至低于本底水平;LPS组TBK1 mRNA表达水平变化不显著,除了在36 h有小幅度上调,为对照组2.09倍,其余均在本底水平波动。
2.4.4 东北林蛙脾脏TBK1转录水平变化
如图7所示,与LB组(对照)比较,Ah组脾脏中TBK1 mRNA表达量除12 h为对照组的8.16倍(P<0.01),其余时间表达量均为对照组的2倍左右;LPS组TBK1 mRNA表达量在4 h达到峰值,为对照组的9.86倍(P<0.01),后逐渐下降,且在6~8 h维持在较低水平。12~36 h又出现上调表达,72 h其表达水平迅速下调,低于本底水平。

图7 东北林蛙脾脏TBK1转录水平变化(与对照组比,*P<0.05,**P<0.01)Fig.7 Transcript levels of TBK1 in the spleen of Rana dybowskii(Compared with the control group,*P<0.05,**P<0.01)
3 讨论
两栖类是从水生鱼类到陆生的过渡类群,在其生存与进化的过程中,免疫系统担负着保护两栖类免受病原体感染的重任,其中TLRs等介导的先天性免疫是两栖类抗病免疫的第一道防线,并在连接先天性免疫与获得性免疫反应中起着桥梁作用。有关哺乳动物的研究表明[12-13],TBK1是Toll样受体信号转导途径中非常重要的衔接分子,也是将信号传导给下游的关键。
本研究结果显示,东北林蛙在注射Ah和LPS后,TBK1的转录水平发生显著变化,且在不同组织器官中的变化程度差异显著。在脾脏和肺脏中,TBK1分子的表达量变化在不同的刺激源刺激下,呈相反的变化趋势。这一现象提示,在脾脏和肺脏,甚至其他区域,对外源性病原体的识别和应答反应时间存在差异。而在肾脏中,TBK1分子的表达量在不同刺激源刺激下呈现相同的趋势,推断这两种不同刺激源其在肾脏中免疫应答的时间大致相同。在脾脏中,LPS与Ah均会引起TBK1出现表达量上调,推测其在机体受到刺激后发挥主要的免疫功能。
TLRs是一类从线虫到哺乳动物都保守的模式识别受体[14]。在鱼类的相关研究中,TLRs及参与其信号通路的重要调控因子的主要特征与哺乳类TLR系统具有很高的相似性[15]。周超[16]的实验表明小鼠在LPS的刺激下TLR4、TBK1、肿瘤坏死因子α(Tumor necrosis factorα,TNF-α)和干扰素β(Interfern-β,IFN-β)的转录水平明显升高。实验证明其确实激活TLR4-TBK1通路。尹月[17]关于鸡的实验也证明其确实使TBK1、IRF3、IFN-α和IFN-β分子的转录水平增高。本实验结果与之相一致。
根据本实验结果,推测东北林蛙在识别Ah和LPS过程中,机体内免疫相关分子TBK1转录水平发生了显著变化。说明该分子在蛙类抗细菌感染过程中发挥作用。在刺激源刺激下,不同的脏器中TBK1的表达量存在一定的差异,推测在受到外源微生物刺激时不同脏器免疫应答的时间和所选择激活的免疫通路有显著差异。
