红芪多糖干预内毒素诱导的葡萄膜炎模型中糖原合成酶3-β的表达及其作用机制△
2019-02-25杨硕余朔刘新丽于晋懿张孝生卢弘
杨硕 余朔 刘新丽 于晋懿 张孝生 卢弘
葡萄膜炎是严重的眼部炎症性疾病,也是主要的致盲性眼病,其中以急性前葡萄膜炎最为多见,占所有葡萄膜炎的50%~60%[1]。我们在前期研究已完成通过霍乱弧菌内毒素(lipopolysaccharide,LPS)足底注射诱导出Wistar大鼠急性前葡萄膜炎[2]。宿主免疫系统对微生物的识别与反应能力很大程度上受I型跨膜受体家族(Toll样受体)调节[3-5]。我们前期的研究发现,虹膜睫状体巨噬细胞上Toll样受体4(toll-like receptor 4,TLR4)表达上调和葡萄膜炎的启动有关[6]。通过对TLR4信号转导通路下游信号分子的研究发现,糖原合成酶3-β(glycogen synthase kinase 3-β,GSK3-β)这一丝氨酸/苏氨酸酶在调节促炎和抗炎因子的产生和维持免疫系统平衡方面起重要作用。动物模型[7]已经证实GSK3-β抑制剂可以抑制炎症并保护宿主对抗炎症的病理过程。这一抗炎效果最早被证实于体内大剂量LPS休克动物模型中[8]。大量研究证实,氯化锂(LiCl)可以直接抑制GSK3-β[9]。Davies等[10]对LiCl的一项研究显示仅GSK3-β被其抑制,而其他24种酶对LiCl不敏感,这项研究进一步证实了LiCl抑制GSK3-β效果的特异性。已有报道显示,LiCl在皮炎[11]、LPS诱导的炎症[12]、Toll样受体介导的慢性肠炎[13]和费朗西斯菌感染[14]中有抑制炎症的作用。然而,LiCl对LPS诱导的葡萄膜炎作用尚不清楚。
中国传统中药红芪多糖 (radix hedysari polysaccharide,HPS)在体内具有重要的生物学活性,具有多种免疫调节作用。其作用机制为通过与巨噬细胞膜上的模式识别受体(pathogen recognition receptor,PRR)结合引起细胞内某些信号通路的活化[15]。红芪中的多糖占红芪总成分的20%~50%,并且为红芪中最有效的成分。HPS可以激活机体B细胞和巨噬细胞并提升细胞增殖能力。近来研究显示,HPS可以抑制小鼠炎症模型中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和 核因子-κB(neuclear factor-κB,NF-κB)等炎症因子的表达[16-18]。我们的前期工作[19]发现,HPS可以通过抑制髓样分化蛋白88(myeloid differentiation protein 88,MyD88)依赖的TLR4信号通路而减轻大鼠的急性前葡萄膜炎。本研究探讨HPS抑制葡萄膜炎作用中GSK3-β的局部表达变化,并探讨HPS在大鼠葡萄膜炎中的作用机制。
1 材料与方法
1.1实验动物6~8周龄SPF 级封闭群雄性Wistar大鼠(北京维通利华实验动物有限公司),体质量180~200 g,实验动物均饲养于12 h光照/12 h黑暗循环环境中。整个实验程序遵循学院实验动物研究指南(实验动物的护理和使用指南)。
1.2主要试剂和仪器LPS(18001 株,古典生物型,小川血清型,兰州生物制品研究所);TLR4抗体、NF-κB p65抗体(美国Santa Cruz 公司);HPS(兰州大学药理学实验室);ELISA试剂盒(北京欣博盛生物技术公司);WB产品(普利莱基因技术有限公司);引物合成(北京天一辉远生物科技有限公司)。LiCl购自美国Sigma公司,兔多克隆抗总GSK3-β(ab97996)抗体,抗P-GSK3-β(phospho S9) (ab131097)抗体,兔多克隆抗NF-κB p65(ab16502)抗体购自美国Abcam plc公司。裂隙灯显微镜购自苏州六六视觉科技有限公司;眼前节照相系统为Topcon 眼前节照相系统;立体解剖显微镜购自德国徕卡公司;酶标仪:美国BD公司流式细胞仪;7500 型荧光定量PCR 仪购自美国应用生物系统公司。
1.3方法
1.3.1实验分组与处理200只大鼠随机分为4组(每组50只大鼠):空白对照组(negative control group,NC)组;LPS诱导的葡萄膜炎组(LPS组);HPS治疗组(LPS+HPS组);LiCl治疗组(LPS+LiCl组)。参照前述报道的方法[2]制作LPS诱导的葡萄膜炎动物模型。将LPS溶于无菌生理盐水中,配成2 g·L-1的注射液。LPS+HPS组腹腔注射400 mg·kg-1HPS,LPS+LiCl组腹腔注射0.5 mol·L-1LiCl 100 μL,对照组和模型组注射等量PBS。2 h后,LPS组、LPS+HPS和LPS+LiCl组每只大鼠足底注射0.1 mL LPS注射液,NC组注射等体积的PBS。每组50只大鼠,每组中10只大鼠用于临床观察和组织学实验。总共80只大鼠用于Western blot和RT-PCR实验,120只大鼠用于房水细胞因子检测。
1.3.2眼前节炎性反应的观察与记录大鼠在LPS注射之后,分别于注射后0 h、6 h、12 h、24 h和48 h裂隙灯下观察双眼,记录包括结膜、角膜、房水、虹膜、瞳孔等的炎性反应并应用眼前节照相系统成像。根据参考文献 [20]的标准对大鼠临床表现进行临床评价与记分。眼部炎症强度从0级至4级,即:无炎性反应为0分;散发的结膜、虹膜炎症为1分;虹膜、结膜血管扩张为2分;虹膜充血伴前房闪辉为3分;除虹膜充血前房闪辉外再加上粘连或纤维素样渗出为4分。
1.3.3虹膜睫状体和房水采集大鼠注射LPS、HPS或LiCl后24 h,过量戊巴比妥钠(100 mg·kg-1)处死大鼠,收集虹膜睫状体组织加入缓冲液并匀浆器均质化,离心去除细胞碎屑。分别于LPS注射后12 h、24 h、48 h用微量注射器抽取双眼房水(每组10只大鼠,20眼,总量为500 μL)。样本于4 ℃ 705 r·min-1离心3 min,上清液放于-80 ℃冰箱中备检。
1.3.4Westernblot检测用PBS清洗虹膜睫状体样本两次,并用NEPER Nuclear液和浆蛋白提取液洗涤。提取液离心微管收集,超声处理10 s,20 800 r·min-1离心15 min。BCA蛋白定量法测定样品蛋白含量。每组各提取60 μg蛋白,聚丙烯酰胺凝胶电泳分离总蛋白,湿法将蛋白质转移到PVDF膜。分别加入GSK3-β和 NF-κB p65抗体,室温反应2 h,洗膜3次,每次5 min。加入辣根过氧化物酶二抗,室温反应2 h。洗膜后用超敏发光液作化学发光,PhosphorImager进行蛋白定量分析。
1.3.5RT-PCR检测Trizol 试剂 (Invitrogen,Carsbad,CA)提取虹膜睫状体总RNA,应用ReverTra Ace qPCR RT Master Mix合成cDNA,按SYBR Green RT-PCR Master Mix试剂盒上二步法进行RT-PCR。RT-PCR引物序列(所有引物通过NCBI Primer BLAST验证)设计如下:GSK3-β上游引物:5’-GACAGAACCTCTTGCTG- 3’,下游引物:5’-GGTGCCCTGTAGTACCG-3’;NF-κB p65上游引物:5’-GGTTACGGGAGATGTGAAGATG-3’,下游引物:5’-AAGGT GGATGATGGCTAAGTGT -3’;β-actin 上游引物:5’-CTGAGAGGGAAATCGTGGGT-3’,下游引物:5’-GG AACCGCTCATTGCCGATA-3’。目标基因的Ct值先经β-actin标准化,组间相对差异化表达为相对增量。所有实验均重复3遍。
1.3.6ELISA细胞因子水平测定ELISA试剂盒检测房水中TNF-α、IL-10、IL-6和IL-1β含量,用酶标仪于450 nm处测定吸光度(absorbance,A)值,并分析细胞因子浓度。
1.3.7组织学检查LPS注射后24 h过量戊巴比妥钠(100 mg·kg-1)处死大鼠,将大鼠眼球放置于体积分数10%中性福尔马林溶液中固定24 h,洗去固定液后组织依次置于体积分数50%、75%、80%、90%和100%乙醇溶液中各脱水1 h,二甲苯处理30 min,浸蜡1 h,共3次;包埋,近视神经盘处切成4 μm切片,苏木素-伊红染色,光学显微镜下观察。
1.4统计学方法所有数据使用GraphPad Prism 5.0 (InStat Program)处理,各组数据采用均数±标准差描述并经过正态分布检验,应用单因素方差分析和Tukey多重比较检验比较分析。P<0.05为差异有统计学意义。
2 结果
2.1动物模型临床表现裂隙灯下观察大鼠眼前节炎性反应。LPS注射24 h后,除NC组外其他三组均出现了不同程度的眼炎性反应:结膜水肿、睫状充血、虹膜血管扩张等,但上述体征在LPS组尤为明显,重于LPS+HPS组和LPS+LiCl组。仅于LPS组可见前房闪辉和纤维素样瞳孔膜,而LPS+HPS组和LPS+LiCl组未见。LPS组可见虹膜后粘连和纤维素样膜(图1A),而LPS+HPS组(图1B)和LPS+LiCl组(图1C)仅偶见瞳孔边缘小量渗出。NC组未见眼前段炎性反应(图1D)。LPS注射后6 h、12 h、24 h、48 h LPS组的炎症评分分别为(2.3±0.2)分、(3.6±0.7)分、(3.9±0.3)分、(3.2±0.4)分,显著高于其他三组(均为P<0.05),而LPS+HPS组、LPS+LiCl组和NC组之间差异均无统计学意义(均为P>0.05)。
2.2组织学改变LPS组大鼠HE染色病理学检查结果与临床表现一致(图 2A),前后房均可见大量炎症细胞浸润和纤维蛋白性渗出,增厚的血管可见于扩张的虹膜基质层,睫状体可见大量炎症细胞渗出。LPS+HPS组和LPS+LiCl组仅见前房少量炎症细胞(图2B、图2C)。NC组未见炎症表现(图2D)。
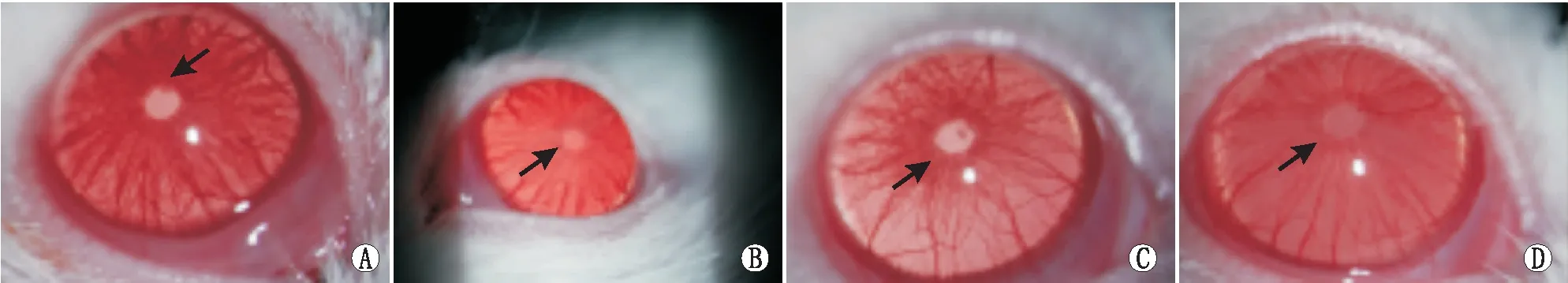
图1 LPS注射后24 h大鼠眼部表现。A:LPS组,箭头所指瞳孔粘连;B:LPS+HPS组,仅见瞳孔边缘少量渗出(如箭头所指);C:LPS+LiCl组,仅见瞳孔边缘少量渗出(如箭头所指);D:对照组,未见明显眼前部炎性反应(如箭头所指)
2.3虹膜睫状体GSK3-β和NF-κBP65的表达四组间虹膜睫状体总GSK3-β蛋白水平差异无统计学意义(P>0.05)。然而,LPS注射24 h后LPS+HPS组和LPS+LiCl组的磷酸化GSK3-β(phospho S9)蛋白水平显著高于LPS组和NC组(均为P<0.01)。而LPS组和NC组之间,或LPS+HPS组和LPS+LiCl组之间的磷酸化GSK3-β蛋白水平差异均无统计学意义(均为P>0.05),见图3。
LPS注射后24 h,LPS组的虹膜睫状体的NF-κB p65蛋白水平均显著高于其他各组(均为P<0.001),而LPS+HPS组、LPS+LiCl组和NC组的NF-κB p65蛋白处于正常水平,差异均无统计学意义(均为P>0.05),见图4。

图2 LPS注射后24 h大鼠眼HE染色。A:LPS组,可见虹膜基质层增厚和大量中性粒细胞浸润;B:LPS+HPS组,炎性反应程度与LPS组比较明显较轻;C:LPS+LiCl组,炎性反应程度与LPS组比较明显较轻;D:对照组,未见明显炎性反应

图3 各组P-GSK3-β蛋白表达水平
2.4各组GSK3-β和NF-κBp65mRNA表达LPS注射后24 h,各组总GSK3-β mRNA表达水平正常,差异无统计学意义(P>0.05)。LPS注射后24 h,LPS组的NF-κB p65 mRNA均显著高于其他三组(均为P<0.01),而LPS+HPS组、LPS+LiCl组和对照组间的NF-κB p65 mRNA表达差异均无统计学意义(均为P>0.05)。
2.5前房房水中细胞因子改变大鼠LPS注射后不同时间点前房房水中细胞因子水平变化如图5所示。LPS注射后,LPS组的TNF-α、IL-6和IL-1β逐渐升高,并在注射后12 h和24 h显著高于其他各组。在LPS组,TNF-α和IL-6浓度峰值出现在注射后24 h(P<0.01、0.001),IL-1β浓度峰值出现在注射后12 h(P<0.001)。LPS+LiCl组、LPS+HPS和NC组的TNF-α、IL-6 和IL-1β表达在任一时间点差异均无统计学意义(均为P>0.05)。LPS+LiCl组和LPS+HPS组,IL-10的表达分别于12 h、24 h和48 h显著高于LPS组和NC组(均为P<0.05)。LPS+LiCl组和LPS+HPS组IL-10的浓度峰值均出现于LPS注射后24 h。LPS+LiCl组和LPS+HPS组之间或是LPS组和NC组之间任一时间点IL-10的表达差异均无统计学意义(均为P>0.05)。见图5。

图4 各组NF-κB p65蛋白表达水平
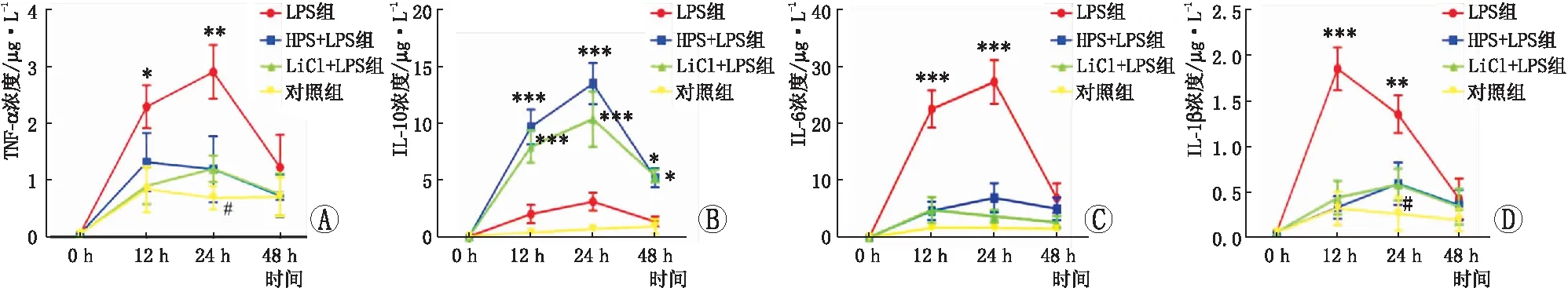
图5 LPS注射后不同时间点大鼠眼前房水细胞因子表达。A:TNF-α;B:IL-10;C:IL-6;D:IL-1β
3 讨论
葡萄膜炎是一种严重威胁视力的眼病,LPS诱导的葡萄膜炎是一个被广泛认可的急性前葡萄膜炎动物模型。经远离眼组织的部位注射革兰阴性菌衍生的LPS可以诱导出眼部急性前葡萄膜炎,而且不会对其他组织造成明显影响[21]。
本实验对LPS+HPS组和LPS+LiCl组在LPS注射前用HPS和LiCl预处理发现,HPS和LiCl均可以减轻大鼠的葡萄膜炎。LPS注射后24 h,作为潜在的抑制性细胞因子,LPS+HPS组和LPS+LiCl组的IL-10显著增高,并且高于LPS组4~6倍。同时,与LPS组相比,LPS注射后24 h,HPS和LiCl预处理出现了60%~80%的IL-6、IL-1β和TNF-α的降低。这些数据与我们实验的临床表现和组织学检查是相符合的。以上结果显示,HPS和LiCl预处理通过对信号通路下游细胞因子水平的调控减轻了LPS诱导的葡萄膜炎炎性反应。
存在于幼稚巨噬细胞中的GSK3经急性刺激后其组成性活化成分通过细胞网络可以提升炎症细胞因子的水平,这一过程部分是通过抑制IL-10的产生和提高NF-κB p65的活性实现的[7]。作为Toll样受体信号转导通路中的一部分,GSK3的功能严格地通过磷酸化实现。GSK3-α(丝氨酸21)或GSK3-β(丝氨酸9)的磷酸化是迄今为止报道的可以影响免疫细胞GSK3活性的唯一机制[22],丝氨酸9的磷酸化导致了GSK3-β的抑制,进而提升了细胞核内环磷腺苷效应元件结合蛋白水平,此核转移的提升竞争性地减弱了NF-κB p65的活性。这一功能性改变最终降低了Toll样受体调节的炎症细胞因子产生,同时出现IL-10的增加[7]。本实验的数据显示,四组的总GSK-3β水平正常,然而大鼠虹膜睫状体磷酸化的GSK-3β表达水平在LPS+HPS组和LPS+LiCl组显著提升,提示HPS和LiCl预处理可以抑制GSK-3β的酶活性,而且LPS注射后24 h,HPS和LiCl预处理的大鼠虹膜睫状体NF-κB p65表达被抑制。这些结果显示HPS和LiCl预处理抑制长时、过度的LPS诱导的大鼠葡萄膜炎的过程可能和GSK-3β的调节机制有关。
GSK3的活性受多种免疫受体,如Toll样受体、细胞因子受体和抗原受体等的调节。大量基于细胞功能中GSK3前炎性功能的研究显示,GSK3具有调节炎症/抗炎细胞因子之间平衡的功能[8,22-24]。GSK3抑制的抗炎效果已在不同炎症动物模型被证实,Zhang等[14]研究证明经活菌(土拉弗朗西斯杆菌)感染的鼠经锂治疗后,可以降低其体内的促炎症细胞因子,并增加了对此细菌感染后的存活率,此研究表明GSK3可以使宿主免受细菌感染的重要性。GSK3抑制剂的抗炎作用在胶原诱导性关节炎、腹膜炎(模型为TLR2诱导型鼠)的效果也很明显,与对照组相比,予以锂治疗的鼠可见明显的的关节水肿减轻及腹腔细胞数量降低[25]。用自发性实验性脑脊髓炎鼠模型来验证锂对炎性反应的影响,发现无论是在症状发生前或发生后予以锂治疗都将降低实验性脑脊髓炎的评分[26]。综上,这些研究均反映了GSK在调节炎性反应中的重要作用,锂作为其抑制物的潜在治疗价值也是值得肯定的。
然而,GSK3-β抑制的抗炎作用似乎不和IL-10的升高直接相关,因为有报道称GSK3-β抑制仍可导致IL-10基因敲除小鼠巨噬细胞的炎症细胞因子抑制[27]。鉴于IL-10在保持免疫系统平衡方面的重要性,我们下一步的工作将致力于研究GSK3-β抑制和IL-10升高这一级联反应在葡萄膜炎中的机制。Chen 等[28]报道结膜下注射LiCl可以使宿主抑制感染铜绿假单胞菌角膜炎的炎性反应,提升炎症细胞凋亡,并且增强细菌清除。我们的实验选择的是更广泛的、非特异性的腹腔注射LiCl,这两种注射方式区别何在?我们相信将来这方面的研究是有一定意义的。
红芪在祖国医学的临床应用中有悠久的历史,其主要化学组成包括多糖、黄酮类、皂苷、香豆酮、有机酸和木酚素等[29]。据国内外研究报道,红芪的主要药物生物活性包括提高免疫、抗炎活性、抗病毒、抗衰老、保肝作用、心血管保护作用和镇痛作用[30-31]。我们前期的研究[19]证实了系统性使用HPS可通过抑制机体对LPS的炎性反应和TLR-4/NF-κb p65通路中促炎因子的产生,从而达到降低大鼠LPS诱导葡萄膜炎的严重程度。本研究发现在抑制LPS诱导的葡萄膜炎过程中,LPS+HPS组和LPS+LiCl的虹膜睫状体GSK3-β的水平都被抑制,尽管这一抑制作用的机制可能是不同的,因为前期我们发现HPS作用位点在TLR-4,而并非像LiCl直接作用于GSK3-β。尽管我们认为通过TLR4调节的PI3K途径,HPS和LiCl可以调控LPS诱导的葡萄膜炎细胞因子的表达,但它们是否于其他信号通路中,如非MyD88依赖途径,还不得而知,未来这些方面的研究还将充满着挑战性。另外,我们以前的研究发现LPS注射后葡萄膜炎发生、发展的速度很快(LPS注射后2 h出现炎性反应,24 h达到高峰),因此我们选择了HPS、LiCl预处理大鼠而不是注射LPS后再给药。然而,也许单独应用HPS或LiCl可能会引发轻微的炎性反应,因为我们以前的研究曾指出其他药物注射也可以引起轻微的眼前节炎性反应[2,6],而本实验中仅有空白对照组,尚缺乏HPS和LiCl的对照组,这是不足之处。
综上所述,本研究发现HPS和LiCl预处理减轻LPS诱导的大鼠葡萄膜炎的作用可能和GSK3-β的抑制性磷酸化有关。GSK3-β在TLR4介导的炎性反应信号转导通路中起重要作用。未来在葡萄膜炎的治疗研究中,对GSK3-β的进一步深入研究意义重大。
