精准针刺激痛点联合拉伸对大鼠前扣带皮层CREB表达及其磷酸化的影响*
2019-02-22李丽辉黄强民阮氏深徐安乐嵇丽娟
李丽辉 黄强民△ 刘 琳 阮氏深 徐安乐 嵇丽娟
(上海体育学院运动科学学院,上海 200438;2南京体育学院运动健康学系,南京 210014)
肌筋膜激痛点(myofascial trigger points, MTrPs)是骨骼肌内结节处大量高度异常的敏感小点,并在此处可触摸到一条紧绷的肌带[1]。当创伤、疲劳、免疫力降低、营养物质缺乏、人体姿势长期失衡等因素刺激隐性激痛点时可以转化为活化激痛点,导致激痛点区域的大面积疼痛,并传导至远处引发牵涉性疼痛和自主神经高度过敏,继而造成病人骨骼肌疼痛、关节功能受限、感觉异常、自主神经功能紊乱,甚至肢体残疾等。临床上常应用针刺对肌筋膜激痛点进行灭活,已有大量的文献从疼痛程度视觉模拟评分法 (visual analogue scale, VAS)评分、关节活动度、疼痛阈值、焦虑抑郁指数甚至生活质量等方面证实了针刺肌筋膜激痛点的疗效[2,3]。静态拉伸作为一种简单易操作且经济实用的疗法,临床医师通常在针刺治疗后将其配合应用,并教会病人以便养成自我拉伸的习惯,对于缓解疼痛可取得事半功倍的疗效[4,5]。同时,有研究发现针刺后配合拉伸能够有效缓解因针刺引起的肌肉酸痛[6]。
但针刺激痛点的治疗机理目前仍主要集中对肌电生理及组织形态方面改变的研究,鲜有从分子生物层面进行解释。拉伸的机制虽然已经被广泛研究,但对于激痛点是如何发挥作用的尚不得而知。肌筋膜激痛点的形成和发生过程非常复杂,涉及多层面的因素,学者们从整体能量危机假说、力学失衡假说、中枢敏化学说及肌梭放电学说等不同方面进行假设[7]。其中中枢敏化假说认为,当肌筋膜激痛点持续得不到灭活,局部缺血缺氧大量的刺激物堆积,激活神经元附近的伤害感受器如瞬时受体电位离子通道和酸敏感离子通道,造成脊髓后角神经元池致敏,神经信号被反复放大加之神经元对阈值刺激的反应增强,从而引发中枢敏化,随之反馈到骨骼肌导致张力改变或力学失衡,形成环路加重激痛点的发展[8]。
环磷腺苷反应元件结合蛋白(cAMP response element binding protein, CREB)是一种转录因子,已被证实与疼痛、认知及记忆等的发生密切相关[9~12]。而激痛点的中枢敏化学说引发思考,或与大脑内高表达的CREB有关,因此我们假设精准针刺激痛点结合静态拉伸可通过改善CREB及其磷酸化蛋白和mRNA水平的表达,从而起到缓解疼痛的作用。本研究以大鼠大脑前扣带回处CREB蛋白为研究指标,进一步丰富激痛点的中枢敏化学说,为今后深入研究揭示激痛点的发生及针刺和拉伸治疗机制奠定初步基础。
方 法
1.材料
实验动物与分组:将60只平均体重220~250 g的6周龄SPF级雄性SD大鼠随机分为正常对照组(C)、模型组(M)、针刺激痛点组(D)、针刺非激痛点组(ND)、拉伸组(S)和针刺拉伸结合组(SD),每组各10只,每笼5只分笼饲养于上海体育学院动物实验中心(许可证号:SYXK(沪)2014-0002),由上海杰思捷实验动物有限公司提供。饲养条件:温度20℃~25℃,相对湿度40%~70%。每日保持12 h的固定明暗周期,适应性饲养1周后进入实验。动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定,实验操作符合动物伦理学要求并通过了上海体育学院科学研究伦理委员会审批《[上体]伦审字(2017017)号》。
试剂和药品:CREB和p-CREB抗体(美国ABCAM);Trizol试剂、随机引物、RNA酶抑制剂、逆转录试剂盒均由美国Invitrogen公司提供;BCA蛋白浓度测定试剂盒(美国Thermal Scientif ic);缓冲液由上海威奥生物科技有限公司;RNA-free Water由德国QIAGEN公司提供。
实验所用主要仪器:Tissue Ruptor匀浆器(北京鼎昊源);台式高速离心机和MutiscanGo全波长酶标仪(Thermo公司);电泳仪和电泳槽(美国BIO RAD);凝胶成像系统GIS-1600(上海天能科技有限公司);热循环仪(美国LIFE);定量PCR仪(Roche罗氏)。
2.研究方法
(1)MTrPs模型的建立与验证
选取M组、D组、ND组、S组和SD组大鼠作为MTrPs建模对象,每周第1天均进行打击处理:将大鼠腹腔麻醉仰卧位固定于自制打击模型上,以重量为1 200 g的打击器从20 cm高度处自由落下,垂直打击标记部位,打击器与腓肠肌接触面积约为1 cm×1 cm,动能为2.352 J打击其左后肢的腓肠肌中端偏上约0.5~1 cm位置1次,使其该部位造成钝挫伤。第2天进行跑台离心运动干预:在倾斜角为-16°的电动动物跑台上使大鼠保持持续性下坡跑训练,速度逐渐增至16 m/s,每次训练90 min,运动中可使用声音、木棒或电刺激驱赶以保证良好的运动效果。剩余5天均正常喂养,重复此干预8周。之后进入为期4周的恢复期,整体干预周期共计12周[13]。
动物模型成功建立的标准(采用国际公认的MTrPs存在特征)[14]:首先将大鼠左后肢毛发剃除,触诊到造模部位有挛缩结节,将第一支电极针刺入结节处产生肌肉跳动,另一电极针刺入第一支针旁3~5 mm作为参考电极,连接到肌电装置(Z2JNB-NCC08, NCC Medical Co, Ltd, 上海)观察肌电活动1 min,如有高频自发性电位出现则证明造模成功,并记录波幅、波频和波长。
(2)针刺及拉伸干预治疗
空白组(C):不做任何处理,与其他五组同时间点取材。
模型组(M):造模时与其他四组造模组同步抓取与固定,但不做针刺和拉伸处理,同时间点取材。
针刺激痛点组(D):造模成功后,左后肢常规酒精消毒后,取一次性规格为Ф0.3×25的针灸针刺入腓肠肌的4处激痛点(见图1),分层次提插,内外上下四个方向寻找并灭活相应的疼痛激痛点,准确后该肌肉可产生抽搐颤动(“跳动”),针刺强度中等,以“跳动”6次后出针结束治疗[15]。
针刺非激痛点组(ND):常规处理如D组,将针灸针刺入腓肠肌的4处激痛点旁开1~2 cm处,进针后不产生“跳动”,针刺强度中等,分层次提插6次后出针结束治疗。
拉伸组(S):将大鼠仰卧,缓慢将其左后肢的髋关节伸直180°、膝关节伸直180°、踝关节背伸90°,主要牵拉腓肠肌。每次牵张1 min,休息1 min,重复牵张3次,由固定人员操作。
针刺联合拉伸组(SD):针刺后随即配合拉伸(针刺方法同D组,拉伸方法同S组)。
干预周期均为每周治疗1次,共持续4周。
(3)取材及样品处理
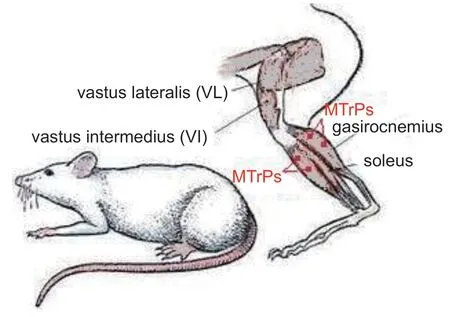
图1 针刺腓肠肌4处激痛点部位(红色点状标示)Fig.1 Four locations of MTrPs of dry needling
将大鼠深度麻醉(腹膜内注射戊巴比妥钠60 mg/kg),待大鼠完全麻醉后取其仰卧位,四肢固定。从内踝向大腿方向剥离肌肉,钝性分离腓肠肌再次检测是否有挛缩结节出现,结节处是否有局部抽搐反应和高频率自发电位等建模成功指标。无菌操作下剥离脑组织取大鼠前扣带回部分,用预冷的PBS洗涤去除残留血液和污染物,冲洗干净。立即置于液氮中速冻,-80℃冰箱保存用于蛋白提取。
(4)Western-Blot检测组织中CREB、P-CREB的含量
将组织剪切成细小的碎片,融解RIPA裂解液,混匀。12 000 rpm离心5分钟,取部分上清蛋白用BCA蛋白浓度测定试剂盒测定蛋白浓度,37℃孵育30 min,562 nm处测吸光度,记录OD值;根据OD值及蛋白标准品浓度绘制标准曲线,计算样品总蛋白浓度。每孔加上样液30 μg,留一孔加10 μl预染的Marker。按黑面(负极)→海绵→滤纸→胶→PVDF膜→滤纸→海绵→红面(正极)的顺序制备转膜,每层铺好后先赶走气泡再铺另一层。孵育袋中加入封闭液稀释的CREB (abcam 1:1 000)、p-CREB (abcam 1:2 000)和GAPDH (weiao 1:2 000),4℃孵育过夜。TBST洗膜5 min×3次,辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jackson 1:2 000)、辣根过氧化物酶(HRP)标记的羊抗小鼠二抗(Jackson 1:2 000)室温孵育2 h。TBST洗膜15 min×5次。膜于化学发光检测试剂(试剂A:试剂B = 1:1)反应2 min,取出膜,甩去多余的液体,用保鲜膜包好PVDF膜,暗室中用X胶片感光、显影、定影。
(5)RT-PCR检测组织中CREB、P-CREB的含量
组织处理同Western-Blot分析。取1 μl总RNA测OD260,并定量。反转录反应合成 cDNA,荧光定量PCR扩增:序列参照Gene Bank数据库中各目的基因的序列,引物由NCBI Primer-blast设计,选用GAPDH作为内参。CREB上游引物序列为5'-ACC AGC AGA GTG GAG ATG CT-3',下游引物序列为5' -GGG CTA ATG TGG CAA TCT GT-3';pCREB上游引物序列为5' - TGC CAC TCA GAA GAC TGT GG -3',下游引物序列为5' - TTC AGC TCT GGG ATG ACC TT -3'。所有引物均由苏州金唯智生物技术有限公司合成及纯化。在PCR反应体系(10 μl)中加入2×SYBGEEN PCR mix、PCR Reverse Primer (10 pM/ul) DNA模板及灭菌蒸馏水。每个基因做三个复孔,设置好扩增程序,放入扩增仪进行扩增。所有的数值先与内参做了△CT,然后用第一个样品做了相对含量2-△△CT分析。
3.统计学处理
采用 SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差(±SD)表示,分别用 Oneway ANOVA 和 Student' st-test 方法分析定量 PCR和Western Blot 结果。P< 0.05 为差异具有统计学意义。荧光实时定量 PCR 采用 2-△△CT 方法分析。
结 果
1.精准针刺可显著降低MTrPs大鼠自发性肌电活动
各组间的波频、波幅和波长变化趋势一致;与C组相比,M组的波频、波幅和波长均显著性增高(P< 0.01);与M组相比,仅D组的波频、波幅和波长显著下降(P< 0.01),其他治疗组别无显著性变化(见图2)。
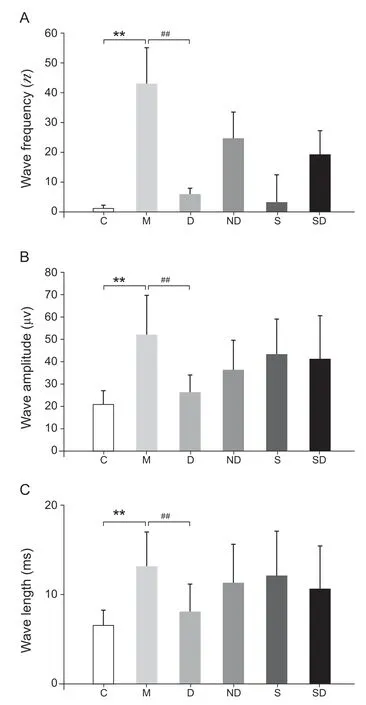
图2 干预后各组间的波频(A)、波幅(B)和波长(C)变化(±SD)**P < 0.01,与C组相比;##P < 0.01,与M组相比Fig.2 Changes of Wave frequency (A), Wave amplitude (B),and Wave length (C) after intervention (±SD)**P < 0.01, compared with group C; ##P < 0.01, compared with group M.
2.精准针刺联合或不联合拉伸均可下调MTrPs大鼠前扣带回处CREB及其磷酸化蛋白的表达
与C组相比,M组、S组和ND组的CREB和p-CREB 蛋白相对表达水平明显增高(P< 0.01)。相比M组,D组,S组及SD组(P< 0.05)的CREB蛋白相对表达量显著降低;相比M组,D组,ND组,S组及SD组(P< 0.05)的p-CREB相对表达量也显著降低;相比D组,ND组与S组的CREB和 p-CREB蛋白相对表达水平显著增高(P< 0.05),而SD组的CREB水平则显著低于D组(P< 0.05,见图3)。

图3 干预后各组大鼠前扣带回处CREB及p-CREB蛋白相对表达量的变化(±SD)**P < 0.01,与C组相比;#P < 0.05,##P < 0.01,与M组相比;&P < 0.05,&&P < 0.01,与D组相比Fig.3 Changes of CREB and p-CREB expression in anterior cingulate cortex in all groups (±SD)**P < 0.01, compared with group C; #P < 0.05, ##P <0.01, compared with group M; &P < 0.05, &&P < 0.01,compared with group D.
3.精准针刺可下调MTrPs大鼠前扣带回处CREB基因的表达
CREB的熔解曲线(见图4A)和扩增曲线(图4B)结果表明PCR扩增过程中无非特异性扩增。与C组相比,M组、S组和ND组的CREB的mRNA表达水平明显增高(P< 0.01);相比M组,仅D组的CREB的mRNA表达显著降低(P< 0.01,见图4C)。

图4 干预后各组大鼠前扣带回处CREB 实时定量PCR结果(±SD)A:熔解曲线;B:扩增曲线;C:各组CREB mRNA相对表达量变化**P < 0.01,与C组相比;##P < 0.01,与M组相比Fig.4 Results of real-time quantitative PCR of CREB (±SD)A: Melting Curve; B: Amplif ication Curve; C: Changes of CREB mRNA expression in anterior cingulate cortex in all groups.**P < 0.01, compared with group C; ##P < 0.01, compared with group M.
讨 论
黄强民等的研究已证实了自发性肌电活动是动物造模成功的标准[16],本研究经针刺治疗后观察激痛点处肌电活动,发现波幅、波频和波长均有显著改善,单从该指标分析可得出精准针刺能有效灭活活化的激痛点。肌电图研究已经报道,静息状态时可在MTrPs处检测到自发性电位(spontaneous electrical activity, SEA)。目前研究多数认为SEA是由于乙酰胆碱(acetylcholine, ACh)过度释放所造成,可能导致终板区的局部收缩形成收缩结节或紧张带,因而推测这可能是MTrPs形成的最初原因[17]。且有研究发现激痛点处均出现自发性放电,且频率、波幅和波长相比非激痛点处显著增加,电位以纤颤电位和正锐波为主,还出现束颤电位。
临床上已有大量的研究证实了针刺激痛点可有效缓解疼痛[2,3,18],但有关激痛点相关蛋白的研究非常之少,尚不能清楚地解释目的蛋白或基因与肌筋膜激痛点发病及针刺治疗的机理。Hsieh等[19]采用ELISA 和Western Blot检测了针刺治疗MTrPs模型兔后血清、脊髓背根神经节及大脑中的β-内啡肽和脑啡肽表达量,发现内源性阿片类系统与针刺激痛点的疗效有关,但该研究未设置正常对照和模型对照组,且实验技术上有明显缺陷。来自巴西的一项随机对照试验纳入24例肌筋膜疼痛综合征的女性病人,分为重复经颅磁刺激组和假干预组,治疗结束检测血清脑源性神经营养因子(Brain Derived Neuro trophic Factor, BDNF)的表达量,发现该方法治疗肌筋膜疼痛可能通过增加BDNF的表达发挥作用[20]。Liu等研究了针刺激痛点和非激痛点后ACh、AChR和AChE的表达变化,发现针刺激痛点相比非激痛点ACh和AChR的表达显著下降,AChE的表达显著性升高,证明精准的激痛点针刺治疗效果更佳[14]。
针刺作为肌筋膜疼痛激痛点的治疗方式之一,可对激痛点进行直接灭活,通常在针刺治疗之后配合静态拉伸,在临床实践中广泛被应用。大量研究已从肌肉表现力、关节活动范围、甚至神经反应等方面证实了骨骼肌拉伸的有益效果[2~5,21,22]。近期来自奥地利格拉茨大学运动科学学院、格拉茨医学院生理系和维也纳医科大学等院系合作研究发现,1分钟的静态拉伸抑制了腱反射,促进了H反射,降低了肌梭敏感性,因而可在一定程度上缓解肌肉酸痛[21]。同时,刘琳等最新研究发现,通过Rampand-hold牵拉诱导得出的H反射通路与慢性MTrPs形成的病理生理机制有关,MTrPs大鼠脊髓中枢可能存在高度致敏,Iα类传入神经兴奋性较高,肌梭敏感性可能也较高[23]。因而本实验将针刺与静态拉伸结合用于治疗MTrPs大鼠,进一步探讨了其治疗机制。
CREB的调节与多条通路相关[24],包括 AC (adenylate cyclase,腺苷酸环化酶)、cAMP、Ca2+、MAPK(mitogen-activated protein kinases,促分裂素原活化蛋白激酶),CREB 作为疼痛信号通路上极其重要的靶点,其作用不容小觑,但CREB的激活不需要其他蛋白的合成,只需自身活化磷酸化即可发挥作用,即pCREB (phosphorylated cAMP response element binding protein,磷酸化cAMP反应元件结合蛋白)。目前已知多种类型疼痛的形成和维持与CREB磷酸化有关,其介导的靶基因有100多种,在参与外周疼痛和中枢敏感化等发挥重要作用[11,12]。有假说认为肌筋膜激痛点的形成导致后角神经元兴奋性增高而出现中枢敏化[8],但假说并未有研究进行验证。本试验经激痛点造模后CREB及其磷酸化蛋白及mRNA水平显著增高,说明外周激痛点模型的形成可能与中枢敏化极度相关。经针刺精准激痛点治疗,CREB及其磷酸化蛋白表达水平显著改善;针刺非激痛点及单独的静态拉伸治疗虽可降低CREB的磷酸化蛋白表达水平,但均不如精准激痛点治疗效果显著。且研究表明,精准针刺联合或不联合拉伸均可下调MTrPs大鼠前扣带回处CREB及其磷酸化蛋白的表达。因而我们推测,单纯拉伸对于灭活激痛点可能达不到治疗“剂量”,拉伸仅可作为一种辅助疗法,只有配合精准针刺MTrPs后方能起到有益效果。
总之,CREB参与针刺MTrPs的调控,或许为激痛点的发生及干刺灭活MTrPs的机理提供一种新的思路,同时为下一步药物靶点的开发奠定基础。本研究的局限之处在于未做免疫组化染色方面的定性观察及外周脊髓CREB的表达测定。此外,CREB与行为、记忆等关系密切,是否与疼痛信号通路上存在共同的调节靶点仍不得而知,与其它可能的通路具体如何相互作用还有待进一步的研究。今后应将阻断或抑制CREB蛋白对MTrPs的作用或与相关通路结合研究,进一步去验证CREB蛋白是否为MTrPs发病的特异性表达因子。
