软组织痛:“针热”靶控疗法及其机制*
2019-02-22邵曙青尤浩军
雷 静 叶 刚 邵曙青 尤浩军
(1延安大学感觉与运动疾病转化医学研究中心,延安 716000;2上海同济大学附属同济医院康复科,上海 200065;3上海曙新科技开发有限公司,上海 200051)
罹患软组织疼痛的病人既可表现出感觉方面的痛觉异常现象,也因为病变区域多位于肌肉运动区域,妨碍病人的运动功能,对人们的正常工作和生活产生不可忽视的影响。病程长及严重者更给家庭和社会带来沉重的经济负担,并对病人造成极大的身心困扰。近年来,由于电子产品的普及和现代生活方式的改变,长期使用电子设备、久坐及不良的姿势,均使软组织疼痛的发病率呈现逐年攀升,且出现病人群低龄化趋势[1]。目前,软组织疼痛,尤其是慢性软组织疼痛,的诊断和治疗一直是疼痛及康复领域内的临床工作者所面临和亟需解决的一大难题。
国内外学术界一致认为,慢性软组织疼痛是由急性软组织损伤未愈,或长期慢性病变后所产生的化学物质持久刺激引起,其主要病理改变为软组织的无菌性炎症,诱发感觉不适及疼痛[2,3]。随着病程的进展,继而出现肌肉痉挛,肌筋膜瘢痕及组织粘连等严重病变。临床上,软组织病变和损伤不仅能引起疼痛和各种肢体功能障碍,还能引起多种涉及内科、外科、妇科等疾病的系列并发症,进一步增加临床诊断和治疗难度。基于慢性软组织疼痛发生、发展的病理生理特点,临床多采用不同的治疗方法以达到消除炎症和局部软组织松解的目的。这些治疗方案,各有优缺点。例如,传统中药外敷,虽然不良反应相对较小,但起效较慢[4];现代药物治疗包括口服抗炎药或镇痛药,局部组织注射等,起效快,但药物不良反应常使病情反复,并出现药物的成瘾和耐受等现象[5];此外,推拿及按摩疗法也可缓解软组织痛,但疗效并不确切;而采用灸(热)、磁、电等物理刺激的疗法,应用较为广泛,对组织损伤小,但上述刺激手段通常不易达到深部病灶软组织[6,7];微创中的针刀松解术,起效较快,但对局部组织损伤大,远期更容易由于针刀的锐性切割形成组织内瘢痕,并造成不同程度的肢体功能障碍[8]。
自20世纪60年代以来,宣蛰人使用密集型银质针疗法,“以针代刀” 既达到了使病变软组织钝性分离和松解目的,又辅以针尾艾条燃烧的热疗,对严重颈肩腰腿痛病人的治疗取得了满意疗效[9]。此后,依据“针”与“热”相结合理念,通过对银质针针尾套以电子加热器件进行加热(简称银质针导热),并通过反馈调节针体温度,实现了针体温度的稳定和可控。临床治疗证实,上述银质针导热疗法对由多种原因,如腰椎间盘突出症、椎管狭窄、股骨头坏死、髌下脂肪垫损伤等,引起的软组织疼痛均能取得良好疗效[10]。近年来,通过针体内加热治疗手段(简称‘内加热’),进一步达到了软组织痛靶向调控治疗目的。该针体内加热方案,通过针管内置加热芯,热电偶测温反馈,并经微电脑控制,达到实时、快速调节针芯温度,并使针身温度稳定维持(见图1)。
从治疗手段而言, “针热”靶控疗法通过聚焦外周软组织病变区域,辅以“不引起明显痛感”的温热治疗,及靶向影响中枢特异核团功能状态,达到软组织痛的精准治疗。在治疗效果上,“针热”靶控疗法兼备针刺和热刺激两类不同的治疗效应。
一、‘针热’靶控疗法的针刺及空间总和效应
祖国医学认为气血运行不畅是引起疼痛的主要病机。《素问·举痛论》中所述:“气不通,故卒然而痛”;而《灵枢》所述的“用针之类,在于调气”,调气即是“通其经脉,调其气血”,说明通过发挥针刺“调气”的作用可以达到“通则不痛”之目的。软组织痛‘针热’疗法中所采用的针是由传统的九针之一的长针演变过来,针体较普通针灸针更长,更粗。《灵枢·九针十二原》载:“长针者,取法于綦针,长七寸,其针身薄而锋其末,令可以取深邪远痹”。而《灵枢·终始》又载:“痛而手按之不得者,阴也,深刺之”。因此,针刺在用于治疗肌肉软组织痛时能够对深部的病变软组织施治,通过深刺直达病灶,从而激发经气,发挥通经镇痛的作用。
临床治疗中,无论是针对‘阿是穴’,或是针对病变组织中的肌筋膜激痛点,上述针刺疗法均采用的是靶点治疗理念:通过松解病变肌肉所致的痉挛,达到局部组织的减压及减张,以增加局部供血,消除无菌性炎症,并促进组织修复和肌细胞再生的目的。而银质针治疗方案更是针对外周病变组织采用多靶点和多靶区的多针联合治疗方案,通过神经系统的空间总和效应以达到治疗效果最佳化之目的[9]。
二、‘针热’靶控疗法的热刺激靶效应
通过在针尾加燃烧的艾条治疗慢性软组织痛,有着悠久的历史。早在《黄帝内经》中即有记载“藏寒生满病,其治宜灸”;表明热刺激疗法的适应证的广泛性及疗效确切性。
1.针体温度和组织内温度场
李娇[11]对‘内加热’的‘针热’治疗的活体和模拟组织内的温度变化做了观察。结果显示,内加热的针体温度分布的特点是中间高两边低,因此热量会比较集中在针体中间偏向针尖的位置,且更多向针体水平方向延伸。经测量,在距离针尖15~30 mm之间存在针体最高温。因此,进行临床治疗时需要有一定的插入深度,否则会影响到加热效率。
于活体动物组织及等效肌肉体模型上,通过模拟计算,其内加热针刺激的温度分布特点大致相同。即,刺入点为针体加热范围内生物组织的温度最高处;内加热治疗中,活体动物组织内可感知到温度升高的范围半径小于20 mm;而在大于该范围后升温不明显,且温度变化无规律,存在较为明显的温度变化延迟现象。同时,内加热针治疗时组织中水平方向传递热量显著高于垂直方向。因此,临床使用时需要针尖到达病灶部位,使病灶局部组织得到更好的热疗效果;同时,病变组织靶区内的多针联合加热法,冀以覆盖更大的病变组织,通过空间总和效应达到治疗效果最大化[11]。
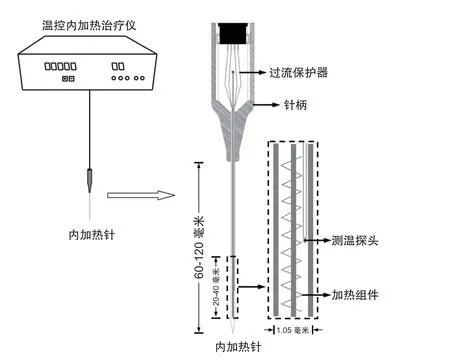
图1 温控内加热治疗仪及内加热针针体构造
2.针体温度对外周局部组织的影响
动物实验研究显示,大鼠骨骼肌机械挫伤后,43oC内加热针肌肉内的热刺激能显著降低大鼠骨骼肌慢性损伤组织中的丙二醛(malonaldehyde, MDA)含量,提高超氧化物歧化酶(superoxide Dismutase,SOD)活性,促进受损软组织恢复[12]。同时,43℃热针肌肉刺激可以明显提高损伤组织的脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)表达,增强代谢和促进细胞存活。形态学结果显示,内热针刺激可以减轻组织变性坏死的程度,减轻炎症反应,加速损伤组织的修复[13]。此外,43℃热针肌肉内刺激可以促进损伤组织内的血管内皮细胞增殖,毛细血管新生,改善组织缺氧状况,促进受损组织修复并减少瘢痕组织形成[14]。较大型的动物实验(如家兔骨骼肌机械挫伤实验)结果显示,内加热针刺激组织后可显著增加肌筋膜血流速度,并降低受损组织肌肉张力[15]。有研究进一步发现,在大鼠关节腔内注射尿酸盐溶液诱导的痛风性关节炎模型中,43℃内加热针肌肉内热刺激可以显著降低关节腔液白细胞介素-1 (interleukin-1, IL-1)及前列腺素E2 (prostaglandin E2, PGE2)的表达,并显著消除关节肿胀[16]。而在完全弗氏佐剂(complete Freund' s adjuvant, CFA)诱发的大鼠肌肉痛模型中,43℃热针肌肉内刺激可以显著降低受累肌肉组织内的白细胞介素-1 (IL-1)及肿瘤坏死因-α (tumor necrosis factor-α, TNF-α)表达,并显著减轻肌肉组织肿胀[17]。然而,46℃热针肌肉内刺激对以上关节和肌肉肿胀却无减轻作用。上述研究结果提示,“不引起明显痛感”的温热(如43℃),而不是痛性热(如46℃),刺激可能是临床内加热针治疗软组织痛的理想加热温度。
通过比较大鼠骨骼肌的形态、蛋白表达情况等,有研究分析了内加热针和银质针导热治疗仪对动物组织的影响。结果显示,内加热治疗在温度控制方面优于银质针导热治疗[18]。此外,通过观察组织烫伤安全性检测指标和光镜及电镜下组织形态学变化,临床研究证实45℃以下的内加热针刺激对组织是安全的[19]。
3.热针刺激对痛觉内源性调控作用影响及时间/空间效应
目前已广泛接受痛觉内源性调控作用分别由痛易化和痛抑制这两个独立的通路完成[20],并由丘脑背内侧核(mediodorsal, MD)和腹内侧核(ventromedial, VM)作为丘脑‘伤害性反应辨别器’分辨外周Aδ和C-纤维介导的不同类型传入信息;进一步通过不同的中枢环路分别对伤害性机械性刺激诱发的反应产生易化作用,而对热刺激诱发的反应起抑制性调节作用[21]。然而,43℃和46℃热刺激对痛觉内源性调控作用却产生不同的影响[22]。
(1)非痛性43℃热刺激对痛觉内源性下行调控的影响:研究显示15~45分钟43℃热针单针/双针肌肉刺激后不引起下行易化作用;而30~45分钟43℃热针单针/双针肌肉刺激后,引起下行抑制作用,表现为热痛反应降低现象,且双针热刺激诱发的下行抑制作用较单针刺激强。进一步的实验结果显示丘脑VM核团参与43℃热针刺激引起的下行抑制作用,该核团内阿片δ受体,而非阿片μ, κ受体参与该作用[23]。而有研究证实脊髓内阿片μ受体和δ受体参与43℃热针刺激引起的下行抑制作用[16]。此外,丘脑VM核团内5-HT1A受体及α2-肾上腺素能受体也参与43℃热针刺激引起的下行抑制作用[17]。人体痛觉实验进一步显示,43℃热针‘足三里’穴位内刺激可以显著减轻由高渗盐斜方肌内注射所诱发的肌肉痛,并进一步证实了该镇痛作用是通过激活痛觉下行抑制系统完成[24]。
(2)痛性46℃热刺激对痛觉内源性下行调控的影响:15~45分钟46℃热针单针/双针肌肉刺激后,诱发痛觉易化作用,表现出机械性痛敏现象;30~45分钟46℃热针单针肌肉刺激以及15~45分钟46℃热针双针肌肉刺激均可诱发下行抑制作用,出现双侧热痛反应降低现象。研究还显示丘脑VM核团中μ, δ, κ阿片受体参与“痛性”热刺激(46℃)所诱发的下行抑制作用。同时,丘脑MD核团中μ阿片受体亦参与“痛性”热刺激(46℃)所诱发的下行易化作用[23]。
由于热敏感纤维多为无髓鞘C-纤维[25],动物和人体实验研究结果显示,非痛性43℃热针刺激可以在不影响激活阈值较低的痛觉下行易化系统的前提下,直接激活阈值较高的痛觉下行抑制系统。这为降低病人的紧张和焦虑情绪,达到良好的治痛疗效提供了直接的实验证据。此外,热针刺激具有时间总和的特点和天花板效应,长于30分钟的热针刺激并没有为临床治疗带来更强的痛抑制作用;而短于15分钟的热刺激通常也不易激活痛觉下行抑制作用[24]。43℃和46℃的双针热刺激可以引起更强,且持续时间更长的镇痛作用,更显示了其具有空间总和的特点[23]。
三、小结
软组织‘针热’靶控疗法采用针刺联合加热手段对软组织痛给予靶向调控治疗。系列的基础及临床研究证实,‘针热’靶控疗法通过精准松解外周病变软组织区域,并对中枢神经系统功能状态(尤其是相关的丘脑靶核团功能状态)产生特异影响。该疗法既可通过针刺降低外周病变软组织区域的高张及痉挛状态,改善血供,以达到促进损伤的组织康复;又可通过热刺激靶向激活痛觉内源性下行抑制作用达到增强抗痛效果。而‘不引起明显痛感’(如42~43℃)的温热刺激治痛理念的提出更在避免激惹痛觉下行易化作用引起的中枢敏化现象的前提下,为临床有效治疗病理性软组织痛提供了可行性。基于中枢空间/时间总和效应的靶控治疗软组织痛理念,在临床实际运用中多建议采用多针、多靶点及多靶区针刺松解局部软组织,并联合不短于30分钟‘不引起明显痛感’(42~43℃)温热刺激的治疗方案。对于“针热”靶控疗法中是否存在中枢多脑区参与,以及不同脑区内神经元形态,神经元内细胞器超微结构是否也随“针热”刺激,尤其是‘不引起明显痛感’温热刺激,而发生功能和/或结构的可塑性变化,尚需给予进一步的研究。
