miR-29c对TNF-α诱导的人脐静脉内皮细胞增殖与凋亡的影响及其机制的初步研究
2019-02-21陈武哲冷超群何彬彬
陈武哲 冷超群 何彬彬

[摘要] 目的 研究miR-29c对TNF-α诱导的人脐静脉内皮细胞(HUVECs)增殖与凋亡的影响及其作用机制。 方法 空白对照组、miR-29c过表达阴性对照组、miR-29c过表达组、miR-29c抑制表达阴性对照组、miR-29c抑制表达组预先转染HUVECs,再用TNF-α(10 ng/mL)诱导HUVECs 48 h,然后分别采用MTT法和Hoechst 33342荧光染色法检测miR-29c对TNF-α诱导HUVECs增殖活力及凋亡的影响;再采用Western blot技术检测miR-29c对Akt、eNOS磷酸化水平及eNOS蛋白表达的影响。 结果 miR-29c可显著降低TNF-α诱导的HUVECs的增殖活力(P<0.05);Heochst 33342荧光染色结果显示,miR-29c可促进TNF-α诱导的HUVECs凋亡(P<0.05);miR-29c可显著下调Akt、eNOS的磷酸化(P<0.05),但其对eNOS蛋白的表达无影响。 结论 miR-29c可降低TNF-α诱导的HUVECs增殖,并促进其凋亡,其机制可能与下调Akt、eNOS的磷酸化相关。
[关键词] miR-29c;人脐静脉内皮细胞;TNF-α;增殖;凋亡
[中图分类号] R363 [文献标识码] A [文章编号] 1673-9701(2019)35-0035-06
Effect of miR-29c on TNF-α induced proliferation and apoptosis of human umbilical vein endothelial cells and its mechanism
CHEN Wuzhe LENG Chaoqun HE Binbin
Department of Basic Medicine, Yongzhou Vocational and Technical College, Yongzhou 425000, China
[Abstract] Objective To study the effect of miR-29c on the TNF-α induced proliferation and apoptosis of human umbilical vein endothelial cells (HUVECs) and its mechanism. Methods HUVECs were pre-transfected with blank control group, miR-29c mimics negative control group, miR-29c mimics group, anti-miR-29c negative control group and anti-miR-29c group, and then HUVECs were induced with TNF-α (10 ng/mL) for 48 hours, after which MTT assay and Hoechst 33342 fluorescence staining were used to detect the effect of miR-29c on the TNF-α induced proliferation and apoptosis of HUVECs. Then Western blot was used to detect the effect of miR-29c on Akt and eNOS phosphorylation and eNOS protein expression. Results The TNF-α induced proliferation of HUVECs was significantly decreased by MiR-29c (P<0.05). It was found by Heochst 33342 fluorescence staining that the TNF-α induced apoptosis of HUVECs was promoted by miR-29c (P<0.05); The phosphorylation of Akt and eNOS was significantly down-regulated by miR-29c (P<0.05), but the expression of eNOS protein was not affected by miR-29c. Conclusion MiR-29c can reduce the TNF-α induced proliferation of HUVECs and promote their apoptosis. The mechanism may be related to the down-regulation of Akt and eNOS phosphorylation.
[Key words] MiR-29c; Human umbilical vein endothelial cells; TNF-α; Proliferation; Apoptosis
動脉粥样硬化(Atherosclerosis,AS)是一种慢性进行性疾病,血管内皮细胞损伤在动脉粥样硬化发生、发展中具有重要作用,是动脉粥样硬化形成的始动因素[1-2]。近年来的报道显示,miRNAs与AS的形成密切相关,在病理性心脏和血管组织中miRNA-21表达出现异常,提示miRNA-21与高血压、心肌梗死、心脏瓣膜病的形成有关[3],miRNA-1-2功能失调导致AS及心血管疾病的发生发展[4]。同时,有研究显示microRNA对心血管细胞的生长、分化、增殖及凋亡有重要的调控作用[5-6]。Schlabritz-Loutsevitch N等[7]研究发现miRNA-29与妊娠肥胖有关;而Li LY等[8]报道miRNA-29c可促进恶性胶质瘤的增殖、迁移、分化;Hu Y等[9]研究发现miRNA-29c通过靶向结合IGF-1的3′-UTR,参与调节HUVECs的细胞循环、增殖和血管形成等。miR-29c调控通路广泛,作用复杂,但有关miR-29c调控TNF-α诱导的人脐静脉内皮细胞增殖与凋亡的作用鲜少报道。本研究主要探讨miR-29c在TNF-α诱导的人脐静脉内皮细胞中对其细胞增殖与凋亡的影响及可能作用机制。
1 材料与方法
1.1 一般材料
HUVECs购于北京大学医学院肿瘤研究所。miR-29c mimics、miR-29c mimics阴性对照、miR-29c inhibitor阴性对照、miR-29c inhibitor来源于上海吉玛公司;转染试剂和无血清培养基来源于Invitrogen公司;MTT试剂来源于AMRESCO公司;TNF-α来源于Sigma公司;BCA试剂盒、ECL试剂盒和Heochest 33342染色液均来源于碧云天研究所;总一氧化氮检测试剂盒来源于碧云天公司;p-Akt、eNOS、p-eNOS抗体来源于Cell Signaling公司;β-actin来源于Bioworld公司、二抗来源于康为世纪公司。
1.2 方法
1.2.1 细胞培养及处理 取HUVECs培养于适宜温湿度条件下,选择生长至80%融合的细胞进行各指标检测。采用接种于96孔板的细胞组,使用MTT法筛选miR-29c mimics转染HUVECs的最佳浓度和时间,并使用同法检测miR-29c对HUVECs增殖活力的影响;采用接种于6孔板的细胞组,使用Hoechst 33342染色法检测miR-29c对HUVECs凋亡的影响,使用Western blot技术检测miR-29c对Akt、eNOS磷酸化水平、eNOS蛋白表达的影响。
1.2.2 细胞的转染 取HUVECs接种于培养板中进行常规培养,至细胞融合度为80%~90%进行试验,每组设置3个复孔。转染前,先将miR-29c mimics、miR-29c阴性对照组、miR-29c inhibitor阴性对照、miR-29c inhibitor分别与适度浓度的培养基轻轻混匀,室温孵育5 min;然后将适宜浓度的Opti-MEMI培养基与转染试剂(LipofectamineTM2000)混匀,在室温条件下孵育5 min;混匀上述两步的混合试剂,在室温条件下孵育20 min后,将其加入含有HUVECs及Opti-MEMI培养基的培养板中,轻轻混匀。
1.2.3 MTT法检测HUVECs增殖活力 将HUVECs以适宜的密度接种于96孔板中,并设置3个复孔,待培养板中的HUVECs融合率达到30%~40%时,加入DMEM培养基(不含血清),再按要求处理细胞(待同步培养12 h后),每组各孔细胞均加入DMEM培养基(含血清,200 μL)和MTT溶液(20 μL),培养4 h后弃去上清,每个培养孔中加入DMSO(150 μL)后轻轻摇动5 min,将培养孔细胞放置于酶标仪(490 nm波长)处测吸光度值(OD)。HUVECs增殖活力(%)=实验组/对照组×100%。
1.2.4 Hoechst 33342荧光染色法检测HUVECs凋亡 将HUVECs接种于6孔板中,待细胞生长至培养孔面积的80%时,加入培养基并培养12 h,细胞按要求处理后再吸干培养板中的原培养液,每个培养孔中加入多聚甲醛(4%、1 mL),在4℃条件下固定20 min后润洗3次,最后每个培养孔中加入1 mL的Heochst 33342染色液,在37℃的条件下染色20 min后润洗3次,于倒置荧光显微镜观察并拍照。
1.2.5 Western blot法检测HUVECs的eNOS、p-Akt及p-eNOS磷酸化蛋白的表达 采用BCA蛋白定量法进行HUVECs总蛋白的蛋白定量检测。每组取50 μg蛋白与等量4×SDS加样缓冲液混匀,置100℃加热,蛋白变性5 min,点样并进行SDS-PAGE电泳,然后切胶,PVDF膜用含5%脱脂奶粉的PBS封闭2 h,加p-AKT(ser473)、eNOS、p-eNOS(Ser1177)抗体于PBST室温孵育2 h,洗膜,PBST室温孵育4 h后孵育二抗3 h,洗膜,然后用ECL试剂盒显色,最后用凝胶图像处理系统分析目的条带。
1.2.6 总一氧化氮检测试剂盒检测HUVECs中NO释放量 使用TNF-α诱导人脐静脉内皮细胞48 h后,取100 μL的HUVECs培养液,采用总NO检测试剂盒检测培养液中NO的浓度及释放量。
1.3 统计学方法
采用SPSS13.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,采用单因素方差分析,P<0.05为差异有统计学意义,P<0.01为差异有高度统计学意义。
2 结果
2.1 TNF-α诱导HUVECs最佳时间和浓度的筛选
采用MTT法检测TNF-α在不同作用时间和浓度条件下对HUVECs增殖的影响,评估TNF-α对HUVECs的最佳诱导时间和浓度。采用不同浓度的TNF-α(0 ng/mL、5 ng/mL、10 ng/mL、30 ng/mL、50 ng/mL、80 ng/mL、100 ng/mL)诱导HUVECs 48 h,结果显示HUVECs的增殖活力随TNF-α诱导浓度的增加而降低,当TNF-α的诱导浓度达到10 ng/mL时,HUVECs增殖活力较空白对照组明显降低,差异有统计学意义(P<0.05),因此,选取10 ng/mL为TNF-α最佳诱导浓度,见表1。TNF-α(10 ng/mL)以不同时间(0 h、12 h、24 h、36 h、48 h)作用于HUVECs后,随着作用时间的延长,细胞增殖活力呈时间依赖性下降,当作用时间为48 h时,相较于空白对照组(0 h处理组)明显降低,差异有统计学意义(P<0.05),因此,选取TNF-α最佳诱导时间为48 h,见表2。
2.2 TNF-α诱导对HUVECs miR-29c表达的影响
采用qRT-PCR法检测TNF-α在不同浓度和作用时间条件下对HUVECs中miR-29c表达的影响,评估在HUVECs中TNF-α诱导与miR-29c表达的关联性。以不同浓度的TNF-α(0 ng/mL、5 ng/mL、10 ng/mL、30 ng/mL、50 ng/mL、80 ng/mL、100 ng/mL)诱导HUVECs 48 h,结果显示miR-29c的表达量随TNF-α浓度的增大,呈浓度依赖性增加,与空白对照组(0 ng/mL组)比较,虽然低浓度处理组(5 ng/mL)差异不明显(P>0.05),但当TNF-α浓度达到10 ng/mL时,miR-29c表达量差异显著增加,差异具有统计学意义(P<0.05),见表3。10 ng/mL的TNF-α不同作用时间(12 h、24 h、36 h、48 h)诱导组与空白对照组(0 h处理组)相比较,miR-29c表达量明顯增加,当作用时间为48 h时,差异明显(P<0.05),且随着作用时间的延长,miR-29c表达量呈时间依赖性增加,见表4。故在HUVECs中,TNF-α诱导miR-29c的表达量呈时间及剂量依赖性增加。
2.3 miR-29c mimics转染对HUVECs增殖活力的影响
采用MTT法检测不同转染浓度和作用时间的miR-29c mimics对细胞增殖活力的影响,评估miR-29c mimics转染HUVECs的效果。使用不同浓度的miR-29c mimics(0 nmol/L、5 nmol/L、25 nmol/L、50 nmol/L、80 nmol/L、100 nmol/L)转染HUVECs 48 h,检测细胞增殖活力。结果显示,相对于空白对照组(0 nmol/L),浓度为50 nmol/L的转染组,其细胞增殖活力明显降低(P<0.05),miR-29c mimics转染效果更好,见表5。再将miR-29c mimics(50 nmol/L)分别作用于HUVECs 12 h、24 h、36 h、48 h,结果显示,与空白对照组(0 h处理组)相比,细胞增殖活力随作用时间延长而下降(P<0.05),表明miR-29c mimics随作用时间延长转染效果越好,见表6。
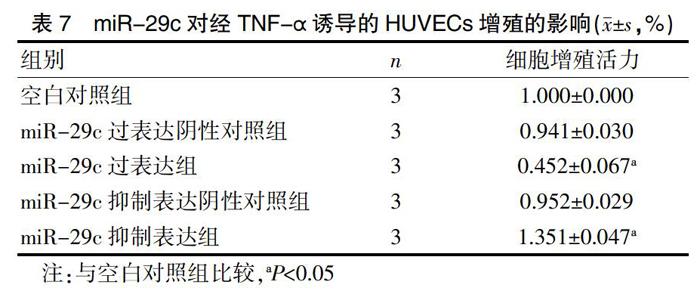
2.4 miR-29c对经TNF-α诱导的HUVECs增殖的影响
空白对照组、miR-29c过表达阴性对照组(miR-29c scramble control)、miR-29c过表达组(miR-29c mimics)、miR-29c抑制表达阴性对照组(miR-29c anti- scramble)、miR-29c抑制表达组(miR-29c inhibitor,anti-miR-29c)预先转染HUVECs,再用TNF-α(10 ng/mL)诱导HUVECs 48 h。与空白对照组相比,miR-29c mimics阴性对照组和miR-29c inhibitor阴性对照组细胞增殖活力的差异不明显(P>0.05);与空白对照组、阴性对照组相比,miR-29c 过表达组细胞增殖活力明显下降(P<0.05),miR-29c抑制表达组细胞增殖活力明显增加(P<0.05)。表明在TNF-α诱导的HUVECs中,miR-29c可明显抑制其增殖,见表7。
2.5 miR-29c对经TNF-α诱导的HUVECs凋亡的影响
空白对照组、miR-29c过表达阴性对照组、miR-29c过表达组、miR-29c抑制表达阴性对照组、miR-29c抑制表达组分别转染HUVECs,再用10 ng/mL的TNF-α诱导HUVECs 48 h,Heochst 33342染色结果显示空白对照组(封三图1A)和miR-29c过表达阴性对照组(封三图1B)的凋亡率分别为(14.830±3.186)%、(15.414±1.358)%;miR-29c过表达组(封三图1C)的细胞凋亡率为(32.190±9.254)%,与空白对照组、miR-29c过表达阴性对照组比较,其差异明显(P<0.05);miR-29c抑制表达组(封三图1E)的细胞凋亡率为(7.830±2.984)%,其阴性对照组(封三图1D)的细胞凋亡率为(15.102±3.301)%,差异明显(P<0.05)。说明miR-29c能促进经TNF-α诱导的HUVECs凋亡。
2.6 miR-29c对Akt磷酸化(p-Akt)、eNOS磷酸化(p-eNOS)及eNOS蛋白表达的影响
空白对照组、miR-29c过表达阴性对照组、miR-29c过表达组、miR-29c抑制表达阴性对照组、miR-29c抑制表达组分别转染HUVECs,再用10 ng/mL的TNF-α诱导HUVECs 48 h,相对于空白对照组和阴性對照组,miR-29c过表达组的Akt磷酸化(p-Akt)和eNOS磷酸化(p-eNOS)表达明显下调(P<0.05);相对于阴性对照组,miR-29c抑制表达组的Akt磷酸化(p-Akt)和eNOS磷酸化(p-eNOS)表达明显上调(P<0.05),对eNOS蛋白表达无影响,说明miR-29c可抑制经TNF-α诱导的HUVECs中Akt及eNOS磷酸化,见表8。
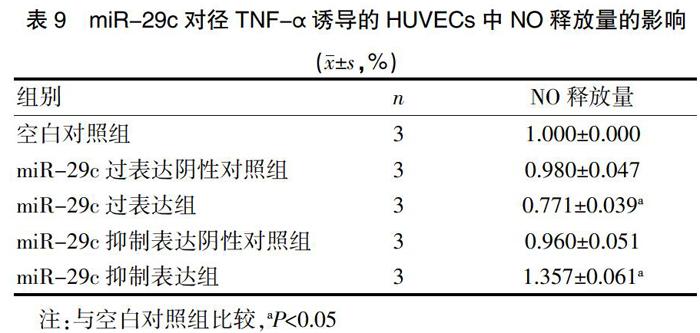
2.7 miR-29c对经TNF-α诱导的HUVECs NO释放量的影响
空白对照组、miR-29c过表达阴性对照组、miR-29c过表达组、miR-29c抑制表达阴性对照组、miR-29c抑制表达组分别转染HUVECs,再用10 ng/mL的TNF-α诱导HUVECs 48 h,分别取培养液100 μL,以硝酸还原酶法检测NO浓度,进而评估HUVECs NO释放量,结果显示,相对于空白对照组和miR-29c过表达阴性对照组,miR-29c过表达组NO释放量明显下降(P<0.05);相对于其阴性对照组,miR-29c抑制表达组NO释放量明显增加(P<0.05),说明miR-29c可降低经TNF-α诱导的HUVECs中NO的释放量,见表9。
3 讨论
血管内皮细胞在维持机体内环境稳定的过程中发挥着举足轻重的作用,Lee HY[10]、Guo F[11]等发现TNF-α可通过激活HUVECs从而诱导HUVECs的凋亡,进而提升血管通透性和引发白细胞浸润及一系列的炎症反应。为摸索TNF-α离体作用时间及浓度,采用MTT法检测TNF-α的诱导对血管内皮细胞增殖活力的影响,结果显示10 ng/mL的TNF-α处理HUVECs 48 h,细胞的增殖活力明显降低,从而建立起TNF-α诱导的HUVECs凋亡模型。
有研究表明,在动脉粥样硬化形成过程中血管内皮细胞可产生TNF-α,其通过与敏感靶细胞结合引发内皮细胞的凋亡和坏死[12]。Hu Y等[9]研究发现HUVECs中miR-29c的表达与TNF-α的诱导可能存在关联,故实验采用qRT-PCR法检测TNF-α诱导HUVECs后miR-29c表达的变化,结果显示miR-29c的表达随TNF-α诱导呈时间及剂量依赖性的增加,即miR-29c的表达与TNF-α的诱导呈正相关。
內皮细胞的瞬时转染和效率评估是研究结果准确度的基础。本研究采用化学合成的miRNA mimics瞬时转染HUVECs。然后用MTT法检测miR-29c mimics对血管内皮细胞增殖活力的影响来评估转染效果。结果发现50 nmol/L的miR-29c mimics作用细胞48 h后,细胞增殖活力明显下降,有效地筛选出了miRNA成熟体模拟物转染的最佳转染条件。
研究表明miR-155、miR-221、miR-222、miR-29c和miR-126等多种miRNAs是血管内皮细胞损伤的调节因子,其参与维持血管内皮细胞生物学功能的调节[13-15]。Liu L等[16]研究发现miR-29c靶向抑制VEGFA的表达,促进HUVEC的血管形成,是肺腺癌的潜在治疗靶标,提示miR-29c参与调控HUVEC的相关生物学功能;Hu Y等[9]研究发现miR-29c表达于HUVECs,参与调节HUVECs的增殖和血管形成等,暗示miR-29c可能参与HUVECs损伤及动脉粥样硬化发生发展的调节。然而在TNF-α诱导的血管内皮细胞的增殖与凋亡中,miR-29c是否参与其调控尚未可知。故将miR-29c mimics和inhibitor分别转入TNF-α诱导的HUVECs中。结果发现miR-29c过表达明显下调HUVECs增殖活力,促进经TNF-α诱导的HUVECs凋亡,而miR-29c抑制表达则出现相反趋势的结果。
早期研究发现,AKT是一种丝氨酸/苏氨酸蛋白激酶,对细胞增殖、分化和凋亡具有重要调控作用,与动脉粥样硬化、糖尿病及癌症等疾病密切相关[17-18]。eNOS主要分布于血管内皮细胞,是机体内NO产生的关键酶,可促使内皮源性舒血管因子NO的释放[19-20]。也有研究表明AKT信号旁路的激活参与了eNOS磷酸化而产生内皮源性NO,使血管舒张[21]。NO能抑制内皮素等缩血管物质分泌,并具有抑制血小板聚集、抑制黏附因子表达及清除氧自由基等作用,从多个环节抑制血管内皮细胞凋亡,是重要的内源性抗动脉粥样硬化因子[22-23]。因此,探索miR-29c对p-Akt、p-eNOS、eNOS蛋白表达的影响,有益于阐明miR-29c抑制经TNF-α诱导的HUVECs的增殖及促进其凋亡的分子机制。本研究检测miR-29c对HUVECs p-Akt、p-eNOS、eNOS蛋白表达的影响,结果发现miR-29c过表达可显著下调p-Akt、p-eNOS磷酸化,抑制表达miR-29c能显著上调p-Akt、p-eNOS磷酸化,而对eNOS蛋白的表达无影响,同时检测培养液中NO的含量,发现miR-29c可降低经TNF-α诱导的HUVECs中NO的释放量。
综上所述,miR-29c可显著抑制经TNF-α诱导的HUVECs的增殖及促进其凋亡,其机制可能与下调p-Akt、p-eNOS磷酸化,进而抑制NO释放有关,为进一步阐明AS的发生发展机制及防治该疾病提供了新依据。
[参考文献]
[1] Reiner Z,Tedeschi-Reiner E. New information on the pathophysiology of atherosclerosis[J]. Lijec Vjesn,2001, 123(1-2):26.
[2] 张鹏,纪亮,沈雷,等. 在高糖条件下锰超氧化物歧化酶刺激MSC提高血管内皮细胞活性的研究[J]. 中国现代医生,2014,52(13):13-15.
[3] Cheng Y,Ji R,Yue J,et al. MicroRNAs are aberrantly expressed in hypertrophic heart: Do they play a role in cardiac hypertrophy[J]. Am J Pathol,2007,170(6):1831-1840.
[4] Zhao Y,Ransom JF,Li A,et al. Dysregulation of cardiogenesis,cardiac conduction,and cell cycle in mice lacking miRNA-1-2[J]. Cell,2007,129(2):303-317.
[5] Zhao Y,Samal E,Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature,2005,436(7084):214-220.
[6] Williams AH,Liu N,van Rooij E,et al. MicroRNA control of muscle development and disease[J]. Curr Opin Cell Biol,2009,21(3):461-469.
[7] Schlabritz-Loutsevitch N,Apostolakis-Kyrus K,Krutilina R,et al. Pregnancy-driven cardiovascular maternal miR-29 plasticity in obesity[J]. J Med Primatol,2016,45(6):297-303.
[8] Li LY,Xiao J,Liu Q,et al. Parecoxib inhibits glioblastoma cell proliferation, migration and invasion by upregulating miRNA-29c[J]. Biol Open,2017,6(3):311-316.
[9] Hu Y,Deng F,Song J,et al. Evaluation of miR-29c inhibits endotheliocyte migration and angiogenesis of human endothelial cells by suppressing the insulin like growth factor 1[J]. Am J Transl Res,2015,7(3):489-501.
[10] Lee HY,You HJ,Won JY,et al. Forkhead factor,FOXO3a, induces apoptosis of endothelial cells through activation of matrix metalloproteinases[J]. Arterioscler Thromb Vasc Biol,2008,28(2):302-308.
[11] Guo F,Wu R,Xu J. Salicin prevents TNF-α-induced cellular senescence in human umbilical vein endothelial cells(HUVECs)[J]. Artif Cells Nanomed Biotechnol,2019, 47(1):2618-2623.
[12] Szot K,Góralczyk K,Michalska M,et al. The effects of humic water on endothelial cells under hyperglycemic conditions: Inflammation-associated parameters[J]. Environ Geochem Health,2019,41(3):1577-1582.
[13] Decembrini S,Bressan D,Vignali R,et al. MicroRNAs couple cell fate and developmental timing in retina[J]. Proc Natl Acad Sci USA,2009,106(50):21179-21184.
[14] O'Hara AJ,Wang L,Dezube BJ. Tumor suppressor microRNAs are underrepre-sented in primary effusion lymphoma and Kaposi sarcoma[J]. Blood,2009,113(23):5938-5941.
[15] Huang YQ,Li J,Huang C,et al. Plasma microRNA-29c levels are associated with carotid intima-media thickness and is a potential biomarker for the early detection of atherosclero-sis[J]. Cell Physiol Biochem,2018,50(2):452-459.
[16] Liu L,Bi N,Wu L,et al. MicroRNA-29c functions as a tumor suppressor by targeting VEGFA in lung adenocarcinoma[J]. Mol Cancer,2017,16(1):50.
[17] 王媛媛,曹建,萬建华. PI3K-Akt-eNOS信号通路在间歇性低氧减轻大鼠心肌缺血/再灌注损伤中的作用[J]. 中国现代医生,2017,55(27):35-37.
[18] Edwards LA,Thiessen B,Dragowska WH,et al. Inhibition of ILK in PTEN-mutant human glioblastomas inhibits PKB/Akt activation, induces apoptosis, and delays tumor growth[J]. Oncogene,2005,24(22):3596-3605.
[19] Tao Y,Yu S,Chao M,et al. SIRT4 suppresses the PI3K/Akt/NF κB signaling pathway and attenuates HUVEC injury induced by oxLDL[J]. Mol Med Rep,2019,19(6):4973-4979.
[20] 崔丽莉,程刚. 一氧化氮在甲状腺功能减退所致血管内皮损伤中作用的研究进展[J]. 中国现代医生,2017, 55(28):164-168.
[21] Zhang Y,You B,Liu X,et al. High-mobility group box 1(HMGB1) induces migration of endothelial progenitor cell via receptor for advanced glycation end-products(RAGE)-dependent PI3K/Akt/eNOS Signaling Pathway[J]. Med Sci Monit,2019,25:6462-6473.
[22] Yang CY,Chen C,Lin CY,et al. Myricetin ameliorated ischemia/reperfusion-induced brain endothelial permeability by improvement of eNOS uncoupling and activation eNOS/NO[J]. J Pharmacol Sci,2019,140(1):62-72.
[23] Wang H,Yao Y,Liu J,et al. Dopamine D4 receptor protected against hyperglycemia-induced endothelial dysfunction via PI3K/eNOS pathway[J]. Biochem Biophys Res Commun,2019,518(3):554-559.
(收稿日期:2019-08-21)
