乳腺腺肌上皮瘤一例
2019-02-21何登飞王安标
何登飞, 王安标
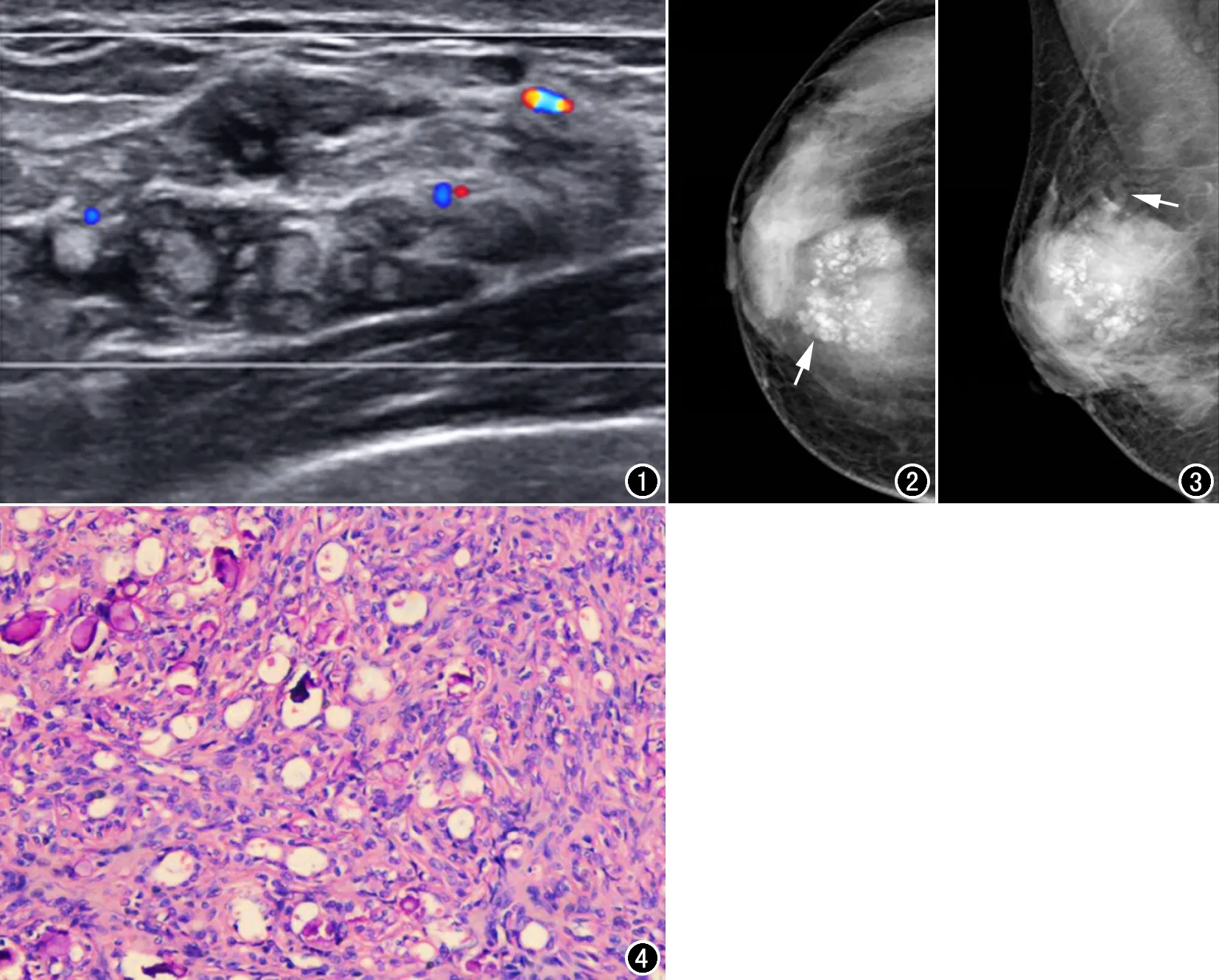
图4 镜下病理示增生的肌上皮细胞围绕增生的腺上皮细胞形成双相套管样结构(HE,×100)。
图1 CDFI示右乳11~12点方向大小约45mm×13mm的片状不均质回声包块,其内多发血流信号。
图2 乳腺钼靶X线摄影头尾位示右乳内上象限大小约41mm×30mm的浅分叶稍高密度肿物,其内多发小片状钙化(箭)。图3 乳腺钼靶X线摄影内外侧斜位示右乳内上象限肿物边界模糊,并见多发粗大血管影(箭)。
病例资料患者,女,29岁,4天前无意间触及右乳包块就诊。查体:右乳内上象限触及长径约20 mm的包块,质韧,边界不清,活动度可,无压痛,双侧腋窝未扪及肿大淋巴结。超声探及右乳11~12点钟方向范围约45 mm×13 mm的片状不均质稍低回声,边界不清,形态不规则;彩色多普勒血流成像(CDFI)提示其内多发短棒状血流信号(图1),考虑乳腺腺病。乳腺钼靶X线摄影:右乳内上象限见等密度肿块影,边界模糊,肿块大小约41 mm×30 mm,其内多发呈簇分布的、中心密度稍低的小片状钙化,钙化边缘模糊,周围腺体密度增高并见多发粗大血管影(图2、3),考虑右乳上部肿块伴钙化,恶性可能大。患者行右侧乳腺包块切除术,术中见:于右乳12点方向据乳头1 cm处行4 cm的放射状手术切口,切开皮肤、皮下组织、腺体见一实性、质硬包块,完整切除包块及周围部分正常乳腺组织送检。病理:大体标本大小约60 mm×40 mm×30 mm,切面灰红、淡黄,实性,质软;镜检示肿瘤组织由增生的肌上皮细胞和腺上皮细胞组成,增生的肌上皮细胞围绕腺上皮细胞形成双相套管样结构(图4);增生的腺上皮细胞呈立方状或柱状,核圆形,位于细胞的基底部,核仁少,胞浆丰富红染,伴有顶浆分泌现象。免疫组化:ER(腺上皮+)、PR(腺上皮+)、PCK(腺上皮+)、P63(肌上皮+)、CK5/6(肌上皮+)、SMA(肌上皮+)、Calponin(肌上皮+)、S-100(肌上皮+),病理结合免疫组化诊断:(右乳)腺肌上皮瘤。
讨论乳腺腺肌上皮瘤(adenomyoepithelioma,AME)是由乳腺腺泡内层的腺上皮和腺泡外周的肌上皮同时增生形成的一种少见的特殊类型肿瘤,多为良性,恶性少见,可出现腋窝淋巴结及远处血行转移[1]。2003年WHO乳腺肿瘤组织学分类将AME归属于肌上皮病变。乳腺AME好发于50岁以上女性,也可见年轻女性及男性[2]。患者多无临床症状,通常为体检或意外发现,多表现为乳腺单发的无痛性肿块。本例表现与之相符。
乳腺AME的影像学表现缺乏明显特征性,与乳腺恶性肿瘤,尤其是乳腺叶状肿瘤难以鉴别[3]。笔者结合文献资料总结乳腺AME的影像学表现为:超声多表现为实性或以实性成分为主的分叶状肿块,与血管相关[1],其内回声多不均匀;X线平片上肿瘤多呈浅分叶状,形态不规则,边界模糊的等密度或稍高密度孤立肿块,周围血管影纡曲增粗,较少病灶内见多发呈簇分布的中心密度稍低的小片状钙化。乳腺AME内出现微小钙化较少见[4],本例显示的钙化与文献报道一致。当边界模糊的肿块内出现形态单一、中心密度稍低的小片状钙化,而肿块外未见类似钙化时,需考虑到本病的诊断。
乳腺AME是罕见的乳腺良性肿瘤,临床及影像学表现均缺乏特异性,确诊需依靠组织病理学。由于AME存在局部复发的可能性,应被视为低度恶性肿瘤,故明确诊断后术中应行局部扩大切除,同时术后运用超声进行随访观察[3]。