功能化阿霉素脂质体制备与肿瘤靶向性评价
2019-02-21宋振国吴小瑜程沁园龙苗苗
宋振国,吴小瑜,程沁园,陈 慧,龙苗苗
(无锡卫生高等职业技术学校药学系,江苏 无锡 214028)
阿霉素(DOX)为广谱抗肿瘤药物,可通过嵌入DNA阻断核酸分子的合成,但会对机体正常细胞产生广泛的生物化学效应,从而对人体正常组织产生强烈的毒副作用[1]。脂质体(LP)为具有类细胞膜的双分子层脂质膜结构的微小囊泡,具有自行密合的特性,可包载疏水性或/和亲水性药物。脂质体具有的纳米尺寸可通过高渗透滞留效应(EPR)被动靶向到肿瘤部位,将脂质体作为阿霉素药物递送载体,可提高肿瘤部位药物浓度,降低药物的毒副作用[2-5]。目前已有多种阿霉素脂质体上市,但仅依靠EPR,普通阿霉素脂质体无法主动靶向肿瘤细胞,故研发功能化脂质体尤为重要。透明质酸(HA)为线性多糖,具有生物相容性好和生物可降解性等优点。HA可与肿瘤细胞表面过量表达的CD44受体结合,具有靶向肿瘤细胞的功能。故可作为药物载体用于靶向传递药物,增加药物在肿瘤部位的蓄积,有效抑制肿瘤细胞生长[6-7]。此外,与磷脂相比,多糖聚合物在体内降解较缓慢,将其修饰于脂质体表面,可提高脂质体的稳定性,增加其在体内的循环时间[8-9]。硬脂胺为亲脂性阳离子化合物,通过加入少量硬脂胺调节脂质体表面电荷,可提高其稳定性,而且用于制备的阳离子脂质体具有肺部癌症靶向治疗作用[10]。本研究中通过引入HA-硬脂胺聚合物(HS),制备功能化阿霉素脂质体,并对其体外性质和抗肿瘤活性进行研究。
1 仪器与试药
1.1 仪器
DF-101S型恒温加热磁力搅拌器(郑州科泰实验设备有限公司);RV10BS96型旋转蒸发仪(德国IKA仪器设备有限公司);UV-1800型紫外分光光度计(日本岛津仪器有限公司);JEM-2100型透射电子显微镜(日本Jeol公司);Zetasizer Nano ZS型纳米粒度分析仪(英国Malven公司);JY92-ⅡN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);DMIL LED型倒置荧光显微镜(德国Leica公司);FACSCalibur型流式细胞仪(美国 Beckman Coulter公司)。
1.2 试药
盐酸阿霉素(大连美仑生物技术有限公司,批号为J0614A,纯度>98%);HA(华熙福瑞达生物医药有限公司,批号为1409191,相对分子质量为5 300);大豆磷脂(上海太伟有限公司,纯度98%);硬脂胺(阿拉丁试剂有限公司);胆固醇(上海生工生物工程股份有限公司);N-羟基琥珀酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)均购自上海晶纯生化科技股份有限公司;其余试剂均为分析纯。
2 方法与结果
2.1 HS 的合成
将 HA(含 0.25 mmol羧基)100 mg溶于 10 mL 无水甲酰胺中,加入等浓度比的 EDC和 NHS(60 mg)活化。称取硬脂胺72 mg,溶于 N,N-二甲基甲酰胺,然后缓慢滴加入上述溶液中,氮气保护下反应48 h。反应结束后用蒸馏水透析(截留相对分子质量为3.5×103)3 d,冷冻干燥得HS。通过1H-NMR确证聚合物化学结构。结果见图1。表明硬脂胺已成功链接到HA主链上。

图1 HS的核磁共振氢谱
2.2 功能化阿霉素脂质体的制备与表征
制备:称取磷脂500 mg和胆固醇50 mg,溶于无水乙醚,逐滴加入盐酸阿霉素溶液2 mg,旋转蒸发除尽有机溶剂,加入磷酸盐缓冲液(PBS)10 mL,水化30 min后冰浴超声10 min,然后加入HS溶液,50℃恒温孵育1 h,得功能化阿霉素脂质体(DOX/LP/HS)。同法制备阿霉素普通脂质体(DOX /LP)。
粒径及Zeta电位测定:取适量脂质体溶液置测量杯内,采用动态光散射技术(DLS)测定脂质体的粒径、多分散系数(PDI)和 Zeta电位。DOX/LP的粒径为(47.17 ±0.85)nm,PDI为 0.297 ±0.08;经 HS 聚合物修饰后,DOX /LP /HS 粒径变化不大,为(51.97±0.95)nm,PDI为 0.286 ±0.07,分布较好(图 2 A)。DOX /LP 的Zeta 电 位 为 (-4.64±0.81)mV,经 HS 修 饰 后 ,DOX /LP /HS 的电位降低到(-9.48±0.55)mV,这是由于HA结构中存在大量羧基所致。表面的负电有利于防止脂质体聚沉,避免血浆蛋白吸附,提高在血液中的稳定性。
透射电镜观察:通过透射电镜(TEM)观察脂质体形貌特征及粒径分布。取脂质体分散液滴于铜网上,晾干后滴加磷钨酸对其负染,室温干燥后用TEM进行观察。透射电镜图可以看出DOX/LP/HS形貌呈球形或类球形,分布较窄(图2 B)。说明脂质体具有较好的粒径及分布,适宜作为抗肿瘤药物载体。

图2 DOX/LP/HS粒径分布图及透射电镜图
包封率测定:准确量取定量DOX/LP/HS,加入甲醇10 mL超声破坏后,在480 nm波长处测定吸光度,计算药物总含量。取2.2的“制备”项下脂质体2.0 mL,置截留相对分子质量为3 000的超滤杯中,10 000 r/min离心50 min,测得游离药物含量,并计算包封率(EE)。结果,DOX /LP 包封率为(94.8 ± 1.95)%,DOX /LP /HS包封率为(98.34±1.02)%,表明两种脂质体对药物均有较好的包载能力。HS插入脂质体双分子结构中,可使载药空间增大,一定程度上提高了脂质体对药物的包封率。
2.3 体外药物释放
采用动态透析法测定体外释放行为。向透析袋中加入脂质体 2 mL,将透析袋置 PBS(pH =7.4,0.01 mmol/L)溶液 10 mL,在 100 r/min,(37 ±0.5)℃的摇床震荡,分别于不同时间取样1 mL,并加入新鲜PBS 1 mL。于480 nm波长处测定吸光度,并计算含量及累积释放度。DOX/LP和DOX/LP/HS的体外释放行为见图3。2种脂质体在10 h内的药物释放低于20%,表明DOX几乎全部包载于脂质体中,无明显突释现象。随着时间的延长,脂质体内药物缓慢释放,具有明显缓释作用。48 h时,DOX/LP/HS的累积释放度低于DOX/LP,这可能是由于HS的疏水段硬脂烷链插入脂质体双分子层膜,导致疏水作用力增强,结构更紧密,不利于药物向外自由扩散。

图3 DOX/LP和 DOX/LP/HS体外释放行为
2.4 稳定性考察
将装有脂质体混悬液的 10 mL棕色瓶置(4±0.5)℃冰箱中,不同时间用马尔文粒径仪测量脂质体粒径,考察其稳定性。此外,将制备的脂质体混悬液置(4±0.5)℃冰箱中,不同时间取样测定包封率,然后计算6 d后脂质体泄漏率[泄漏率=(第1天包封率-第6天包封率)/第 1天包封率 ×100%]。DOX/LP和 DOX/LP/HS放置的粒径变化见图4。可见,随着放置时间的延长,脂质体粒径均有所增加。其中第8天时,DOX/LP粒径急剧变大,并出现多峰,而DOX/LP/HS粒径变化不大,说明经HA修饰后,脂质体的稳定性有所提高。
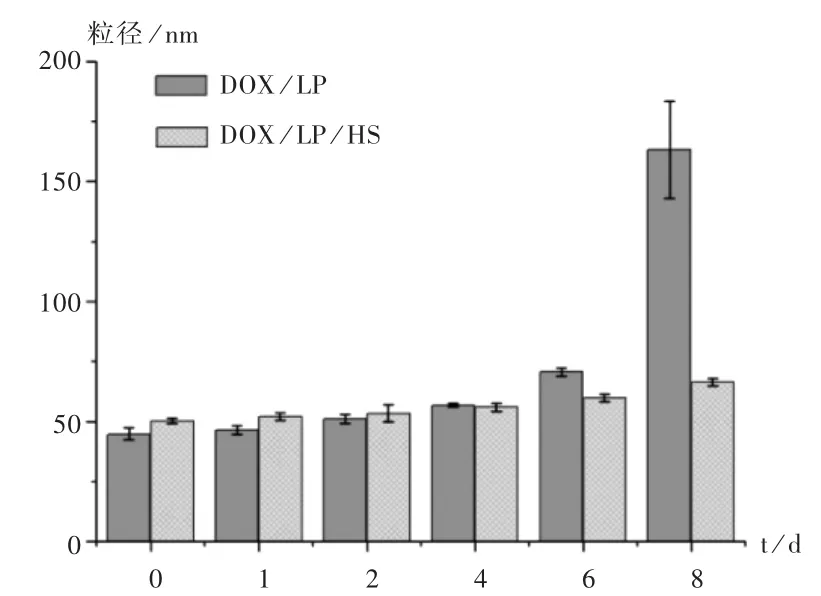
图4 DOX/LP和 DOX/LP/HS的粒径变化
DOX/LP和 DOX/LP/HS放置 6 d后的泄漏率分别为(4.94 ±0.5)% 和(1.93 ± 0.05)% ,DOX /LP /HS明显低于DOX/LP,说明脂质体经HS修饰后提高了脂质体结构的致密性,使药物不易泄露,提高了脂质体稳定性。
2.5 肿瘤靶向性评价
流式细胞仪测定:将MCF-7和COS7细胞按照3×105个/孔的密度加到6孔板培养 24 h,加入2 mL游离 DOX,DOX /LP,DOX /LP /HS(阿霉素终质量浓度为 5 μg /mL)孵育 1,2,4 h(以细胞培养液为空白对照),胰酶消化后,收集细胞,加入PBS 500 μL分散细胞后,用流式细胞仪测定相对荧光强度,代表摄取水平,结果见图5。可见,2种细胞对脂质体的摄取均有明显的时间依赖性。由于COS7细胞表面缺乏CD44受体的表达,DOX/LP/HS和DOX/LP在各个时间点的摄取无明显差异。而DOX/LP/HS在MCF-7细胞内的摄取率明显高于DOX/LP,这是因为HS修饰的阿霉素脂质体可通过细胞表面的CD44受体介导进入细胞,增加细胞内的药物蓄积量,具有更好的抗肿瘤作用。

图5 不同制剂在细胞中的摄取率
荧光显微镜观察:为了验证CD44受体介导的靶向作用,采用倒置荧光显微镜进一步观察 DOX/LP和DOX/LP/HS在MCF-7细胞内的摄取及分布情况。细胞以1.0×104个/孔的密度进行接种,孵育24 h。弃去原培养基,用PBS清洗3次,加入500 μL含游离DOX,DOX /LP,DOX /LP /HS(DOX 的终质量浓度为 5 μg/mL)孵育1,2,4 h。然后PBS润洗 3次,加入 4%多聚甲醛固定 20 min,Hoechst溶液(10 μg /mL)染色 20 min,PBS 清洗后在荧光显微镜下观察、拍照。
由图6可见,随着时间的延长,药物进入细胞的量逐渐增多,部分药物进入细胞核中,表现出时间依赖性。孵育时间为4 h时,游离DOX通过快速扩散入胞最多,且均进入细胞核内。与 DOX/LP相比,DOX/LP/HS的荧光强度明显增强,且主要集中于细胞核内,表明DOX/LP/HS具有更好的肿瘤细胞靶向性。以上结果表明,DOX/LP/HS能与肿瘤细胞表面的 CD44受体结合,提高药物的摄取量,更有效地发挥抗肿瘤作用。

图6 不同制剂在MCF-7细胞中的摄取荧光图(×40)
3 讨论
脂质体主要由磷脂和胆固醇形成类似细胞膜的双分子层结构,具有与细胞膜融合性好和生物相容性佳等特点,且可包载亲水性和亲脂性药物,故被广泛用于抗肿瘤药物的传递载体。DOX是临床常用的蒽环类抗肿瘤药物,但其具有严重的心脏毒性等毒副作用,临床应用受限。目前上市的DOX/LP/HS能降低药物的心脏毒性,但稳定性差,药物易渗漏,易受RES影响,虽然经聚乙二醇修饰可提高脂质体表面的亲水性,阻止血浆蛋白吸附,减少吞噬吸收,但其仅依靠EPR被动靶向到肿瘤部位,无法进一步提高肿瘤部位的药物蓄积。通过配体对脂质体表面进行修饰是提高其靶向性的有效手段。多糖聚合物可提高疏水性药物的水溶性,易于对结构进行修饰,连接各类配体,因而在抗肿瘤靶向给药系统备受关注[11-13]。HA可与大部分肿瘤细胞过表达的CD44受体结合,通过靶向介导更多药物进入肿瘤细胞,抑制肿瘤生长[7,14]。
本研究中主要合成HS,修饰脂质体,提高脂质体的靶向性和稳定性。通过考察HS的修饰方法发现,后插入法HS可以自发嵌入脂质体结构中,得到粒径更均一的脂质体。且 DOX/LP/HS的稳定性优于 DOX/LP。硬脂胺等阳离子化合物可通过调节脂质体表面电荷提高其稳定性[8]。此外,通过体外释放等试验结构推测,HS的疏水段插入脂质体双分子层膜,导致疏水作用力增强,结构更紧密,降低了脂质体的泄漏率。DOX/LP/HS可与MCF-7细胞表面的CD44受体结合,具有更高的摄取量和细胞内蓄积率。
综上所述,本研究为构建功能化脂质体作为抗肿瘤药物载体提供了参考。但本研究中仅对HS修饰的功能化脂质体的制备及物理性质进行了研究,后续试验应深入考察其体内外抗肿瘤活性。
