冷水鱼循环水养殖系统生物滤池成熟过程及 低温氮降解菌的分离与鉴定❋
2019-02-21蒋雯雯柳婷婷董双林田相利蔡玉勇李海东
蒋雯雯, 柳婷婷, 董双林,2, 田相利,2❋❋, 李 丽,2, 蔡玉勇, 李海东, 赵 坤
(1 .海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003; 2 .青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266235)
循环水养殖是一种通过对系统内养殖废水进行一系列物理、化学和生物处理,经处理后的水可以被再度用于养殖活动的新型养殖模式。循环水养殖因具有污水排放少、水资源利用率高、可以降低外来疾病引入风险、能够进行精准的养殖自动化管理等优点,被广泛应用于水产养殖活动[1]。在循环水养殖系统中,采用生物滤池实现氮元素从高毒害向低毒害的转换,是水处理的核心技术之一[2]。生物滤池的有效运转,需要在滤料表面形成生物膜,建立能有效去除氨氮和亚硝酸氮等有害污染物的菌群结构[3],而养殖活动中的温度、盐度、投喂量、水交换量以及日常管理等会直接影响硝化菌群的建立及其硝化效率[4-6]。因此,对于新建成的循环水养殖系统来说,确保生物膜成熟并具有稳定净化效果是系统早期运行的重点和难点。
受实验条件的限制,对生物滤池的研究大部分仅限于室内的小规模模拟实验,少有从商业规模养殖系统中取得研究数据[7-8],而从商业规模养殖系统中获得的数据,可以更好得用于系统的优化和设计[9]。另外,多数研究限于20 ℃以上的常温和高温系统[3, 10-11],对于低温冷水鱼循环水养殖系统的研究较少。同时,为维持并提高生物滤池的水处理效率,不少学者尝试从不同介质上分离得到具有高效降解氨氮和亚硝酸氮功能的细菌[12-13],然后将这些分离得到的细菌制成微生态制剂添加到生物滤料上,发现可有效提高生物滤料的水处理效率[14]。
本文以新建成的商业规模的冷水鱼循环水养殖系统的生物滤池为研究对象,通过测定各类水质指标,探究生物滤池的成熟过程和水处理效果,旨在了解商业规模下低温循环水养殖系统中生物膜的成熟周期和净化规律,为今后类似系统生物滤池的管理和设计提供借鉴。同时对成熟生物滤料进行了低温氮降解细菌的富集和分离,以期获得可有效降解养殖废水中氨氮和亚硝酸氮的细菌,用于后续添加至生物滤料上以提高生物膜构建速度和水处理效率。
1 材料与方法
1.1 系统组成及运行
实验系统位于山东省日照市,主要养殖硬头鳟(Oncorhynchusmykiss)、虹鳟(Oncorhynchusmykiss)等冷水性鱼类,养殖总量为35 000尾,鱼规格为40 g,日投喂量按鱼体重的1.5%。系统由养殖单元和水处理单元两部分组成,养殖单元为26个容积16.96 m3的圆形养殖池,总养殖容积440.86 m3,水处理单元包括沉淀池、微滤池、生物滤池、紫外消毒池和曝气池五部分(见图1),其中,生物滤池为6串联浸没式结构,总容积587.24 m3,滤料为立体弹性滤料,由聚乙烯纤维丝加工而成,直径为0.5 mm,比表面积约为360 m2·m-3,形状类似日常使用的毛刷。生物填料布设完成后,使用鱼池养殖废水对生物滤池浸泡10 d,后开启循环水养殖系统,系统运行期间日补水量10%,系统的水力停留时间约为1 h,日循环20次。
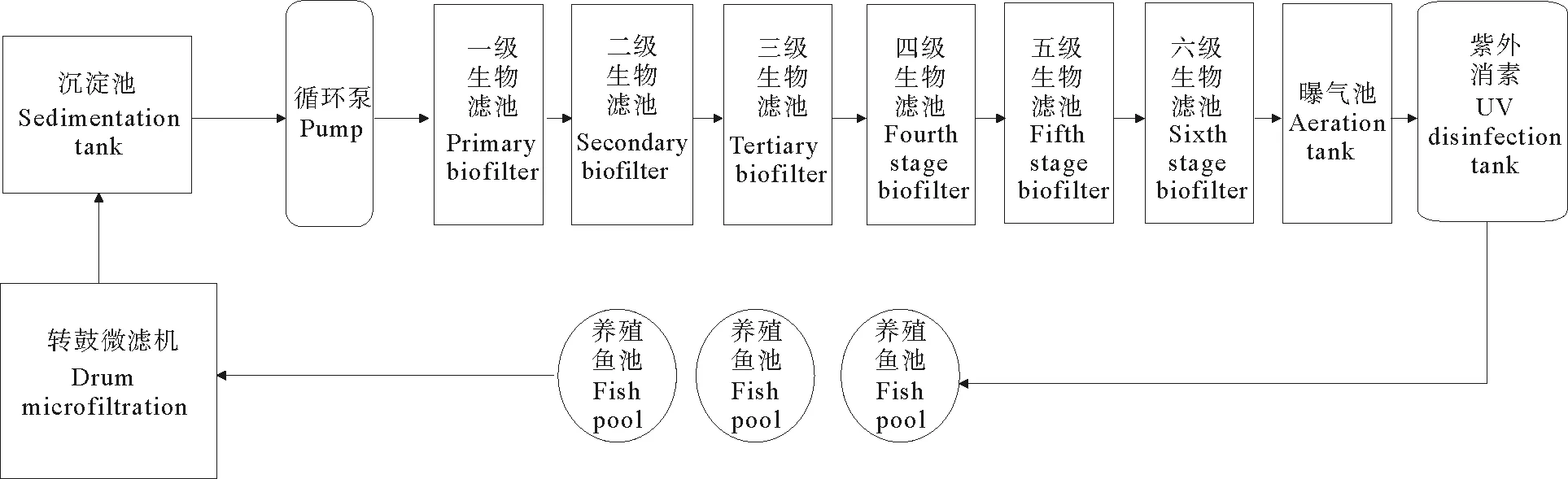
图1 循环水养殖系统水处理流程Fig.1 Water treatment process of recirculating aquaculture system
1.2 实验设计
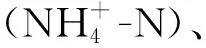
1.2.2 低温氮降解细菌的富集和分离 在第90天取生物膜已经成熟的生物填料2 g,以震荡方式将填料上的生物膜洗脱至100 mL无菌生理盐水中,制得菌悬液。按照体积比为10∶1的接种量将菌悬液接种到不同的硝化细菌富集培养基中,置于15 ℃,160 r/min的条件下持续培养7 d,记为第一个富集周期,第一个富集周期结束后,将所得的富集菌液按相同方法接种、培养7 d,记为第二个富集周期,如此持续富集7个周期,富集期间取第4、5、6和7富集周期的菌液按照1∶10的接种量,接种至人工配制的降解液中,置于15 ℃,160 r/min的条件下连续测定5天内富集菌液对氨氮和亚硝酸氮的降解效果,实验设置3个重复。取降解效果好的富集菌液,涂布于相应的富集培养基平板上,置于15 ℃条件下进行培养,待长出单菌落后进行分离、纯化。
1.2.3 低温氮降解细菌的降氮效果测定 将分离、纯化得到的细菌于LB液体培养基中培养至OD600值为0.5时,调整菌液浓度为106后按照10%的接种量接种至人工配制的降解液中,置于15 ℃,160 r/min的条件下测定第3和5天各株细菌对氨氮和亚硝酸氮的降解效果,再根据每株细菌的降解效果进一步选取降氮效果好的细菌进行分子生物学鉴定,实验设置3个重复。
1.3 实验用富集培养基及降解液
低温氮降解细菌的富集培养基主要参考李步先的研究[15],以葡萄糖为碳源,并分别以氨氮和亚硝酸氮为综合氮源以及氨氮、亚硝氮为单独氮源,基础配比如下:
MgSO40.1 g,NaH2PO4·2H2O 0.26 g,K2HPO40.5 g,CaCO31 g, FeSO4·7H2O 0.183 g,葡萄糖0.3或5.0 g(前3个周期所用葡萄糖添加量为0.3 g,后4个周期葡萄糖添加量为5.0 g),酵母膏0.03 g,1 000 mL纯水。
其中,N1富集培养基以添加2 g (NH4)2SO4、0.5 g NH4Cl和 1 g KNO2作为氮源,N2富集培养基以添加2 g (NH4)2SO4和0.5 g NH4Cl作为氮源,N3富集培养基以添加1 g KNO2作为氮源。
人工降解液参考李步先的研究[15],具体配比如下:
0.2 g NH4Cl,0.2 g NaNO2,2 g葡萄糖,1 000 mL纯水。
1.4 水质指标的检测方法
氨氮、亚硝酸氮、总氮、活性磷和总磷的测定主要参考《养殖水环境化学实验》[16],氨氮采用靛酚蓝法,亚硝酸氮采用重氮-偶氮比色法,总氮和总磷采用消解法,活性磷采用磷钼蓝法,硝酸氮采用紫外分光光度法;总有机碳、总碳和总无机碳使用德国耶拿公司的总有机碳分析仪(2100S)测定,温度和溶解氧使用手持溶氧仪AZ8403测定,pH使用笔试酸度计测定,盐度使用手持式盐度计测定,OD600值使用酶标仪SYnergy2测定。
1.5 单株细菌对氨氮和亚硝酸氮的降解效率
单株细菌对氨氮和亚硝酸氮降解率(n)计算公式:
n= (C0-Cn)/C0×100%。
式中:n为降解率 (%);C0为降解液中初始氨氮或亚硝酸氮浓度 (mg/L);Cn为降解液中氨氮或亚硝酸氮的终浓度 (mg/L)。
1.6 细菌的分子生物学鉴定方法
用水煮法提取细菌的DNA,采用细菌16SrDNA的通用引物27F和1472R进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测合格后送至青岛擎科天成生物技术有限公司进行测序。
1.7 数据处理
实验所得数据使用SPSS 22.0.0.0统计软件中的ANOVA进行显著性差异及均值多重比较(Duncan),以P<0.05为差异显著水平。
细菌测得的16SrDNA序列与NCBI数据库进行比对后,下载相似性大于97%的相关细菌序列,使用MEGA 7.0采用邻接法构建系统发育树。
2 结果与分析
2.1 生物滤池成熟过程中水质变动情况
2.1.1 系统内水质基本情况 在生物膜的培养和成熟过程中,生物滤池和鱼池的水温一直维持在18 ℃左右,pH稳定在7.5~8.0,溶解氧的浓度维持在5 mg/L以上,盐度均为(见表1)。

表1 系统内水质基本情况Table 1 Fundamental state of the water in the recirculating aquaculture system
注:如无特殊说明,所有表格中数据均为平均值±标准差。
Note: The data in all
Tables were presented as mean ± SD, unless specified.
① Temperature;②Dissolved oxygen ;③Salinity;④Biofilters effluent;⑤Fish pools effluent
2.1.2 系统内氮的变化 实验过程中,氨氮、亚硝酸氮、硝酸氮和总氮浓度变化见图2,前20 d内(见图2(a)),生物滤池出水和鱼池出水的氨氮浓度显著下降 (P< 0.05),说明生物滤料上附着的硝化细菌数量逐渐增加, 40 d以后,氨氮浓度基本稳定在0.05 mg/L以下。生物滤池出水和鱼池出水的亚硝酸氮浓度在前40 d内均呈现先升高再降低的变动特点(见图2(b)),40 d后系统的亚硝酸氮的浓度也都稳定在0.05 mg/L以下生物滤池出水和鱼池出水的硝酸氮和总氮浓度在整个实验周期内均显著上升 (P<0.05) (见图2(c)和2(d))。说明生物滤池中的生物膜主要进行的是将高毒的氨氮转化为低毒的硝酸氮的硝化反应,对于将硝酸氮转化为NO或N2排出系统的反硝化作用则很少或没有发生。综合比较,40 d后,系统内氨氮和亚硝酸氮的浓度基本保持稳定,说明滤料上的生物膜已经完全成熟。
2.1.3 系统内磷的变化 实验过程中,生物滤池出水和鱼池出水的活性磷与总磷浓度的变化与硝酸氮和总氮的表现相似,均呈现显著升高的趋势 (P<0.05) (见图3(a)和3(b)),说明生物滤池对活性磷和总磷的降解作用不显著。
2.1.4 系统内碳的变化 实验前60 d,生物滤池出水和鱼池出水的总碳和无机碳浓度呈稳步下降态势,60 d后趋于稳定(见图4(c)和4(b)),说明在生物膜成熟过程中也需要利用无机碳作为碳源,但总碳和无机碳在生物滤池出水中浓度的降低相对滞后,说明利用无机碳为碳源的菌群的形成滞后于利用氮、磷的菌群。相应的,与总碳和无机碳相比,从生物布设完成并开始浸泡,生物滤池对有机碳有显著降解作用(见图4(a))。实验第0天,鱼池出水中有机碳浓度为13 mg/L,经过生物滤池的降解后,同期内生物滤池出水中的有机碳浓度降低至4 mg/L。实验10 d后,系统开启循环运行,由于生物滤池的降解作用,2个测试点水体中的有机碳浓度始终稳定在7 mg/L以下。说明生物滤料上最初形成的群落主要利用有机碳为碳源,并且在以后群落演替的过程中,利用有机碳为碳源的群落也不会消失。
2.2 低温氮降解富集菌液的降氮效果测定
经过4个周期的富集后(见图5(a)),不同培养基富集的菌液对氨氮和亚硝酸氮均有较好的降解效果,特别是N3组的富集菌液,经过5天的降解实验可以将降解液中的氨氮由最初的(36±3.21) mg/L降解至(20±7.13) mg/L (P<0.05),将亚硝酸氮由最初的(44±0.79) mg/L显著降解至(2±0.75) mg/L (P<0.05),说明之前采集到的生物滤料上确实已经形成可以降解氨氮和亚硝酸氮的种群,并且在不断的富集过程中,这类种群已经逐渐成为优势种群。经过5个周期的富集后(见图5(b)),N3组的富集菌液经过5 d的降解实验可以将降解液中的氨氮由最初的(36±3.21) mg/L降解为(0.9±0.44) mg/L (P<0.05),将亚硝酸氮由最初的(44±0.79) mg/L降解至(0.076±0.01) mg/L (P< 0.05);N1和N2组的富集菌液经过5 d的降解实验可以将亚硝酸氮降解至(0.034±0.01)和(0.046±0.01) mg/L (P<0.05)。经过6个周期的富集后(见图5c),N3组的富集菌液在第4天已经能将降解液中的氨氮和亚硝酸氮分别降解至(0.035±0.01)和(0.3±0.17) mg/L (P< 0.05), N1和N2组的富集菌液也可以在第4天将降解液中的亚硝酸氮显著降解至(0.25±0.02)和(0.63±0.24) mg/L (P<0.05)。经过7个周期的富集后(见图5(d)),N3组的富集菌液在第5天能将降解液中的氨氮和亚硝酸氮分别降解至(1.68±0.86)和(0.056±0.01) mg/L (P<0.05), N1和N2组的富集菌液可以在第4天将降解液中的亚硝酸氮分别降解至(0.25±0.03)和(0.2±0.02)mg/L (P<0.05)。将第7周期各组富集菌液的降解效果与第6周期相比,到第5天,各组在2个周期间没有显著差异 (P>0.05),说明经过6个周期富集的菌液即达到富集要求。
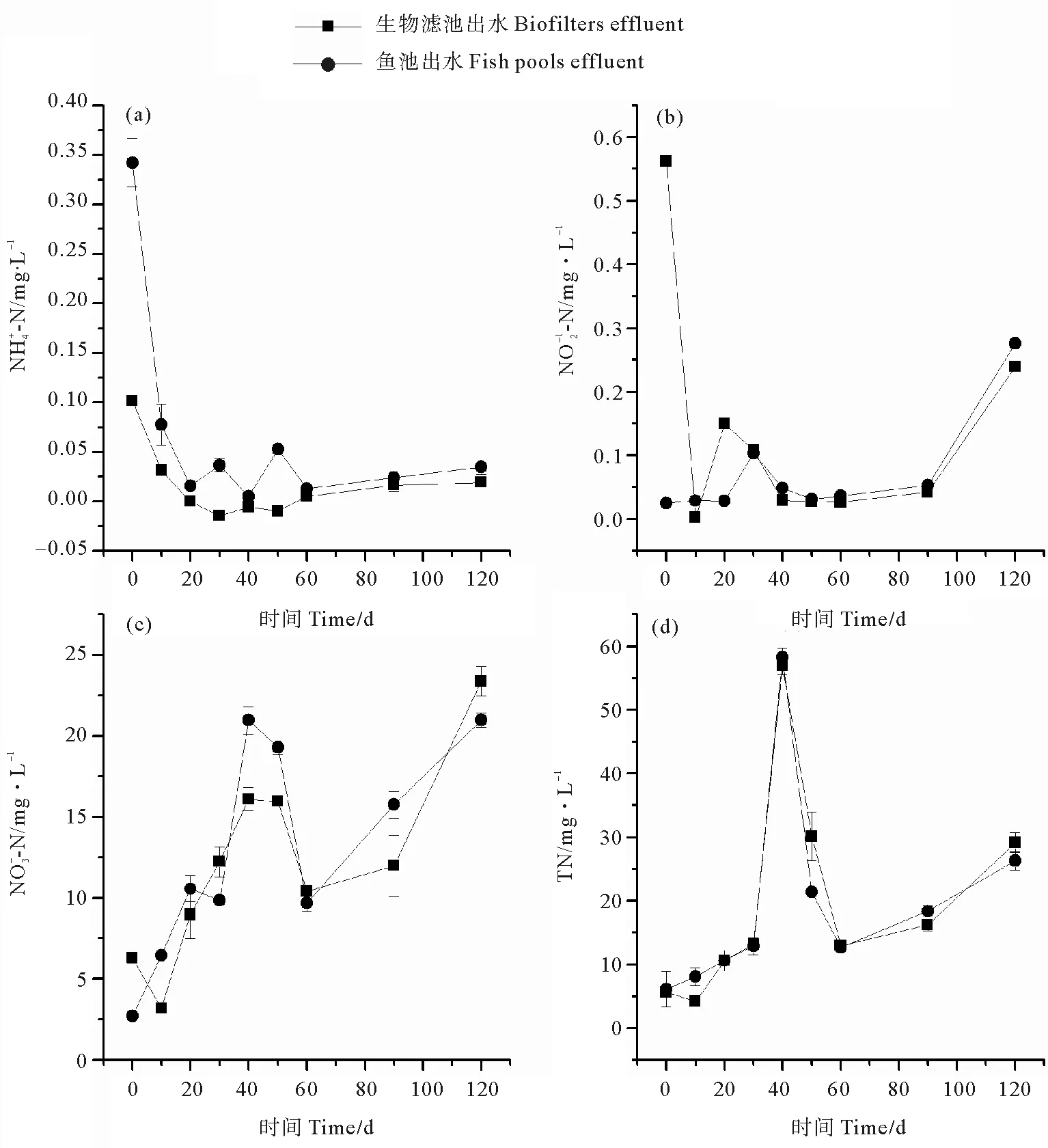
图2 系统内氨氮(a)、亚硝酸氮(b)、硝酸氮(c)和总氮(d)浓度变化情况Fig.2 Concentration changes of (a), (b), (c), TN (d) in the recirculating aquaculture system

图3 系统内活性磷(a)和总磷(b)浓度变化情况Fig.3 Concentration changes of (a) and TP (b) in the recirculating system
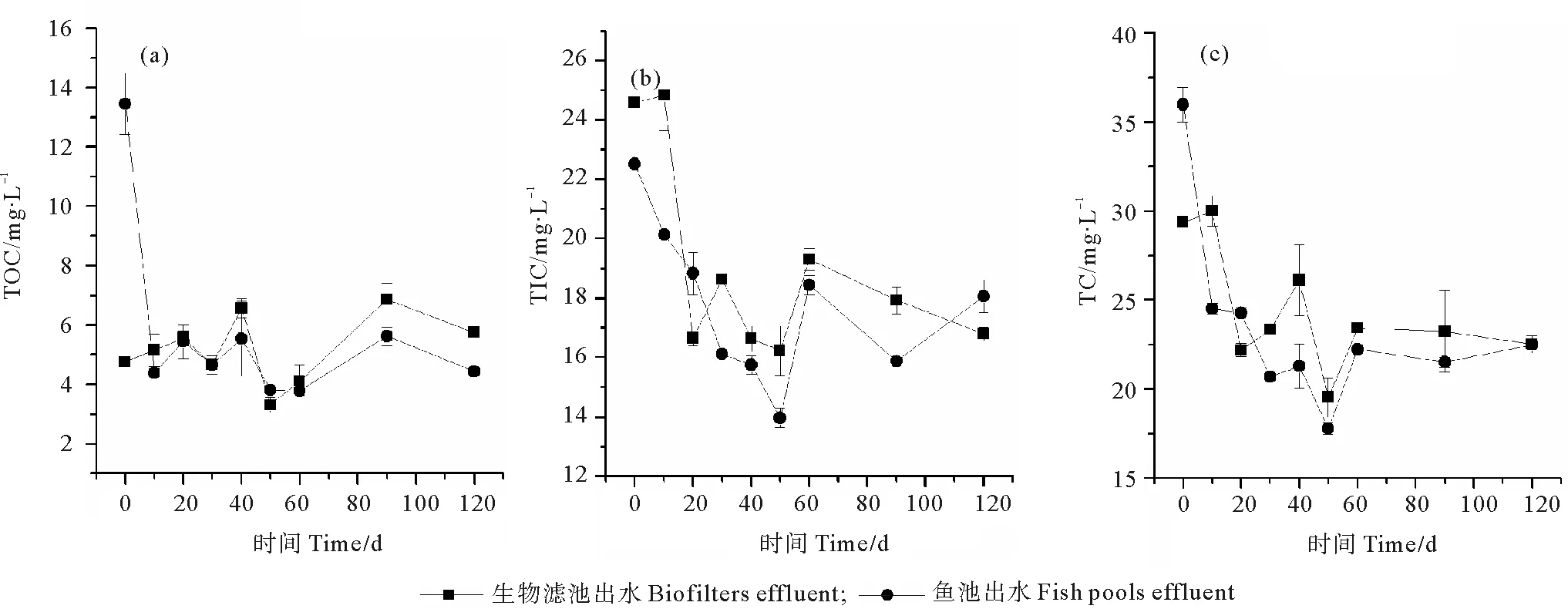
图4 系统内有机碳(a)、无机碳(b)和总碳(c)浓度变化情况Fig. 4 Concentration changes of TOC (a), TIC (b) and TC (c) in the recirculating aquaculture system

图5 不同时期富集菌液对氨氮和亚硝酸氮的降解效果Fig. 5 Degradation effect to ammonia and nitrite among enrichment bacteria of different enriching periods
2.3 低温氮降解细菌的降氮效果测定
实验分离得到14株耐低温的细菌(见表2),其中有4株细菌 (LB1-4、LB3-J、LB3-1和LB2-6) 经过5 d的降解实验,可以将降解液中的氨氮由最初的36 mg/L分别降解至1.3、4.7、4.6和5.1 mg/L,降解率达96.39%、86.94%、87.22%和85.83%;有5株细菌 (LB1-4、LB3-J、LB3-1、LB3-3和LB2-6) 经过5 d的降解实验,可以将降解液中的亚硝酸氮由最初的40 mg/L分别降解至0.22、0.02、0.03、0.03和0.01 mg/L,降解率达99.45%、99.95%、99.93%、99.93%和99.98%。

表2 不同菌株对氨氮和亚硝酸氮的降解效果Table 2 Degradation effect to ammonia and nitrite among different bacteria
注:字体加粗的为氨氮或亚硝酸氮降解效果较好的细菌。
Note: The bold font are the bacteria with better degradation effect of ammonia or nitrite.
2.4 低温氮降解细菌的鉴定
将分离得到的LB1-4、LB3-J、LB3-1和LB2-6这4株细菌的16S rDNA进行PCR扩增后,将所得序列在NCBI数据库进行BLAST比对后,选取相似性达97%以上的细菌构建系统发育树,结果显示(见图6),LB1-4为枯草芽孢杆菌 (Bacillussubtilis),LB3-J为Velezensis芽孢杆菌 (Bacillusvelezensisstrain SQ-5),LB3-1为土芽孢杆菌 (Geobacillussp. strain SA2),LB2-6为短小芽孢杆菌 (Bacilluspumilusstrain AB25A-SW1)。
3 讨论
3.1 通过水质变动探究生物滤器成熟过程
生物滤池是循环水养殖系统中的核心单元,主要功能是通过硝化作用将养殖废水中有毒有害的氨氮和亚硝酸氮转化为低毒害的硝酸氮。在生物滤池成熟过程中,可以根据生物滤料上生物膜的质量以及氨氮的去除效果划分为潜伏期、增长期、稳定期和脱落期[3];也可以根据生物滤料上的细菌数量将其成熟过程划分为适应期、潜伏期、快速增长期和稳定期[11]。但不管以怎样的方式对生物滤池的成熟过程进行界定,生物滤池成熟时最显著的特征为具有稳定的硝化作用,可以达到水质净化效果[3, 11, 17-18]。本研究中,经过40 d的培养后,生物滤池和养殖鱼池出水中的氨氮和亚硝酸氮浓度均基本稳定,因此可以认为本系统经过40 d培养,生物滤池已经达到成熟状态。在此之前,许多研究指出温度对硝化细菌的代谢影响显著,在20 ℃以上水温条件下,生物滤池成熟一般都需要30~40 d[3, 18],在25 ℃的条件下,生物滤池有较好的氨氮去除效率[19]。而本次研究结果表明:在较低的水温条件下 (17~18 ℃),生物滤池40 d左右成熟,并在低温下对氨氮、亚硝酸盐实现有效去除。

图6 4株低温氮降解细菌的系统发育进化树Fig. 6 Phylogenetic trees of 4 bacteria of nitrogen degradation bearing low temperature
生物膜是一个以硝化细菌为主的生物絮团,同时还包括一些藻类、真菌和原生动物[20]。硝化作用主要分为两个步骤,第一步为氨氮氧化为亚硝酸氮,第二步为亚硝酸氮进一步氧化为硝酸氮[6]。其中,第一步主要由氨氧化细菌和氨氧化古生菌完成[21],第二步主要由硝化菌属和硝化螺旋菌属细菌完成。本研究中,2个测试点的氨氮浓度在系统启动后表现为持续下降,而亚硝酸盐浓度则表现为先升后降,硝酸盐浓度持续上升,说明氨氧化细菌和氨氧化古生菌的生长要优于硝化菌属和硝化螺旋菌属细菌的生长,氨氮、亚硝酸盐和硝酸盐的变化规律与许多学者的研究结果相似[18, 22]。硝化作用主要是将高毒害的氨氮氧化为低毒的硝酸氮,而硝酸盐从系统的移除则主要依赖于反硝化反应[23],可以进行反硝化反应的细菌群落主要为厌氧细菌,较高的溶氧条件会阻碍反硝化菌群的附着和繁殖[24],在本实验中硝酸氮浓度和总氮浓度的不断升高,说明在高溶氧的循环水养殖系统中,生物滤器可以实现高毒氨氮向低毒硝酸氮的转变,但却不能实现氮营养盐的移除。
饵料中磷的溶失是水体中磷含量升高的主要原因[25]。水体中磷的去除,通常需要一个厌氧的条件才能实现[26]。聚磷菌虽是好氧细菌,但其释磷功能在厌氧条件下才能充分发挥[27]。而本实验系统溶解氧一直维持在6 mg/L以上,较高的溶氧抑制了聚磷菌释磷功能的发挥,饵料中磷的不断溶失,加之生物膜对磷较低的去除效率,最终导致水体中的活性磷和总磷浓度不断升高,这一现象在其他相关研究中也有发现[25]。
水体中有机碳的浓度可以表征水体中有机物的含量,同时,有机碳源的添加可以改变一些人工基质表面菌群结构的组成,促进异养菌的生长[28]。本研究中,实验初期生物滤池出水中总有机碳的浓度就出现显著下降,说明以有机碳为碳源的异养菌形成;20 d以后2个测试点的无机碳才开始出现显著下降,说明以无机碳为碳源的自养菌形成[29],因此,推测本系统中最早出现并稳定发挥功能的是异养菌群落,而自养菌群落的出现则相对滞后。
3.2 低温氮降解细菌富集后的降氮效果
自然条件下具有氮降解功能的细菌数量非常有限,而可被人工分离得到的细菌数量更是仅占全部细菌的1%,因此要得到具有某种特定功能的细菌,需要先进行选择富集,使具有该功能细菌的数量增长到足够多时,才有可能将该功能细菌分离出来。当前,针对氮降解细菌的富集,主要通过提供不同的氮源来实现对不同功能氮降解细菌的富集,其中,有的以氨氮为氮源富集可以降解氨氮的亚硝化细菌,有以亚硝酸氮为氮源富集可以降解亚硝酸氮的硝化细菌[30-31],也有的以添加氨氮为氮源进行硝化细菌的富集[32]。在富集周期上,从7~20天不等,由于硝化细菌生长较慢,所以需要富集几个周期才可以完成[12-13]。在本研究中,通过对比几个周期富集菌液的降氮效果,发现对降氮细菌进行周期式的富集会提高富集和降氮效果,但由于生活环境的限制,富集到一定周期后降氮细菌数量会达到顶峰,即使增加富集周期也不会提高富集效果。其中,富集培养基以添加亚硝酸氮为氮源时,富集到的菌液的降氮效果较好。
3.3 低温氮降解细菌的分离和鉴定
循环水养殖系统中的生物滤料需要形成成熟的生物膜后才能稳定发挥净水功能。生物滤料挂膜过程中,可通过添加微生态制剂辅助进行挂膜[17],或接种加入功能稳定的生物滤料以帮助系统加速建立硝化作用[33],但实际生产中还需要避免引入外来病原微生物,因此最稳妥的方法是对循环水养殖系统生物滤料上自身附着的土著菌进行培养[34],后期添加至生物滤料上以帮助稳定水处理效果。本实验通过对前期富集得到的混合菌液进行分离、纯化后,最终得到4株对氨氮和亚硝酸氮降解效果好的菌株,这4株细菌对氨氮的降解率可达85%以上,对亚硝酸氮达99%以上,可用于后期添加至生物滤料上,既可以降低引入外来病原微生物的风险,还以帮助提高生物滤料的水处理效率。
4 结语
本研究通过对新建成的商业规模的冷水鱼循环水养殖系统的生物滤池的成熟过程进行研究,发现即使在17~18 ℃的低水温条件下 ,生物滤池经过40 d的培养也可以完成成熟过程。受较高溶氧条件的限制,成熟后的生物滤池只能将养殖水中高毒害的氨氮和亚硝酸氮转化为低毒害的硝酸氮,而无法通过反硝化作用,将氮和磷从系统中移除。同时,根据水体中有机碳和无机碳的变化,推测生物滤料上自养菌群的产生滞后于异养菌群。采集成熟生物滤料上的生物膜进行富集培养后,发现在15 ℃,160 r/min的条件下,通过添加以亚硝酸氮为氮源的富集培养基,以7 d为1个周期,富集6个周期可以得到降氮效果最好的富集菌液。对富集得到的菌液进行分离、纯化和鉴定后,共得到4株可在低温条件下有效降解氨氮和亚硝酸氮的细菌,分别为枯草芽孢杆菌 (Bacillussubtilis)、Velezensis芽孢杆菌 (Bacillusvelezensisstrain SQ-5)、土芽孢杆菌 (Geobacillussp. strain SA2)和短小芽孢杆菌 (Bacilluspumilusstrain AB25A-SW1)。
