ARTP诱变联合抗生素抗性选育纳豆激酶高产菌株
2019-02-20薛莹莹林福兴别小妹吕凤霞赵海珍陆兆新
薛莹莹,林福兴,别小妹,吕凤霞,赵海珍,陆兆新
(南京农业大学食品科技学院,江苏南京 210095)
纳豆激酶来自于日本传统食品纳豆,是一种丝氨酸蛋白酶,属于枯草杆菌蛋白酶家族[1]。纳豆激酶具有很强的抗血栓和溶解血栓的功能,对心血管系统具有多种有益作用,且安全无毒副作用[2],临床用药应用前景广阔。纳豆激酶主要通过纳豆枯草芽孢杆菌的发酵获得,菌株的产酶性能对酶的生产应用有着很大的影响。为开发可工业化生产、成本低廉的纳豆激酶产品,需要进一步提高生产菌的产酶能力。
诱变育种因其简单、快速、有效等优点,被广泛使用于发酵工业菌种的选育[3]。如李淑英等[4]采用60Co-γ射线辐照诱变获得了纳豆激酶高产突变菌株;薛健等[5]采用紫外诱变选育纳豆激酶高产菌株,产酶活力较出发菌株提高了6.78%。近年来,常压室温等离子体诱变系统(atmospheric pressure room temperature plasma mutagenesis system,ARTP)技术在诱变育种中得到了广泛的应用[6],与其它传统诱变技术相比,ARTP诱变育种技术安全性高、突变率高、条件可控性强,可以大幅提高菌株的突变强度和突变库容量[7]。如田成福等[8]通过ARTP诱变选育出高酶活突变菌株,提高了生产海藻糖的能力。抗生素抗性筛选方法是从微生物对抗生素的耐药性中发展起来的菌种选育技术,微生物产生的某些抗性突变会直接影响其次生代谢产物的调控,从而改变其代谢产物的生产能力和产量水平[9]。同时抗生素抗性筛选方法作为一种选择性标记的筛选方法,可以淘汰掉大量非突变菌株,减小筛菌的盲目性。如关志炜等[10]通过筛选抗高浓度利福平的菌株来筛选更多的基因突变菌株。田萍萍等[11]将ARTP诱变技术与抗生素抗性筛选相结合,获得一株阿维菌素高产突变菌株,其阿维菌素产量比诱变前提高了23.4%。而利用ARTP技术联合抗生素抗性选育纳豆激酶高产菌株的育种工作尚未见报道。
本实验室保藏的一株产纳豆激酶的枯草芽孢杆菌(Bacillussubtilis)XZI125,其产酶能力还未达到用于工业发酵生产菌株的要求,需要进一步提高菌株的产酶性能,本文通过对其进行ARTP诱变,采用酪蛋白平板和利福平、卡那霉素、链霉素、氯霉素抗性筛选,选育纳豆激酶高产突变菌株,以期为纳豆激酶的工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌(Bacillussubtilis)XZI125 由南京农业大学酶工程实验室保藏;安佳脱脂乳粉 新西兰;牛血纤维蛋白原、尿激酶和凝血酶 中国药品生物制品检定所;琼脂糖 阿拉丁试剂有限(中国)公司;利福平、卡那霉素、链霉素和氯霉素 美国Sigma公司;其它试剂 均为分析纯。
SW-CJ-IBU超净台 苏净集团安泰公司;高压蒸汽灭菌锅 日本TOMY公司;HYG-C型恒温摇床 太仓实验设备厂;DRP-9162型电热恒温培养箱 上海森信实验仪器有限公司;Orion 3 STAR pH计 美国Thermo公司;AY120型电子天平 日本岛津公司;WH-3微型漩涡混匀仪 上海沪西分析仪器厂;WFJ 7200型可见分光光度计 尤尼柯上海仪器公司;游标卡尺 上海恒量量具有限公司;Anker DL-5-B型离心机 上海安亭科学仪器厂;IIS型常压室温等离子体微生物诱变系统(ARTP) 无锡源清天木生物科技有限公司。
1.2 实验方法
1.2.1 培养基的配制 斜面与固体培养基:牛肉膏0.3%,氯化钠0.5%,蛋白胨1.0%,琼脂 2.0%,pH7.2,121 ℃灭菌20 min。
液体种子培养基:牛肉膏0.3%,葡萄糖0.5%,氯化钠0.5%,蛋白胨1%,pH7.2,121 ℃灭菌20 min。
液体发酵培养基:麦芽糖1%,麸皮1%,胰蛋白胨0.5%,豆粕粉1.5%,酵母膏0.1%,MgSO40.05%,K2HPO40.25%,KH2PO40.1%,吐温40 0.15%,pH7.2,121 ℃灭菌20 min,装液量 50 mL/250 mL。
酪蛋白平板培养基:脱脂奶粉5%,琼脂1.5%,115 ℃灭菌15 min。
1.2.2 纳豆激酶活力的测定
1.2.2.1 尿激酶标准曲线的测定 采用琼脂糖-纤维蛋白平板法测定[12]。将8 mL 0.7%的琼脂糖溶液加热溶化至透明状态,60 ℃恒温水浴保温20 min,按0.8 mg/mL的量将纤维蛋白原溶于蒸馏水中,放入50 ℃恒温水浴锅中保温15 min,将琼脂糖和纤维蛋白原溶液快速混匀,同时加入50 μL 200 IU/mL的凝血酶,充分混匀后倒入直径为9 cm的圆形培养皿中,待凝胶体系完全凝固后,打孔备用。
将尿激酶标准品稀释为50、100、200、400、600、800 IU/mL 6个浓度梯度的标准样品,取各个浓度标样10 μL加入到琼脂糖-纤维蛋白平板的加样孔中,37 ℃正置培养18 h,用游标卡尺测量纤维蛋白溶解圈的横直径和竖直径,算出各个标样浓度下溶解圈的直径积,然后以尿激酶标准液溶解圈直径积为横坐标,尿激酶标准液酶活的对数值为纵坐标,绘制尿激酶的标准曲线。
1.2.2.2 发酵液中纳豆激酶活力的测定 发酵液经5000 r/min离心20 min后,作适当倍数稀释,使得酶活测量值在标准品浓度范围内,按1.2.2.1的方法测定发酵上清液的酶活,活性单位以尿激酶的活性单位 IU/mL表示。
1.2.3 菌悬液的制备 将出发菌株从斜面上取一环接种到装有50 mL液体种子培养基的250 mL锥形瓶,放置于37 ℃恒温摇床中,180 r/min培养7~9 h至该菌株的对数期,此时是芽孢杆菌产胞外酶最旺盛的时期[13],用可见分光光度计在600 nm波长下检测菌液OD600值在0.9~1.1之间,此时菌液浓度为107~108CFU/mL,菌液于4500 r/min下离心5 min,用无菌生理盐水洗涤菌体沉淀两遍,最后用无菌生理盐水重悬菌体,作为待诱变处理的菌悬液。
1.2.4 ARTP诱变 将ARTP育种仪自带的金属载片移至超净台中,用镊子将其放在酒精灯火焰上灼烧灭菌,然后放入灭菌过的平板中,取10 μL含5%甘油的菌悬液,均匀涂于金属载片上,盖上平板盖,将平板移至ARTP诱变系统操作仓,按照ARTP生物育种仪的操作流程,以高纯氦气为气源,设定功率为100 W,气流量10 SLM,载片与气流端口距离为2 mm,设置处理时间0、15、30、45、60、90、120、160 s;待诱变完成后,立即用无菌生理盐水洗脱附着在载片上的菌体,形成新的菌悬液,振荡均匀,并作适当稀释涂布于酪蛋白初筛平板上,每个处理时间做3次重复,37 ℃倒置培养24 h,观察菌落生长情况,进行平板菌落计数,按下式计算出菌株致死率和正突变率,在正突变率计算中,考虑系统误差存在的情况下,挑选出的突变株初次摇瓶发酵验证得到的酶活值高于对照组10%,即视为正突变菌株。
致死率(%)=(对照组菌落总数-诱变处理组菌落总数)/对照组菌落总数
正突变率(%)=正突变株的菌落数/处理后长出的菌落总数
1.2.5 抗生素最小抑菌浓度(MIC)的测定 将出发菌株 XZI125 的菌悬液经适度稀释,取0.1 mL分别涂布在含有利福平(0.3、0.4、0.5、0.6、0.7、0.8 μg/mL)、卡那霉素(10、20、30、40、50、60 μg/mL)、链霉素(20、30、40、50、60、70 μg/mL)、氯霉素(100、150、200、250、300、350 μg/mL)的固体平板上,37 ℃倒置培养24 h,以不含抗生素的平板上菌体的生长状况为对照,观察并记录未长出菌落的各个抗生素的最低浓度,即为该抗生素的MIC,然后按其各自的MIC作为添加水平制作这四种抗生素抗性筛选平板。
1.2.6 高产突变株的筛选 将经过ARTP诱变后的菌悬液经过适当稀释后涂布于酪蛋白平板上,37 ℃倒置培养24 h,挑取酪蛋白平板上蛋白溶解圈直径与菌落直径比较大的单菌落;并将不经稀释的菌悬液分别涂布在含利福平、卡那霉素、链霉素、氯霉素的四种抗性平板上,37 ℃倒置培养24 h,观察菌落生长情况,挑选出平板上单菌落大、形态规则、生长状况良好的单菌落,将所有挑选出的疑似高产突变株进行摇瓶发酵验证:将该菌株处于对数期的种子液按2%的接种量接种于盛有50 mL发酵培养基的250 mL锥形瓶中,在37 ℃恒温摇床中180 r/min 摇瓶发酵5 d,发酵液按1.2.2所述方法测酶活值。
1.2.7 高产突变株遗传稳定性的测定 将筛选出的高产突变菌株以试管斜面形式在4 ℃冰箱保藏,传代活化时,从冰箱的斜面直接挑取一环,划线在新鲜的斜面上,然后将斜面在37 ℃培养箱中培养24 h,共转接传代30次,每隔5代进行摇瓶发酵,测定其产纳豆激酶的活力。
1.3 数据处理
采用SPSS 20.0和Origin 9.0统计学软件进行实验数据的显著性分析和回归性分析,纳豆激酶酶活值以平均值±标准偏差(AVE±SD)表示。
2 结果与分析
2.1 尿激酶标准曲线
以标准尿激酶为标准品作标准曲线,根据纤维蛋白平板法测得的溶解圈的直径积来表示纳豆激酶的活性,这种测酶活的方法因简便、有效而常用[14]。本研究以尿激酶标品溶解圈的直径积为横坐标,尿激酶标品的酶活的对数值为纵坐标,得到尿激酶酶活值的标准曲线。由图1可知,在0~1000 IU范围内,标准酶活的对数值与溶解圈的直径积之间呈线性关系,回归分析得出的回归方程为y=1.5454x+0.1976,决定系数为0.9945。
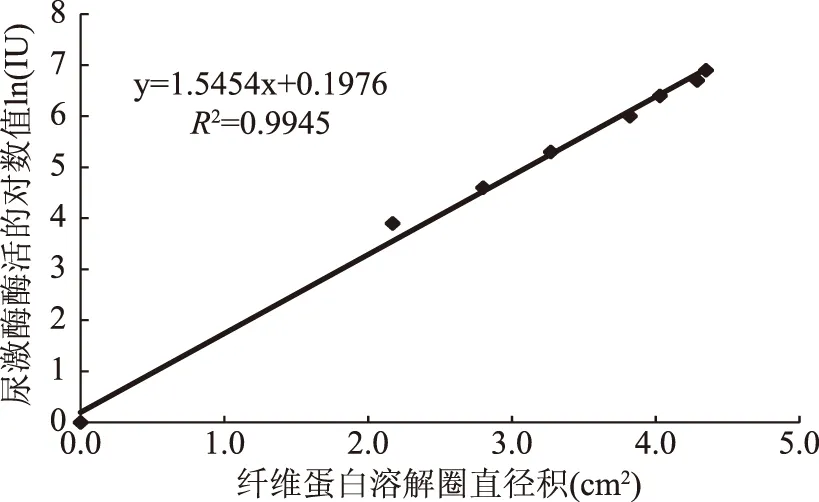
图1 尿激酶标准曲线Fig.1 Standard curve of urokinase
2.2 ARTP诱变结果
2.2.1 ARTP处理时间的确定 用0~200 s不同时间剂量对出发菌株BacillussubtilisXZI125进行ARTP诱变,结果如图2所示。
从图2可以看出,菌株的致死率随处理时间的延长而提高,而正突变率呈现先升高后降低的趋势。由于等离子体可以产生活性粒子破坏细胞结构[15],长时间处理使得等离子体穿透细菌细胞壁,破坏基因、蛋白等,使得大部分微生物死亡,而少数通过自身的自动修复系统得以存活,并在此过程中发生基因突变[7],因此过长的处理时间对菌体有明显的致死效果,且伴随较高的负突变率,不利于选种。当处理时间达到200 s时,致死率达到最大为99%,此时正突变率偏低为4.7%;当诱变处理时间为90 s时,其致死率为83%,达到最高正突变率为8%,正突变率高则有利于菌种的筛选,故选择90 s作为诱变处理时间。
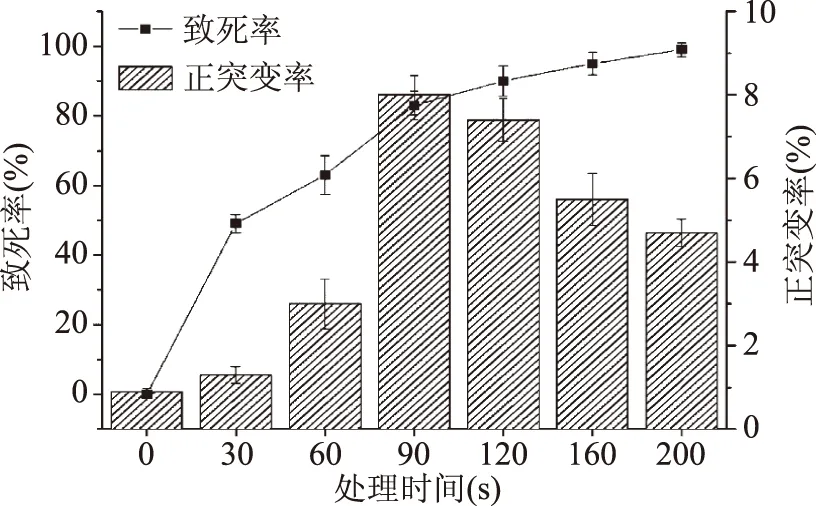
图2 枯草芽孢杆菌XZI125的ARTP诱变致死率及正突变率Fig.2 The fatality rate and positive mutation rate ofBacillus subtilis XZI125 treated by ARTP
2.2.2 抗生素抗性筛选浓度的确定
2.2.2.1 利福平的MIC 利福平的抗菌机制主要通过抑制细菌依赖于DNA的RNA聚合酶,阻碍 mRNA合成,从而阻断RNA的转录,使DNA和蛋白质的合成终止[16],因此可以通过筛选抗更高浓度利福平的菌株获得RNA聚合酶突变株,以提高转录水平,增加酶产量。

表1 利福平对枯草芽孢杆菌XZI125生长的影响Table 1 Effect of rifampicin on the growth of Bacillus subtilis XZI125
如表1所示,枯草芽孢杆菌XZI125在添加利福平的平板培养基中,随着利福平浓度的增加,单菌落数目减少,添加浓度为0.7 μg/mL时,无菌落生长,此浓度即为利福平对出发菌株的MIC。
2.2.2.2 卡那霉素的MIC 卡那霉素通过与细菌的核糖体30S亚基结合,影响蛋白质合成的多个环节[16],枯草芽孢杆菌XZI125在添加卡那霉素的平板培养基上的生长情况如表2所示,添加浓度为50 μg/mL时,无菌落生长,此浓度即为卡那霉素对出发菌株的MIC。

表2 卡那霉素对枯草芽孢杆菌XZI125生长的影响Table 2 Effect of kanamycin on the growth of Bacillus subtilis XZI125
2.2.2.3 链霉素的MIC 链霉素抗性筛选具有正突变率高、增产百分率高等特点[9]。链霉素对枯草芽孢杆XZI12生长的抑制作用如表3所示,在添加浓度为60 μg/mL时,无菌落生长,此浓度即为链霉素对出发菌株的MIC。

表3 链霉素对枯草芽孢杆菌XZI125生长的影响Table 3 Effect of streptomycin on the growth of Bacillus subtilis XZI125
2.2.2.4 氯霉素的MIC 氯霉素通过与细菌的核糖体50S亚基结合,阻碍转肽酰酶的作用,从而使新肽链的形成受阻,抑制蛋白质合成[16]。氯霉素对枯草芽孢杆XZI125生长的抑制作用如表4所示,在添加浓度为300 μg/mL时,无菌落生长,此浓度即为氯霉素对出发菌株的MIC。

表4 氯霉素对枯草芽孢杆菌XZI125生长的影响Table 4 Effect of chloramphenicol on the growth of Bacillus subtilis XZI125
2.2.3 高产突变株筛选结果 菌株XZI125经ARTP诱变后,在酪蛋白初筛平板上共得到276株透明圈清晰的菌株。挑取其中38株蛋白溶解圈直径与菌落直径比较大的单菌落进行摇瓶发酵验证,得到3株高产菌,正突变率为7.9%。其中1株高产突变株A27,测得其摇瓶发酵液酶活值为3068 IU/mL,比原始菌株酶活力(2490 IU/mL)提高了23.2%。
将诱变后的菌悬液涂于四种抗生素抗性平板上,共计挑选了59株ARTP诱变结合抗生素抗性的菌,其中有14株正突变菌,正突变率达到23.7%,其中一株最高产菌Ar 41比原始菌的产酶能力提高了26.6%。相比于经ARTP诱变后通过酪蛋白平板法初筛挑取的菌株,用抗生素抗性平板筛选的方法,正突变率更高。且结果显示,一共得到的17株高产突变菌中,只有17.6%来源于酪蛋白平板的挑选,82.4%的高产突变株来源于ARTP诱变结合抗生素抗性平板的筛选。表5列出了酶活提高20%以上的7株高产突变菌株,其中2株来自酪蛋白平板的筛选,5株来自抗性平板的筛选。
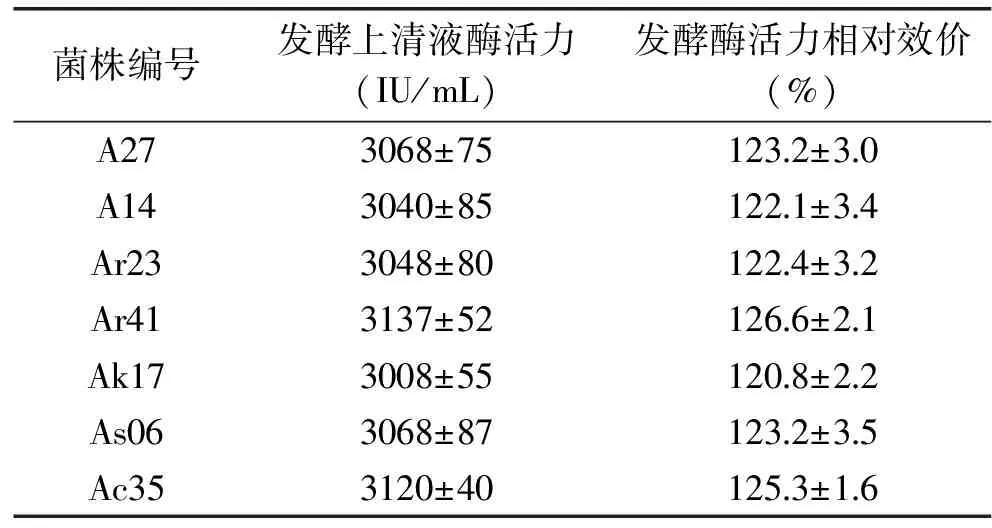
表5 高产纳豆激酶突变菌株的产量Table 5 Production of high-yield nattokinase strains
在14株从抗生素抗性平板上挑选的高产菌株中,其中最高产菌株Ar 41的筛选来自于利福平抗性平板,在卡那霉素抗性平板上只筛选到1株高产菌株。诱变处理后的菌悬液在抗性平板上大都呈稀密度菌落分布状态,且菌落一般比较小,形态较不规则,筛选时选择菌落较大、形态规则、生长状况良好的菌株,缩小了筛选的选择范围。分析在抗性平板上筛选到的高产菌株可能是因为ARTP诱变过程使菌株发生产酶性能提高的正突变,同时菌株的突变可能导致对某些抗生素的抗性提高;或是因为抗生素抗性的引入导致了菌株产酶能力增强,如Kurosawa等[17]通过引入链霉素抗性突变得到了高产α-淀粉酶和蛋白酶的枯草芽孢杆菌突变株。
2.2.4 高产突变株的遗传稳定性 突变菌株在传代过程中可能出现表型延滞现象,会导致筛选到的高产菌株转接多次后发酵产能下降,故需要对突变菌株的遗传稳定性进行验证试验。Ma等[18]对经ARTP诱变后的枯草芽孢杆菌突变体WB600 mut-12#进行了多次传代培养,其表现出良好的遗传稳定性。本研究对筛选到的NK高产突变菌进行30代遗传稳定性验证实验,通过6轮复筛验证,得到3株遗传稳定的突变菌A27、Ar41和Ac35,其发酵酶活力相对效价分别为123.0%、125.1%、126.5%,相对于原始菌株酶活力分别提高23.0%、25.1%、26.5%。从图3中可以看出这三株菌有相对稳定的遗传特性,故可作为后续试验的出发菌株。
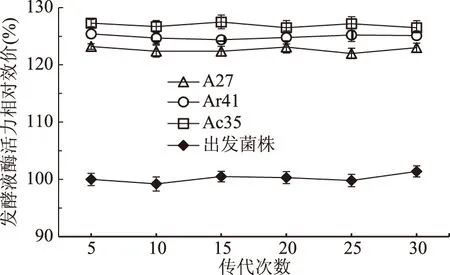
图3 出发菌株、A27、Ar41和Ac35每代摇瓶发酵酶活力相对效价Fig.3 The relative potency of enzyme activity of every generation by initial strain,A27,Ar41 and Ac35
3 结论
本研究对原始菌株BacillussubtilisXZI125采用ARTP诱变的方式结合抗生素抗性筛选,筛选出3株稳定高产菌株,分别是A27、结合了利福平抗性的Ar41和结合了氯霉素抗性的Ac35,经过30次传代培养后,相对于原始菌株酶活力分别提高了23.0%、25.1%、26.5%。比较酪蛋白平板筛选方法和0.7 μg/mL利福平、50 μg/mL卡那霉素、60 μg/mL链霉素、300 μg/mL氯霉素四种抗性筛选方法,结果显示抗生素抗性筛选方法更有利于NK高产菌株的筛选。在用抗生素抗性筛选方法的过程中,可能由于诱变的随机性,并未发现经ARTP诱变后的高产菌株和其对这四种抗生素产生抗性之间存在何种相关性。今后的研究中,可进一步研究更有效、更好的筛选方法,也可对突变菌的代谢特性作深入研究,探索高产突变株的最佳培养条件,进一步提高其产酶量,为促进纳豆激酶作为溶栓剂的开发和应用提供技术支持。
