海藻酸钠薰衣草精油微胶囊的制备及其性能研究
2019-02-20,*
,*
(1.石河子大学药学院,新疆石河子 832000; 2.华北制药集团新药研究开发有限责任公司,河北石家庄 050015)
薰衣草(LavandulaangustifoliaMill.)系唇形科(Labiatae)薰衣草属(LavandulaLinn.)植物,多年生草本或半灌木,素有“芳香药草之后”的美誉,其在我国新疆伊犁地区种植面积达数万亩。新疆伊犁地区的精油产量占全国的95%。薰衣草主要使用价值在其精油部分(含有芳樟醇、乙酸芳樟酯等)。薰衣草精油的药用历史悠久,作为抗失眠药物被应用,但其在常温下有极强的挥发性,对空气、日光、湿气(水分)及温度等均较敏感;在贮存或应用中遇光和热不稳定,极易发生分解或氧化而导致香气变劣[1-2]。将薰衣草精油微胶囊化是解决这些问题的一种常规手段,可以通过制备得到薰衣草精油微胶囊起到提高精油的稳定性并能很好地防止外部环境的作用,解决其贮藏、留香时间等诸多问题,同时可以拓宽薰衣草精油的应用领域[3-6]。
海藻酸钠作为一种优良的天然高分子材料,具有药物制剂辅料所需的稳定性、水溶性、粘性和安全性,属于聚阴离子电解质,其分子链上有大量的羧基。因此可利用海藻酸钠的聚阴离子电解质特性,在海藻酸钠溶液滴入多价阳离子溶液(如Ca2+等),当聚阴离子的海藻酸钠与金属阳离子相遇时,会产生瞬时凝胶,形成一层凝胶膜将乳液剂包覆在其中,所制备的微胶囊稳定性高且复杂的界面膜结构有更好的控释特性[7-8]。但是,直接将海藻酸钠微乳滴入Ca2+制备的微胶囊,其大小会受注射器针头大小、滴入高度等的限制,且所制备的微胶囊粒径较大[9-12]。因此为了改善制备过程中存在的缺点,希望能找到一种新的微胶囊制备方法,可以制备出膜厚度可控的微胶囊。
反向凝胶技术是近年来提出的一种新的精油包合方法。首先,在高速剪切力的作用下,在薰衣草精油中加入CaCl2溶液,将其制备成为W/O型乳液。其次,将乳液分散至海藻酸钠池中,乳液中的Ca2+会在磁力搅拌的作用下从乳液中释放出来与池中的海藻酸钠相遇,在乳液表面形成一层不规则且很薄的膜。再次,由于在实验过程中发现乳液中的Ca2+释放速度较为缓慢,所形成的膜非常薄且易破裂。因此为了改善其膜厚度较小、易破裂等缺点,向加有乳液的海藻酸钠池中加入乙醇、吐温20,使乳化剂中更多的Ca2+从乳液中渗出,并与海藻酸钠溶液相遇,在薰衣草精油乳滴外形成一层较厚的凝胶膜,将薰衣草精油包覆其中制成海藻酸钠薰衣草精油微胶囊[13-15]。这种方法具有安全环保、工艺简单等优点,具有广阔的应用前景。
目前对薰衣草精油的包合研究工作主要是集中在纳米乳液、纳米胶囊、纳米/微米粒、微胶囊等,而主要用途集中在化妆品、药品、食品等领域。一个良好的食品包封递送系统不仅需要具备防止降解提高稳定性的特性,还需要具备与其他食品系统兼容以及在口腔等特定环境下使用特定的触发系统让其达到控时控释的效果[16-20]。因此,构建挥发油缓控释系统,探索挥发油的控时控释技术,让其在特定的应用环境条件下控时控释释放,是一个值得研究和探讨的课题。为了提高薰衣草精油的稳定性并且能使精油能控时控释释放,本研究采用反向凝胶技术制备了海藻酸钠薰衣草精油微胶囊,以期通过加入去稳定剂来调节微胶囊的膜厚度达到控释的目的。
1 材料与方法
1.1 材料与仪器
薰衣草精油 伊犁兄弟有限公司;海藻酸钠 天津市福晨化学试剂厂;无水氯化钙(粒) 分析纯,天津市盛奥化学试剂有限公司;Span 85 天津市盛奥化学试剂有限公司;无水乙醇 分析纯,天津永晟精细化工有限公司;吐温20 天津市盛奥化学试剂有限公司。
DDS-307电导仪 上海精科;ZNCL磁力搅拌器 巩义市予华仪器有限责任公司;KQ-500DE超声分散 昆山市超声仪器有限公司;AR1140电子分析天平 上海奥豪斯国际贸易有限公司;DHG-9240电热恒温鼓风干燥箱 上海齐欣科学仪器公司;SHB-循环水式多用真空泵 郑州长城科工贸有限公司;FA-25高速剪切分散乳化机 上海弗鲁克流体机械制造有限公司;TGL-16G台式离心机 上海安亭科学仪器厂制造;OLYMPUS CX21数码生物显微镜、Agilent 6890N气相色谱仪 安捷伦科技有限公司。
1.2 溶液的配制
海藻酸钠溶液的配制,准确称取10 g的海藻酸钠,并将其溶于1 L的双蒸水中,在500 r·min-1条件下搅拌6 h,将其放入4 ℃冰箱静置24 h备用。
CaCl2溶液的配制:准确称取20、30、40 g的CaCl2·2H2O,并将其溶于500 mL的双蒸水中备用。
破囊液的配制:称取一定量的NaHCO3和柠檬酸三钠,溶于超纯水,分别配制0.2 mol/L NaHCO3和0.06 mol/L柠檬酸三钠溶液,调节pH=8。
1.3 乳化剂的制备及表征
1.3.1 乳液的制备 向10 mL精油中加入分别加入0.001、0.01、0.1 g的Span 85,在13500 r·min-1条件下搅拌1 min,然后再向其中分别加入3 mL CaCl2溶液(60 g/L),在13500 r·min-1条件下搅拌2 min,即得油包水型乳液。
1.3.2 乳液的表征
1.3.2.1 稳定性 在室温(25±2) ℃条件下,将制备完成的乳液置于100 mL试管中,观察并记录乳液发生相分离的时间,即油相从水相中分离1 mL所需要的时间。
1.3.2.2 液滴粒径 W/O型乳化剂的粒径用电子显微镜来测定,将制备好的乳化剂置于载玻片上,并放在数码生物显微镜下观察乳液液滴形态并用Image J 1.47V软件来记录乳液粒径大小,每个样本至少测量三个不同区域,平行测量三组。
1.3.2.3 导电性 在((25±2) ℃)常温下,用电导仪测定乳剂的导电性,每份样品重复测定三次,取平均值进行导电性分析[21]。
1.4 微胶囊的制备及影响因素考察
1.4.1 微胶囊的制备方法 首先,将20 mL海藻酸钠溶液置于100 mL的烧杯中,用5 cm长的搅拌子在转速400 r·min-1条件下搅拌2 min。其次,在转速为700 r/min条件下,边搅拌边加入1 mL的乳液至海藻酸钠池中。再次,在海藻酸钠池中加入去稳定剂继续搅拌1~15 min(固化时间,其被定义为在加入去稳定剂之后,乳化剂接触海藻酸钠的时间)对微胶囊进行固化。最后用双蒸水洗涤2~3去除多余的海藻酸钠,然后将制备好的湿微胶囊置于15 g/L的CaCl2溶液中储存待用(图1)[22]。

图1 微胶囊制备示意图Fig.1 Schematic representation of the formation of microcapsules
1.4.2 去稳定剂的选择 分别按各个组别的设置在海藻酸钠池中加入去稳定剂。空白组:不加去稳定剂;乙醇组:加入20 mL乙醇(10% v/v);吐温20组:加入2 mL(1% v/v)的吐温20;乙醇+吐温20组:先加入2 mL(1% v/v)的吐温20,然后在350 r·min-1条件下搅拌10 s后再加入20 mL乙醇(10% v/v)。通过膜厚度及Ca2+释放来选择最优去稳定剂。
1.4.3 薰衣草精油微胶囊成囊参数的确定
1.4.3.1 海藻酸钠浓度对成囊质量的影响 固定CaCl2浓度为60 g/L,Span85的浓度为1%,去稳定剂为2 mL(1%)Tween20和20 mL(10%)的乙醇,固化时间为3 min,选择海藻酸钠的质量浓度为0.5%、1%、1.5%,按“1.4.1”项下制备海藻酸钠/Ca2+微胶囊,并观察其形态。
1.4.3.2 CaCl2浓度对微胶囊质量的影响 固定海藻酸钠浓度为1%,Span85的浓度为0.1%,去稳定剂为2 mL(1%)Tween20和20 mL的乙醇(10%),固化时间为3 min,选择CaCl2浓度40、60、80 g/L,按“1.4.1”项下制备海藻酸钠/Ca2+微胶囊,并观察其形态。
1.4.3.3 固化时间对微胶囊质量及膜厚度的影响 固定海藻酸钠浓度为1%,Span 85的浓度为0.1%,去稳定剂为2 mL(1%)Tween20和20 mL的乙醇(10%),选择CaCl2浓度60 g/L,固化时间为1、3、5、10、15 和20 min,按“1.4.1”项下制备海藻酸钠/Ca2+微胶囊,并观察其形态。
1.4.4 指标测定方法
1.4.4.1 膜厚度的测定 用光学显微镜对微胶囊的成像情况及微观结构进行分析,采用ImageJ 1.57 V对膜厚度进行测定,每个样品选用100个微胶囊进行分析测定结果取平均值,每组重复三次。
1.4.4.2 Ca2+释放量计算 加入去稳定剂后,Ca2+会从油芯中扩散到海藻酸钠溶液中,前期试验结果显示加入不同去稳定剂后,膜厚度有一定的差异,因此猜测可能是不同去稳定剂加入导致CaCl2液滴都从乳液液滴中渗出至海藻酸钠溶液的量不同导致了微胶囊膜厚度和体积的差异。
因此,在显微图像下选择了不同粒径大小的微胶囊,参照相关文献中CaCl2的渗出量的计算方法,计算了不同壳体积微胶囊中CaCl2的渗出量,进一步评价去稳定剂对膜厚度的影响,参照文献中的计算方法计算微胶囊中Ca2+从微乳中的释放百分含量,由公式(1)(2)(3)计算[23]。
式(1)
式中:NCa,core代表微囊壳中Ca2+(mol)的物质的量;[Cacore]代表油壳中Ca2+(mol/L)的浓度;dcore代表油壳的直径。
式(2)
式中,[Ca]m表示膜中Ca2+(mol/L)的浓度;dcap表示微胶囊的直径。
式(3)
式中,ψ代表从油壳中释放出的Ca2+的量。
1.4.4.3 微胶囊的形貌观察 将制备好的微胶囊用超纯水进行超声分散,取一滴滴于载玻片上置于电子显微镜下观测微粒的分布、形貌特征,取若干区域进行显微镜拍照,利用Image J 1.47V软件分析各种不同实验参数所得产品的粒径大小,并对微胶囊圆整度、黏连程度等形貌特征进行分析[22]。
1.5 微胶囊性能的表征
将制备好的微胶囊冷冻干燥,并准确称冷冻干燥后的微胶囊0.5 g,溶于5 mL的甲醇和20 mL的破囊液中,在常温下搅拌6 h,将产物在6000 r·min-1离心15 min,取5 μL上清液进行载药量、包封率、粒径、膜厚度的检测[24]。
微胶囊载药量(%)和包封率(%)的计算公式为:
载药量(%)=微胶囊内的药物质量(g)/微胶囊总质量(g)×100
包封率(%)=微胶囊内的药物质量(g)/投药量(g)×100
1.6 体外释放
1.6.1 膜厚度对薰衣草精油体外释放的影响 在制备的过程中加入不同的去稳定剂可导致不同膜厚度的形成。采用1.4.3中得出的适宜的实验参数,按照1.4.1中的方法制备微胶囊,固定释放介质的pH=7,研究在海藻酸钠池中分别加入乙醇及吐温20对薰衣草精油体外释放的影响[25]。
1.6.2 释放介质pH对薰衣草精油体外释放的影响 考察了海藻酸钠-薰衣草微胶囊在不同pH条件下的释放情况,选用乙醇和吐温20组为去稳定剂,采用1.4.3中得出的适宜的实验参数,按照1.4.1中的方法制备微胶囊,在释放介质pH分别为1.2、2.6、4.0、5.4、6.8、7.4时进行薰衣草精油体外释放研究。
1.6.3 微胶囊体外累计释放率的测定 准确称取10 mg微胶囊,溶于50 mL释放介质(pH缓冲液∶乙醇=4∶1 (v/v))混合溶液中,于37 ℃磁力搅拌40 h。期间每间隔一定时间,取出5 mL样品,并用新鲜的释放介质补充至同等体积。将取出的样品于6000 r·min-1离心10 min,取上清液在245 nm波长处用紫外分光光度计测定峰面积并计算薰衣草精油浓度,并求出0~40 h的累积释放率[26-29]。
式中:Q为累计释放率;CN为不同时刻测得的薰衣草精油浓度;V为释放介质的总体积(50 mL);VS为每次取样的体积(5 mL);W为实际薰衣草精油总量(即投药量和包封率的乘积)。
1.7 数据处理
所有实验数据取3次重复实验的平均值。采用Origin 8作图,SPSS Statistics 17.0、Design Expert 7.0.0软件进行数据处理与分析。
2 结果与分析
2.1 加入不同浓度Span 85后的W/O乳化剂的表征
乳液表征结果见表1,由表1可知,加入不同浓度Span 85制备的三组乳液均没有导电性。说明CaCl2液滴可能全部被薰衣草精油包裹形成了W/O型乳化剂。当乳化剂的含量升高时,所形成的液滴粒径变小,乳液更加稳定。乳液稳定性更高的原因可能是,Span85浓度越高,乳液中从油壳中渗出的Ca2+会越少。当Span85浓度较低时,所制得的微乳结构不规整,有部分椭圆形。可能是由于低的Span85含量导致所形成的双电层比较薄,在搅拌条件下易于破裂,致使油壳中大量Ca2+渗出,导致所形成的微乳形状不好。因此最终选用Span85浓度为0.1%做制备微乳进行微胶囊的制备实验。

表1 加入不同浓度Span 85的W/O乳化剂的表征Table 1 Characteristics of the W/O emulsions with different concentration of Span 85
2.2 去稳定剂的加入对微胶囊膜厚度和Ca2+释放的影响
膜厚度结果(图2A)显示:与空白组相比,乙醇组膜厚度增加较小,而吐温组和吐温乙醇组膜厚度都有明显增加。从图(2B)中也可以直观地看出,不同去稳定剂加入后,微胶囊的膜厚度不同。
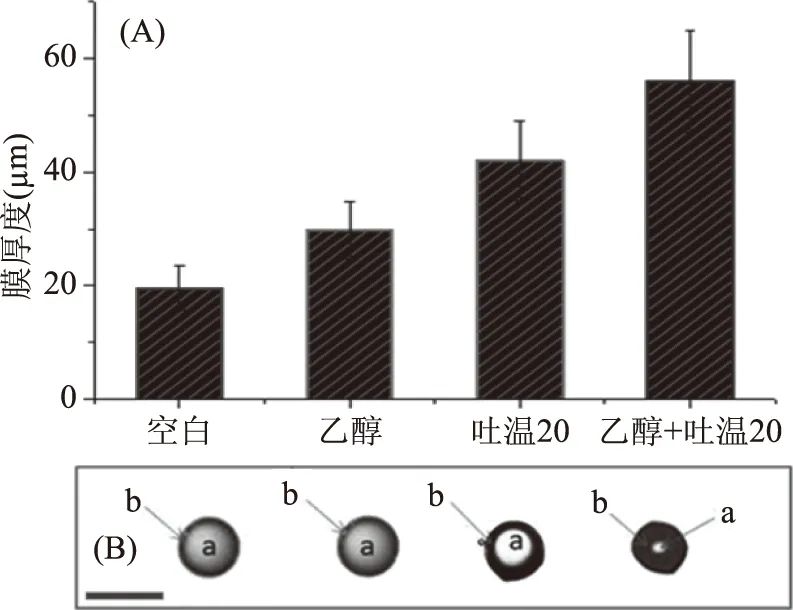
图2 加入乙醇或/和吐温20前后微胶囊的膜厚度Fig.2 Membrane thickness before and after adding of ethanol or/and Tween20注:A:加入不同去稳定剂后微胶囊的膜厚度图;B:加入不同去稳定剂后单个微胶囊的显微图片,a:核,b:膜(40×)。
钙离子的释放结果(图3)显示,加入适宜的去稳定剂可以使乳化剂中的Ca2+从壳中渗出。空白组和乙醇组释放量较少,相对应的膜厚度也较薄,而Tween 20组、乙醇+吐温20组Ca2+释放量较高,但并未完全释放。随微胶囊壳体积的增加,钙的释放率在22%~85%之间。钙离子释放越多,微胶囊的膜越厚,因此,最终选择乙醇+吐温20作为去稳定剂。

图3 从油核中释放出来的Ca2+百分含量Fig.3 Percentage of calcium released from the oil core
2.3 微胶囊成囊参数的确定
2.3.1 海藻酸钠浓度对成囊质量的影响 海藻酸钠的浓度对微胶囊的成型性有很重要的影响,当海藻酸钠浓度为0.5%时,由于其浓度较小,能与Ca2+结合的-COOH很少,所形成的微胶囊球大小不一且微胶囊的性状不圆整。当海藻酸钠浓度为1%时,成球效果会明显提高,微胶囊形貌较圆实,粒径分布比较均一;但是,当海藻酸钠浓度为1.5%时,球形不规整、球形度变差,粒径分布范围变宽。因为,随着海藻酸钠浓度的上升,海藻酸钠的粘度也会随之升高,会导致微胶囊很难成型。因此选用海藻酸钠的最优浓度为1%。

图4 海藻酸钠/Ca2+微胶囊(40×)Fig.4 Alginate/Ca2+ microcapsule(40×)注:A:海藻酸钠浓度0.5%;B:海藻酸钠浓度1%;C:海藻酸钠浓度1.5%。
2.3.2 CaCl2浓度对微胶囊质量的影响 图5显示,随着CaCl2浓度增加,微胶囊的成球效果也逐渐提高,当CaCl2浓度较低时,与海藻酸钠中羧基所结合的钙离子较少,导致微胶囊膜易破裂,形成的微胶囊不稳定。当氯化钙浓度较高时,成球效果明显变好。但是当Ca2+浓度大于60 g/L时微胶囊变的更加紧实,会使囊内空间变小,不利于精油包封。综合考虑,选用Ca2+为60 g/L较为合适。

图5 海藻酸钠/Ca2+微胶囊(40×)Fig.5 Alginate/Ca2+ microcapsule(40×)注:A:CaCl2浓度40 g/L;B:CaCl2浓度60 g/L;C:CaCl2浓度80 g/L。
2.3.3 固化时间对微胶囊质量的影响 固化时间定义为加入去稳定剂(乙醇和吐温20)后乳液液滴与海藻酸钠溶液接触的时间。图6显示,固化时间1~5 min内所形成的微胶囊粒径较小,成囊效果较差。固化时间为15 min时微胶囊的膜厚度达到了最大值,再继续搅拌微胶囊膜厚度减小。由此推断15 min的固化时间足以让钙离子的释放量达到最大值。因此微胶囊的固化时间选择15 min。

图6 海藻酸钠/Ca2+微胶囊(40×)Fig.6 Alginate/Ca2+ microcapsule(40×)注:A:1 min;B:3 min;C:5 min;D:10 min;E:15 min;F:20 min。
2.4 微胶囊性能表征
根据前期试验结果,最终选用乳化剂浓度为0.1%,CaCl2浓度为60 g/L,海藻酸钠浓度为1%,制备薰衣草海藻酸钠微胶囊,并对加入不同去稳定剂之后的载药量、包封率、粒径、膜厚度进行测定。测定结果如表2所示。
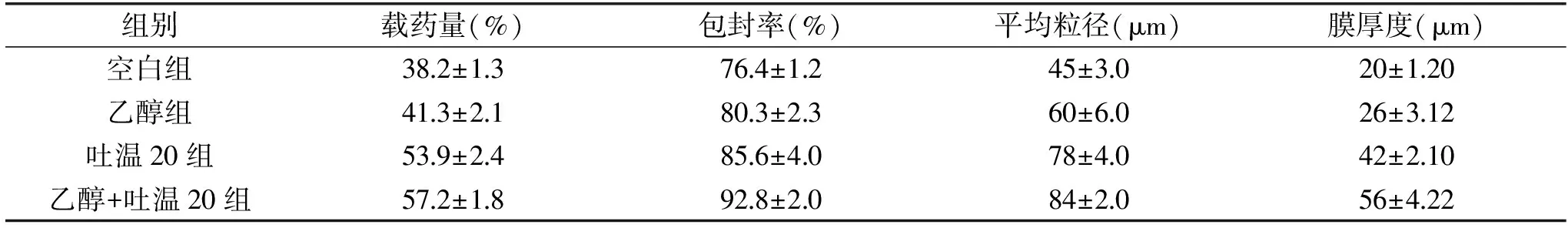
表2 微胶囊的性能表征Table 2 The properties characterization of microcapsule
2.5 体外释放
2.5.1 不同膜厚度对薰衣草-海藻酸钠微胶囊缓释速率的影响 微胶囊膜厚度与药物从微胶囊中释放出来的时间有非常密切的联系,所以有必要研究微胶囊膜厚度对微胶囊释放性能的影响。在制备过程中,分别加入乙醇、吐温20、乙醇+吐温20 作为去稳定剂,与空白组的体外释放情况进行对比,释放结果如图7所示。
从图7可以看出空白组在10 h内释放量达到了92%,乙醇组为80%和吐温20组为82%,但乙醇+吐温20组释放量仅为70%。综上所述,薰衣草精油从微胶囊中释放出来的时间是可以通过控制膜厚度来进行调控的。

图7 海藻酸钠/Ca2+微胶囊在不同膜厚度条件下的累计释放率Fig.7 The cumulative release rate of sodium alginate/Ca2+microcapsules under different film thickness conditions
2.5.2 不同pH对薰衣草精油释放速率的影响 pH对释放的影响结果如图8所示。由图8可知,海藻酸钠-薰衣草精油微胶囊在不同pH的缓释介质中呈现相同规律,在刚开始1 h内,其缓释速率最高,随后,其药物释放速率会慢慢减小,在3 h后基本达到了缓释平衡。刚开始释放较快可能是因为海藻酸钠是水溶性电解质,在缓冲液中会逐渐溶胀,导致在1 h时有一个突释现象产生。但是当溶胀达到一定限度后,其缓释速率主要依靠海藻酸钠与钙离子所形成的凝胶的网格孔径大小决定。综上所述,可以利用海藻酸钠的特殊性质,通过改变释放介质的pH,实现薰衣草精油在海藻酸钠微胶囊中的控时控释释放。
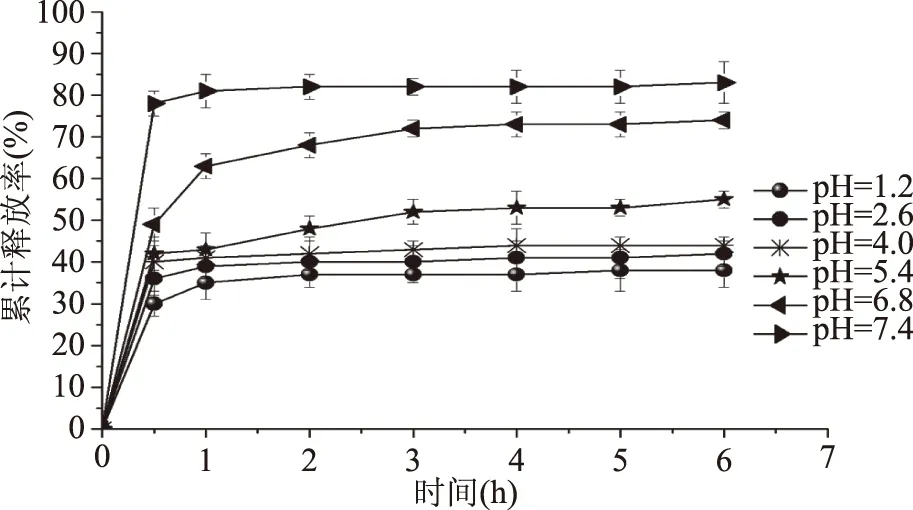
图8 海藻酸钠/Ca2+微胶囊在不同pH条件下的累计释放率Fig.8 The cumulative release rate of sodium alginate/Ca2+microcapsules under different pH conditions
3 结论
以海藻酸钠为壁材,用反向分散凝胶技术制备了载薰衣草精油的微胶囊。并通过加入不同的去稳定剂得到了具有不同膜厚度的微胶囊。制得的微胶囊膜厚度在20~56 μm之间。通过研究不同膜厚度的微胶囊释放情况,发现膜厚度越大释放越缓慢。膜厚度为56 μm时10 h内的释放仅为70%,膜厚度为20 μm时10 h内的释放率为92%。此外,当释放介质pH小于4时因海藻酸钠与溶液中的氢离子结合形成不溶物致使释放较为缓慢,当溶液pH大于4时,微胶囊在水中迅速膨胀导致其释放速率增加。得到了具有膜厚度和pH响应的可控释放微胶囊。但由于条件限制,制备方法尚不成熟,所制备的微胶囊粒径均一度还存在问题,有些机理方面的研究尚未完全清楚,后期希望对制得的微胶囊进行更进一步的表征,对方法有更一步的改进。为薰衣草精油的包合及控释制剂的应用提供一定的参考。
