肝硬化患者肠内营养对其肝功能、血清蛋白和炎症因子水平及疗效的影响
2019-02-20郭艳
郭 艳
肝脏作为机体消化器官之一,在糖类、蛋白质、脂肪的合成与分解中具有重要作用,故肝脏发生病理学改变时,机体能量代谢也将随之变化,而导致营养代谢失衡[1]。肝硬化是一种进展性肝疾病,患者肝组织呈不同程度病理学改变,可引起能量代谢紊乱,也有研究发现,约80%肝硬化患者存在营养不良[2],且营养不良能使肝硬化患者腹水、酸碱平衡紊乱进一步加重,不利于患者预后[3]。 因此,给予肝硬化患者营养支持有其必要性。肠内营养(EN)及肠外营养(PN)均为临床常用营养支持方式,而有学者指出,EN 更符合肝硬化患者生理需求,于患者营养状况改善效果更佳,亦能促进患者病情恢复[4]。 对此,该研究选取172 例肝硬化患者为研究对象,以探讨EN 干预对其营养状况及临床疗效的影响, 现报告如下。
1 资料与方法
1.1 一般资料 选取2015 年2 月—2018 年1 月笔者所在医院肝硬化患者172 例为研究对象,采用随机数字表法分为对照组及观察组, 各86 例。 年龄40~63 岁。纳入标准:符合《慢性乙型肝炎防治指南》[5]乙型肝炎诊断标准和《肝硬化中西医结合诊疗共识》[6]肝硬化诊断标准者;肝炎后肝硬化者;签署知情同意书且经医院医学伦理委员会审批者。 排除标准:合并肝癌或其他恶性肿瘤者;孕产妇或哺乳期妇女;合并酒精性肝硬化者;合并糖尿病等其他基础疾病者;相关治疗禁忌者;依从性较差者。 观察组男47 例,女39 例;平均年龄(51.49±10.17)岁;肝功能分级(Child-Pugh)A 级28 例,B 级32 例,C 级26例;合并低蛋白血症者75 例;水肿或腹水者49 例;肝性脑病者19 例;上腹胀者72 例,食欲缺乏者65例。 对照组男45 例, 女41 例; 平均年龄(50.27±10.03)岁;Child-Pugh 分级A 级29 例,B 级33 例,C级24 例;合并低蛋白血症者73 例;水肿或腹水者47 例;肝性脑病者18 例;上腹胀者71 例,食欲缺乏者63 例。 两组患者一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法 两组均给予保肝、退黄、降酶、利尿(合并腹水者)等基础治疗;并对人血白蛋白(ALB)<28 g/L的患者给予人血ALB(生产企业:中国绿十字生物制品有限公司,规格:20 g,批准文号:S20083037)静脉滴注治疗。 对照组在此基础上予以常规营养干预:限制氯化钠摄入量<6 g,且饮食以大米、白面、猪肉、牛肉、羊肉、绿叶蔬菜、乳制品、豆制品、水果等为主,保证每日热量需求值为30~35 kcal/kg,热氮比为100~120 kcal∶1 g,蛋白质为1.2 g/kg,脂肪为1 g/kg。 观察组则予以EN 干预:给予能全素(生产企业:德国美乐宝有限责任公司,规格:320 g,批准文号:H20090007)干预。 320 g 供能1500 kcal,渗透压为320 mOsm/L; 首次予以500 kcal/d 能全素干预,待患者无不适反应后予以1000 kcal/d 能全素,并以此剂量维持干预;对能全素干预热量摄入不足者给予饮食补充。 两组均干预2 个月。
1.3 观察指标 (1)干预前及干预2 个月后肝功能指标:采用全自动生化分析仪(日本奥林巴斯株式会社生产, 型号:AU640) 检测其血清总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)水平。 (2)干预前后血清蛋白水平:使用双缩脲法(试剂由北京索莱宝科技有限公司生产)检测其血清总蛋白(TP)水平,使用溴甲酚绿法(试剂由上海复星长征医学科学有限公司生产)检测其ALB 水平,采用免疫比浊法(试剂由北京九州泰康生物科技有限责任公司生产)检测其转铁蛋白(TF)水平。 (3)干预前后血清炎症因子水平:利用双抗体夹心酶联免疫吸附法(试剂由北京北方生物技术研究所生产)检测其白细胞介素-21(IL-21)、白细胞介素-10(IL-10)水平。 (4)干预前后血清胰岛素样生长因子-1(IGF-1)水平:使用放射免疫分析法(试剂由北京北方生物技术研究所生产) 检测其血清IGF-1 水平。 (5)两组肝功能分级:记录干预4 周后两组Child-Pugh 分级情况。
1.4 统计学方法 用SPSS 19.0 软件处理数据,计量资料以表示,组间比较采用独立样本t 检验,时间点比较采用配对t 检验;计数资料以例或百分率形式表示,采用χ2检验,等级资料使用Wilcoxon秩和检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 两组患者干预前后肝功能指标比较 干预2个月后,两组血清TBIL、ALT、AST 水平均较干预前降低(P<0.05),且观察组低于对照组(P<0.05),见表1。
2.2 两组患者干预前后血清蛋白水平比较 干预2 个月后,两组血清TP、ALB、TF 水平均较干预前升高(P<0.05),且观察组高于对照组(P<0.05),见表2。
2.3 两组干预前后血清炎症因子水平比较 干预2 个月后,两组血清IL-21 水平均较干预前降低(P<0.05),IL-10 水平则较干预前升高(P<0.05),且观察组变化幅度均大于对照组(P<0.05),见表3。
2.4 两组干预前后血清IGF-1 水平比较 干预2个月后,两组血清IGF-1 水平均较干预前升高(P<0.05),且观察组变化幅度均高于对照组(P<0.05),见表4。
2.5 两组干预后肝功能分级比较 干预2 个月后,观察组Child-Pugh 分级严重程度低于对照组 (P<0.05),见表5。
表1 两组干预前后血清TBIL、ALT、AST 水平比较
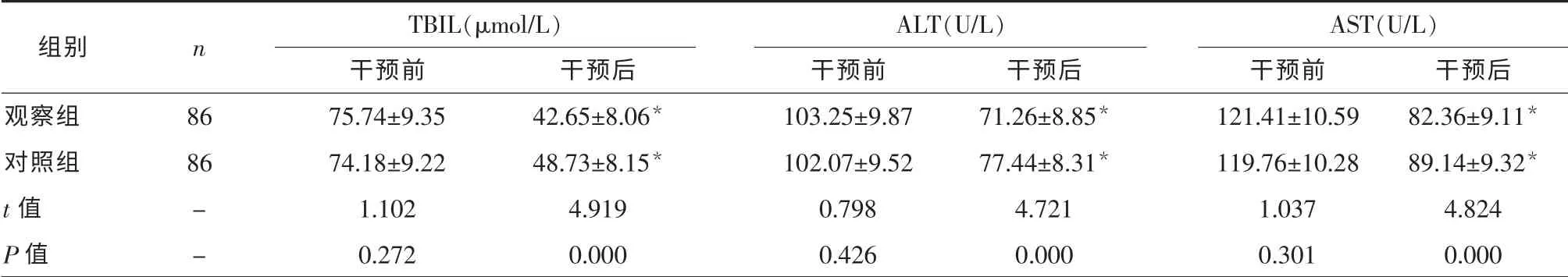
表1 两组干预前后血清TBIL、ALT、AST 水平比较
注:与本组干预前比较,*P<0.05。
组别 n TBIL(μmol/L) ALT(U/L) AST(U/L)干预前 干预前 干预前 干预后观察组 86 75.74±9.35 103.25±9.87 121.41±10.59 82.36±9.11*对照组 86 74.18±9.22 102.07±9.52 119.76±10.28 89.14±9.32*t 值 - 1.102 0.798 1.037 4.824 P 值 - 0.272 0.426 0.301 0.000干预后42.65±8.06*48.73±8.15*4.919 0.000干预后71.26±8.85*77.44±8.31*4.721 0.000
表2 两组干预前后血清TP、ALB、TF 水平比较
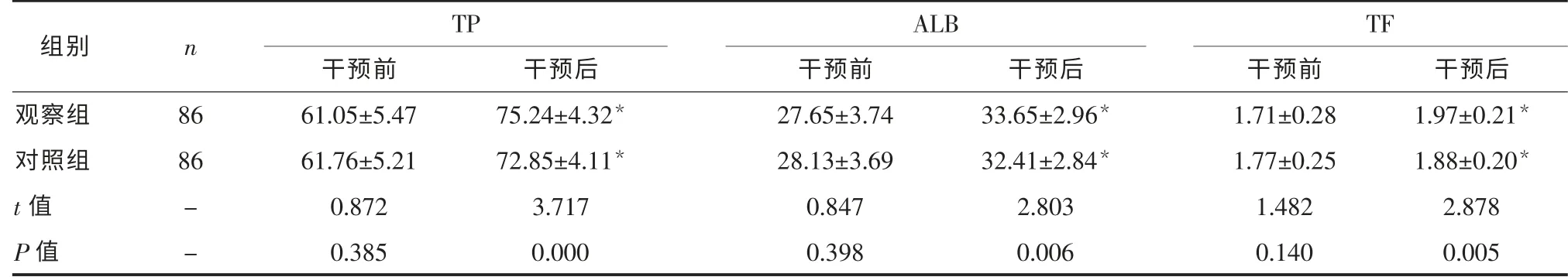
表2 两组干预前后血清TP、ALB、TF 水平比较
注:与本组干预前比较,*P<0.05。
组别 n TP ALB TF干预前 干预前 干预前 干预后观察组 86 61.05±5.47 27.65±3.74 1.71±0.28 1.97±0.21*对照组 86 61.76±5.21 28.13±3.69 1.77±0.25 1.88±0.20*t 值 - 0.872 0.847 1.482 2.878干预后33.65±2.96*32.41±2.84*2.803 P 值 - 0.385 0.398 0.140 0.005干预后75.24±4.32*72.85±4.11*3.717 0.000 0.006
表3 两组干预前后血清IL-21、IL-10 水平比较

表3 两组干预前后血清IL-21、IL-10 水平比较
注:与本组干预前比较,*P<0.05。
组别 n IL-21 IL-10干预前 干预前 干预后观察组 86 894.55±97.43 34.57±2.14 37.19±1.78*对照组 86 887.96±96.28 34.96±2.05 36.58±1.72*t 值 - 0.446 1.220 2.285干预后576.82±84.32*643.15±87.63*5.058 P 值 - 0.656 0.224 0.024 0.000
表4 两组干预前后血清IGF-1 水平比较
注:与本组干预前比较,*P<0.05。
组别 n IGF-1干预前 干预后观察组 86 32.69±6.14 52.94±7.63*对照组 86 33.38±6.22 48.32±7.45*t 值 - 0.732 4.018 P 值 - 0.465 0.000
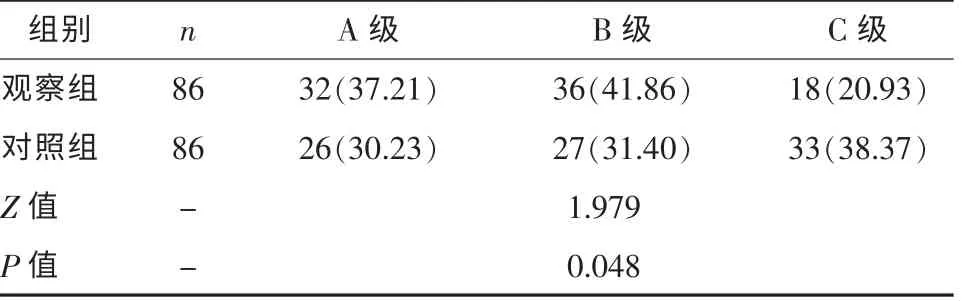
表5 两组干预后Child-Pugh 分级比较[例(%)]
3 讨 论
目前,已有部分国家将营养干预纳入肝硬化的常规治疗方案,以及时改善患者营养状况,避免营养不良相关并发症发生[7]。 既往我国对肝硬化患者的营养支持未予以重视,使肝硬化患者营养状态处于较低水平,造成肝硬化患者预后受到严重影响[8]。近年来,随着临床对营养风险筛查的重视,肝硬化患者的营养状态也受到国内学术界的广泛关注[9]。也有部分国内学者提出,给予肝硬化患者有效的营养支持可减轻患者营养不良风险,也能改善患者肝功能,于患者预后有利[10]。 EN 疗法可辅助降低肠黏膜通透性, 避免细菌易位, 以降低感染发生率;而PN 则在营养素补充过多时,能增加肝脏代谢负担,不利于调节肝脏代谢功能[11],且EN 疗法也为国外学者普遍接受的肝硬化营养支持方法[12]。 因此,该研究对EN 支持疗法干预效果展开分析, 以探究肝硬化患者的最佳营养支持方法。
研究结果显示, 给予EN 疗法干预的观察组干预后血清蛋白TP、ALB、TF 水平升高幅度均大于予以常规营养干预的对照组, 说明EN 疗法可为患者提供更为全面的营养支持, 更适于肝硬化患者,利于调节其蛋白质代谢功能, 而促进患者营养状态改善。TF 为反映机体铁代谢的重要指标,当铁负荷过重时,可促进氧自由基生成,而刺激肝组织纤维化[13]。 故上述结果也提示,EN 疗法不仅能改善患者蛋白质代谢状况,也能缓解肝纤维化情况。 此外,观察组干预后肝功能 (血清TBIL、ALT、AST 水平)改善情况也明显优于对照组。 原因可能与EN 疗法充分发挥其与患者生物需求相符合的优点,提高患者蛋白质合成能力,纠正患者负氮平衡状态,而降低肝纤维化程度,并促进肝细胞再生,使肝功能提高有关[14]。 另外,观察组干预后血清IGF-1 水平升高幅度明显大于对照组。 IGF-1 与肝细胞的再生与肝脏的合成功能密切相关,不仅能促进肝细胞功能恢复,也能减少肝纤维化,于患者预后有积极意义[15]。这也进一步证实,EN 疗法可促进肝硬化患者肝纤维化缓解,于改善患者肝功能有利。
另据文献报道,IL-21 及IL-10 为肝脏病变中的重要炎症因子;IL-21 可辅助激活肝星状细胞,引起胶原蛋白上调,使肝纤维化程度加深[16];而IL-10为有效的抗炎细胞因子,具有抗纤维化作用,且于肝硬化细胞损伤有保护作用[17]。 而该研究中,观察组干预后血清IL-21、IL-10 水平明显较干预前改善。 提示EN 疗法还能通过调节肝硬化患者炎症反应状态,使肝纤维化程度减轻。 考虑此结果由以下因素引起:肝硬化导致部分肝细胞坏死,使肝细胞清除促炎性因子能力及分泌抗炎性因子降低;而EN 疗法使患者营养状态改善, 减小负氮平衡造成的肝细胞损伤,而提高肝细胞对炎症因子的调节能力,利于改善机体炎症因子水平[18]。 观察组干预后Child-Pugh 分级严重程度低于对照组。 这也提示EN 疗法还能发挥其降低肝硬化患者肝纤维化程度的功效,使肝脏储备功能提高,于患者病情转归有利。
