副溶血弧菌耐热直接溶血毒素抑制人肺腺癌细胞活性的研究
2019-02-19,,2,3,,
,,2,3,,
生物毒素抗肿瘤来源于“以毒攻毒”这个说法,生物毒素固然有害,但也可以用于治病,许多科学家从不同的生物比如蛇、蜂、相思子、炭疽等里面提取毒素并用于肿瘤的治疗,这已经成为一种治疗癌症的新手段[1]。
耐热直接溶血毒素(Thermostabile direct hemolysin,TDH) 来源于能够引起人急性肠胃炎,伤口感染和败血症及海鲷、对虾、九孔鲍、文蛤等水生动物疾病的副溶血性弧菌(Vibrioparahaemolyticus,Vp),是一种分布较广的细菌毒素[2]。TDH 蛋白是由两条相同的多肽链构成的、分子量为 42 kDa 的二聚体毒素蛋白[3]。其每条多肽链由165 个氨基酸残基构成,在近C 端有一个二硫键,呈神奈川阳性[4]。研究发现TDH 具有强烈的肝脏毒性、溶血活性、肠毒性、小鼠的致死性、心脏毒性[5-7]。
本文以试验室自己制备的高纯度TDH毒素蛋白,通过比较TDH对不同细胞的细胞毒性作用说明TDH对肿瘤细胞的毒性远大于正常细胞。不同剂量、不同时间处理人肺腺癌细胞SPC-A-1细胞, 通过生长曲线和“创伤”试验评价TDH在体外对肿瘤细胞生长、增殖及迁移的影响,进一步用流式细胞法和荧光试剂盒检测TDH对SPC-A-1细胞凋亡和caspase-3活化的影响,以探讨其体外抑制肺腺癌细胞的机理,以期为海洋来源的生物毒素—TDH抗肿瘤的基础研究和应用研究提供科学的资料和依据。
1 材料与方法
1.1材料与试剂 致病性副溶血弧菌ATCC33846 (标准菌株)购于北京中原公司;DEAE-纤维素、DEAE-Sephadex A-50、葡聚糖G-75层析柱购自上海思吉生物制品有限公司;Annexin V细胞凋亡试剂盒购自BD pharmingentm公司;Caspase-3荧光检测试剂盒购自KeyGEN BioTECH公司;人肺腺癌细胞SPC-A-1、人结肠上皮细胞NCM460、人肝成纤维细胞LO2由华东理工大学药学院刘建文教授惠赠; BSA (牛血清蛋白)购于上海正极生物有限公司;DMEM培养基、RPMI1640、胎牛血清均购于上海普飞生物有限公司。快速吉姆萨染液购于生物工程股份有限公司。
1.2 方法
1.2.1TDH的制备及纯化 37 ℃条件下对致病性副溶血弧菌ATCC33846进行摇床扩大培养16 h,8 000 r/min离心取上清去掉菌体,硫酸铵盐析提取粗蛋白,然后依次经过DEAE-纤维素、DEAE-Sephadex A-50、葡聚糖G-75层析纯化TDH[8],将纯化后的TDH 100 ℃,水浴加热10 min,与用PBS缓冲液制备的小鼠的红细胞悬液进行反应,通过红细胞的裂解情况检测纯化后TDH的溶血活性, 用非变性凝胶电泳检测纯度,冷冻干燥。
1.2.2TDH的细胞毒性试验 取对数生长期的SPC-A-1细胞,人结肠上皮细胞NCM460、人肝成纤维细胞LO2,用含5%小牛血清的DMEM培养基制成细胞悬液,以5 000细胞/孔的密度接种于96孔板,每孔体积为100 μL,于37 ℃,5% CO2的培养箱中孵育,等细胞贴壁后。用不同浓度的TDH(0、1.5625、3.125、6.25、12.5、25、50、100、200 μg/mL)分别处理,每组设5个复孔,在培养箱中孵育24 h。24 h后每孔加入10 μLMTT(浓度为5 mg/mL),继续孵育4 h,终止培养,弃去上清液,每孔加100 μL DMSO,置摇床上振荡10 min,使沉淀充分溶解,最后以570 nm为检测波长,655 nm为参考波长用酶标仪测定各孔光吸收值。用改良寇氏法计算出每株细胞的半抑制剂浓度IC50。
改良寇氏法:LogIC50=Xm-I*(P-(3-Pm-Pn)/4)
Xm:Log最大药物剂量,I:Log(最大药物剂量/相邻剂量),P:阳性反应率之和,Pm:最大阳性反应率,Pn:最小阳性反应率
1.2.3生长曲线 取对数生长期的SPC-A-1细胞,用含5%小牛血清的DMEM培养基制成细胞悬液,以3000细胞/孔的密度接种于96孔板,每孔体积为100 μL,于37 ℃,5% CO2的培养箱中孵育,等细胞贴壁后。用不同浓度的TDH(0、0.5、1、2、3、4 μg/mL)分别处理,每组设5个复孔,在培养箱中连续孵育9 d。不同时间在相应的孔中加入10 μL MTT(浓度为5 mg/mL),继续孵育4 h,终止培养,弃去上清液,每孔加100 μL DMSO,置摇床上振荡10 min,使沉淀充分溶解,最后以570 nm为检测波长,655 nm为参考波长用酶标仪测定各孔光吸收值。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.4“创伤”试验 取对数生长期的SPC-A-1细胞,制备单细胞悬液,以1×105细胞/mL接种于24孔培养板,每孔1 mL。置37 ℃,5% CO2的培养箱中孵育,到细胞长成单层后,用200 μL的塑料枪头造一道划痕,用PBS清洗1遍,显微镜拍照,并用目镜测微尺(用镜台测微尺校正)测量划痕宽度后,每孔加入一定浓度的药物(4、2、1、0.5 μg/mL)处理,每浓度平行3孔,对照组加等量体积的培养液,孵育48 h,用目镜测微尺测量划痕宽度[9]。
细胞迁移的距离=药物处理前的划痕宽度-药物处理后的划痕宽度/2
1.2.5细胞凋亡试验 用 BD pharmingentm提供的试剂盒测定Annexin V染色测定细胞凋亡。取对数生长期SPC-A-11×105细胞/mL接种于细胞培养板后,孵育过夜,然后将5-FU或TDH加入培养孔中。处理24 h后,用胰酶消化,离心后加入培养基制成单细胞悬液。在100 μL细胞悬液中加入Annexin V试剂100 μL,孵育20 min后在室温下进行分析,通过Accuri C6流式细胞仪检测不同处理组SPC-A-1细胞的凋亡情况,采用数据分析软件csampler BD进行数据处理。
1.2.6caspase-3活性试验 取对数生长期的SPC-A-1细胞,以1×105细胞/mL接种于6孔板,置37 ℃,5% CO2浓度的培养箱中孵育12 h,每孔加入1 mL的5 μg/mL的TDH处理不同时间,设阴性对照,收集细胞。加入100 μL冰冷的细胞裂解缓冲液(使用前每50 μL 细胞裂解缓冲液加入0.5 μL DTT),吹打均匀;置冰上裂解20 min,其间涡旋振荡3次,每次10 s。4 ℃,10 000 r/min离心1 min后,小心吸取上清转移至新的管中,并放置冰上待用;取少量上清(1~2 μL),Braford法测定蛋白浓度。按照说明书吸取30 μL含100~200 μg蛋白的细胞裂解上清,依次加入反应缓冲液,ddH2O以及加入Caspase-3底物反应液,并于37 ℃避光孵育1.5 h;用荧光酶标仪测定荧光强度(激发波长=485 nm,发射波长=535 nm)。通过计算TDH处理组比阴性对照组平均荧光强度的倍数来确定TDH处理组Caspase-3活化程度。以10 mmol/L PBS和反应缓冲液 作为空白对照。

2 结 果
2.1TDH的纯化 经过一系列层析后得到的TDH样品进行进行溶血活性检测,用PBS缓冲液和没有进行加热处理的TDH作为对照,经过加热处理后有活性的样品孔内没有红细胞沉淀,将这部分洗脱液进行合并浓缩得到最后的样品,结果见图1,非变性凝胶电泳显示单一条带,见图2。说明本试验中得到的TDH是具有活性并且纯度较高的,该样品冷冻干燥。使用前,溶解于少量pH7.4 , 0.01 mol/L的PBS或者培养基中。

a:PBS对照组;b:TDH对照组;c、d、e:TDH加热组图1 TDH洗脱液的溶血活性测定Fig.1 Determination of hemolytic activity of TDH eluent
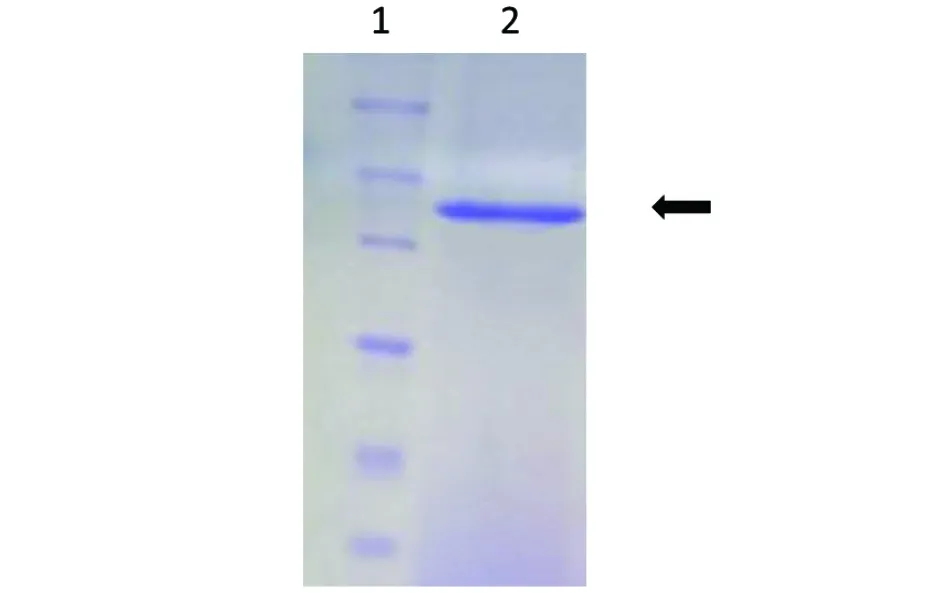
1. 分子量marker; 2. TDH图2 纯化后的TDH非变性SDS-PAGE电泳图Fig.2 Non denatured SDS-PAGE electrophoresis of purified TDH
2.2TDH的细胞毒性试验 不同浓度TDH处理 SPC-A-1细胞、NCM460细胞、LO2细胞,对其半抑制剂浓度IC50的影响见表1。从试验结果可以看出:正常细胞的IC50高出肺腺癌细胞近20倍,由此可见TDH对肿瘤细胞的毒性远大于正常细胞,对肿瘤细胞具有选择性。
2.3TDH对 SPC-A-1细胞生长曲线的影响 不同浓度TDH处理 SPC-A-1细胞,对其生长曲线的影响见图3。从试验结果可以看出:TDH剂量依赖性抑制SPC-A-1细胞的生长, 与对照组相比,TDH明显减缓了SPC-A-1细胞生长对数期,使斜率压低,缩短了平台期,加速了衰亡期。
表1 TDH对不同细胞的半数抑制量
Tab.1 Half maximal inhibitory concentration of different cells treated by TDH

细胞IC50(μg/mL)SPCA16.7NCM460151LO2118
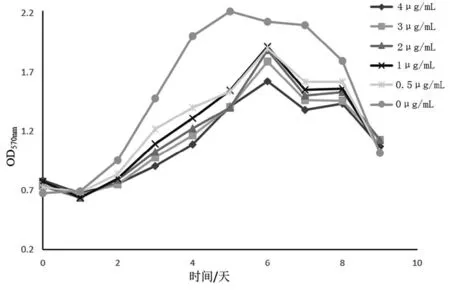
图3 TDH对SPC-A-1细胞生长的抑制作用Fig.3 Inhibitory effect of TDH on the growth of SPC-A-1 cell
2.4TDH对 SPC-A-1细胞迁移能力的影响 不同浓度TDH处理 SPC-A-1细胞,对其迁移能力的影响见图4。试验结果可以看出:随着TDH浓度的增大,SPC-A-1细胞移动的距离越来越小,呈剂量依赖性。说明TDH可以抑制SPC-A-1细胞的迁移。
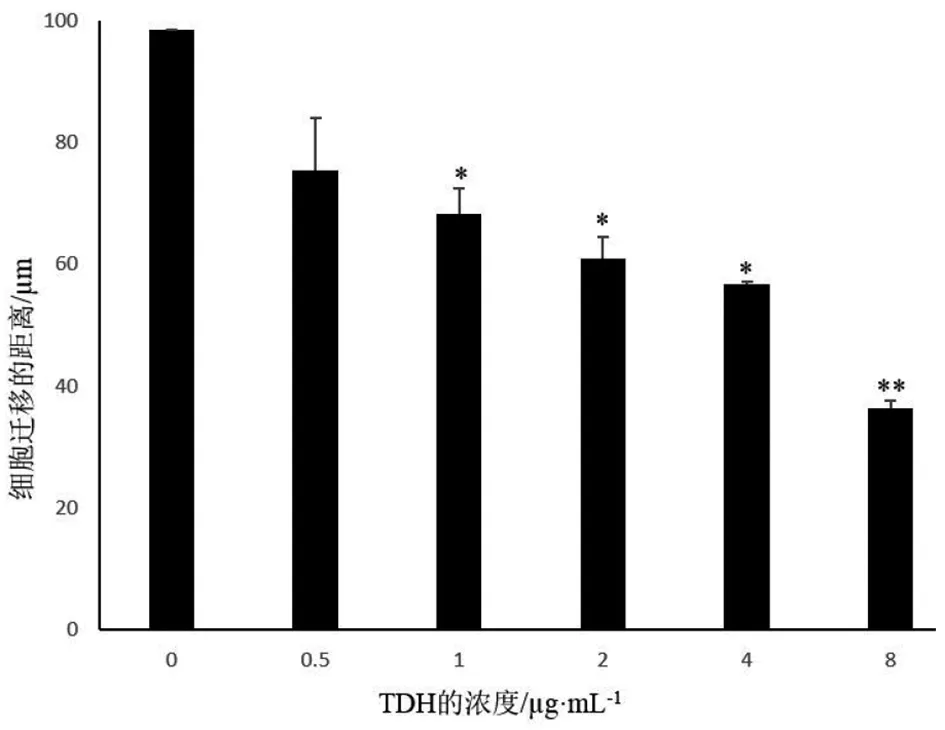
与对照组比较 *P<0.05, **P<0.01图4 TDH对SPC-A-1细胞移动能力的抑制作用Fig.4 Inhibitory effect of TDH on the migration of SPC-A-1 cell
2.5TDH对 SPC-A-1细胞凋亡的影响 Phosphatidyl serine(PS)通常是定位在质膜的脂质双层膜的内表面。当细胞凋亡时,PS是外翻的、可由Annexin V-FITC检测。因此,膜联蛋白可作为程序性细胞死亡的标志物。TDH处理24 h后诱导SPC-A-1细胞凋亡显著增加(早期)(图5)。正常对照组,阳性对照组5-Fu (20 μg/mL),5 μg/mL TDH处理组SPC-A-1细胞的凋亡率分别为2.40%、53.20%和33.30%,在5-FU和TDH处理组分别表现出51.9%和33%的早期凋亡事件。因此,我们认为,细胞凋亡是TDH引起SPC-A-1细胞死亡的重要作用机制。

a:阴性对照; b:阳性对照组;c:TDH 处理组图5 TDH诱导SPC-A-1细胞凋亡的作用Fig.5 Effect of TDH on inducing apoptosis of SPC-A-1 cell
2.6TDH对caspase-3活性的影响 5 μg /mL的 TDH处理SPC-A-1细胞后,分别在1, 1.5, 2, 2.5h检测 caspase-3的活性,发现随着时间的延长,caspase-3的活性逐渐增加(图6)。

与对照组比较,*P<0.05,**P<0.01图6 5 μg /mL TDH对SPC-A-1细胞caspase-3的激活Fig.6 Activation of Caspase-3 in SPC-A-1 cell by TDH (5 μg /mL)
3 讨 论
细菌毒素是天然毒素的一种,指微生物产生的具有自身防卫作用的各种物质。近年研究发现,细菌毒素不仅具有毒理作用,也具有药理作用,可作为天然来源的抗肿瘤药物,是新型药物开发的重要研究靶标,是近年来兴起的用于癌症治疗的新思路[10]。许多细菌毒素都是与配体融合然后结合到肿瘤细胞上发挥作用,因此免疫毒素一般设计成配体或抗体与细菌毒素融合的嵌合蛋白,从而定位到特异的靶标细胞上发挥作用,如YangX等将白喉毒素的催化兼移位区域(提供靶向和毒性作用)和人表皮生长因子融合成新蛋白在体内和体外均有良好的抗肿瘤活性,并且在小鼠体内没有显示出任何非特异性全身毒性[11]。一个包含白细胞介素2和白喉毒素片段的融合毒素被批准用于T淋巴细胞瘤的治疗[12]。以上研究提示,细菌毒素对多种肿瘤有较好疗效,且能克服传统癌症疗法的缺陷,在癌症治疗中具有重要价值和应用前景。
近年来的研究表明:副溶血弧菌耐热直接溶血毒素(TDH)可抑制结直肠癌细胞系的增殖,显示出一定的抗肿瘤活性[13]。本试验测得在TDH处理人的结肠上皮细胞NCM460、人肝成纤维细胞LO2 、人肺腺癌细胞SPC-A-1 24h之后,细胞的半抑制剂浓度IC50分别为151μg/mL、 118μg/mL和6.7μg/mL。通过TDH对不同细胞的细胞毒性比较,两株人的正常细胞的IC50比SPC-A-1高出近20倍,由此可知,TDH对肿瘤细胞的毒性远大于正常细胞,对肿瘤细胞具有选择性。本试验研究发现:经纯化后的TDH处理人肺腺癌细胞SPC-A-1 24h,结果显示:TDH剂量依赖性抑制SPC-A-1细胞的生长,能减缓细胞生长的对数期、缩短平台期,促进衰亡期。图2和图3可以看出:TDH能明显抑制SPC-A-1细胞的克隆形成及迁移能力。据报道,癌细胞的克隆形成能力与癌细胞的增殖能力和转移能力密切相关[14],而癌细胞的迁移能力在癌细胞的转移过程中起关键作用。进一步,流式细胞仪研究采用膜联蛋白V染色法,它反映了细胞可能死亡的两种截然不同的方式:凋亡和坏死途径。大部分潜在的抗肿瘤药物会通过诱导细胞凋亡而杀伤细胞[15]。5μg/mLTDH显示出33%细胞凋亡,明显高于正常对照细胞凋亡率,说明细胞死亡是通过细胞凋亡途径介导。进一步的研究表明:TDH能诱发caspase-3的活化,说明TDH可能通过激活caspase-3诱导了细胞的凋亡。在哺乳动物细胞中,caspase-3依赖性的细胞凋亡通过两条途径引发:细胞表面的死亡受体起始的外源性途径或者线粒体起始的内源性途径[16-17]。进一步的试验需要探明TDH是通过其中哪一条途径诱导凋亡的机理。
总之,本研究说明TDH可以有效地抑制SPC-A-1细胞的生长、增殖及体外转移能力可能与TDH激活caspase-3而诱导细胞凋亡有关,提示TDH可能是一种潜在的治疗人肺癌的生物治疗方法。TDH在体内对肿瘤细胞的抑制及其作用机制的研究将在后续试验中进一步研究。
利益冲突:无
