DEPDC1基因在非肝炎病毒相关性肝细胞癌及癌旁组织中的表达及临床意义
2019-02-19赵文超王敬晗祝建勇赵锦标李景波邱宝安夏念信
赵文超,王敬晗,祝建勇,赵锦标,安 阳,李景波,邱宝安,夏念信
肝细胞癌(hepatocellular carcinoma,HCC;简称肝癌)在世界范围内是发病率及死亡率最高的恶性肿瘤之一,在我国亦是如此。目前认为HCC发生主要与乙肝病毒(hepatitis B virus,HBV)和丙肝病毒(hepatitis C virus,HCV)感染相关[1]。但非肝炎病毒性肝癌(多数为非乙肝丙肝相关性肝癌,non-B non-C HCC,NBNC-HCC)也占相当比例,且更容易被忽视。NBNC-HCC患者的背景肝病多与代谢性疾病相关,主要包括非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD),其他包括酒精性脂肪性肝病、肥胖、糖尿病等[2]。近期有来自日本的统计研究发现,在肝炎病毒流行得以逐步控制的今天,NBNC-HCC的发生率有逐步增加的趋势[3],其相关危险因素、预后结果等尚存争议。原因在于对于此类肝癌患者的临床特点和与常见肝炎病毒相关性肝癌的发病机理之间缺乏对比研究[4]。对NBNC-HCC在生物学行为、分子机制领域的探讨,有助于改变我们对此类肝癌患者的认识,并改善其预后。
人含DEP结构域1(DEP domain containing 1,DEPDC1)基因位于染色体1p31.2,全长约23 Kb,其表达产物与细胞膜锚定、信号转导、细胞极性确立、小分子GTP酶活性密切相关[5]。有研究表明在膀胱癌中,下调DEPDC1的表达可明显抑制肿瘤细胞生长[6]。同时还有研究显示乳腺癌、多发性骨髓瘤的发生发展与DEPDC1相关[7]。目前DEPDC1在肝癌发生发展中的作用报道较少,且多集中于肝炎、肝硬化背景下的肝癌,尚未有在NBNC-HCC中的比较研究。本研究收集了大量NBNC-HCC临床样本,旨在初步评估DEPDC1基因表达与NBNC-HCC的发生及预后的关系。
1 材料与方法
1.1 临床资料 收集2007年6月—2014年6月间解放军总医院第六医学中心肝胆外科手术切除、经病理切片证实的56例NBNC-HCC冰冻组织和石蜡标本(同时每例患者另取距癌组织2~5 cm处的癌旁组织标本作为对照),并搜集患者的临床病例资料。其中男32例,女24例,中位年龄48(21~67)岁。患者随访64个月,中位生存时间45个月。同时对56例肝癌组织及其癌旁组织抽提RNA,反转录成cDNA,进行转录水平的分析。
1.2 主要抗体及试剂 实时定量PCR所用荧光标记物SYBR Green Mix购自广州东盛生物科技有限公司;兔抗人DEPDC1pAb抗体(HRP标记的羊抗兔二抗购自英国Ahmar公司)。TRIzol reagent购自美国Invitrogen公司;甲醇、无水乙醇均购自上海试剂一厂;Annexin V-硫氰酸荧光素凋亡检测试剂盒购自美国BD公司。DEPDC1引物序列上游:5′-CACTGGGTATTA TCTGCCATGAAG3′;下游:5′-AATCTGCGATTGTI CTGAATACATO-3′,扩增产物为112 bp。GAPDH引物序列上游:5′-GGGTGTGAACCATGAGAAGTATO 3′;下游:5′-GATGGCATGGACTGTGGTCAT 3′,扩增产物为154 bp,由美国Invitrogen公司合成。
1.3 免疫组织化学染色法检测DEPDC1蛋白的表达 将所有肝癌及其癌旁组织进行4 mm连续切片,石蜡包埋,应用cyclin G1多抗进行免疫组化SP法染色。具体操作步骤:①石蜡切片脱蜡至水,3%H2O2室温孵育10 min,以清除内源性过氧化物酶的活性;②抗原微波热修复3 min,抗原修复液为pH6.0柠檬酸缓冲液;③3.5%~10%正常山羊血清封闭非特异性位点,室温孵育10 min;④倾去血清,滴加cyclin GI-抗工作液37 ℃孵育过夜;⑤滴加生物素标记的二抗工作液,湿盒中孵育20 min;⑥滴加辣根过氧化物酶标记的链酶卵白素工作液,湿盒中孵育20 min。上述步骤之间均用0.01 mmol/L PBS(pH=7.4)冲洗。二氨基联苯胺染色,自来水冲洗、苏木精复染细胞核、封片。结果判定:细胞质或细胞膜呈清晰黄褐色颗粒为阳性表达,高倍镜(×400)下随机观察5个视野,根据阳性细胞百分率和染色强度进行半定量分析,染色强度:无染色0分,轻度染色计1分,中度染色计2分,强染色3分;阳性细胞数<10%计0分,10%~25%计1分,26%~50%计2分,>50%计3分。2项指标评分相乘,0~1分为阴性病例(-),≥2分为阳性病例(+),≥4分为强阳性病例(++)。由2名病理科医师双盲法计数,差异超过10%需重新计数。
1.4 实时定量PCR检测肝癌组织及癌旁组织中DEPDC1 mRNA的表达 将收集的肝癌及癌旁组织碾碎,分别置于1.5 mL EP管中,Trizol reagent收集组织,根据试剂盒说明的步骤进行RNA的抽提,然后进行反转录,得到cDNA用于实时定量PCR检测。PCR扩增条件:95 ℃预变性10 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,72 ℃延伸30 s,39个循环,72~95 ℃溶解曲线分析5 s。以双Ct值法计算靶基因相对表达水平:DEPDC1相对表达水平=(ΔCt);ΔCt=Ct(DEPDC1)-Ct(GAPDH);Δ(ΔCt)=ΔCtΔCt(Control)。
1.5 统计学处理 应用SPSS 18.0统计软件,计量资料的均数比较采用t检验,计数资料的生存分析采用Kaplan-Meier法,生存率的比较采用log-rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 DEPDC1蛋白在肝癌组织与癌旁组织中的表达水平 首先免疫组织化学染色法检测了56例NBNC-HCC及其癌旁组织中DEPDC1蛋白的表达情况,免疫组化染色(图1)所示,阳性染色主要位于胞浆内,呈棕黄色或褐色,56例肝癌组织DEPDC1染色均呈阳性着色,且肝癌组织中的表达(7.83±0.17)显著高于癌旁组织(4.67±0.22),差异比较有统计学意义(P<0.05)。
2.2 DEPDC1 mRNA在肝癌组织与癌旁组织中的表达水平 实时定量PCR检测56例手术切除的NBNC-HCC组织及其癌旁组织中DEPDC1 mRNA的表达,研究结果(图2)显示,DEPDC1 mRNA在41例肝癌组织中的表达高于癌旁组织中的表达,高表达率为73.2%(41/56)。研究提示DEPDC1基因在大多数肝癌组织中表达高于癌旁组织,DEPDC1基因有可能在肝癌的发生发展过程中发挥了重要作用。

图1 免疫组化染色法检测DEPDC1蛋白在肝癌组织及癌旁组织中的表达(sp×100)
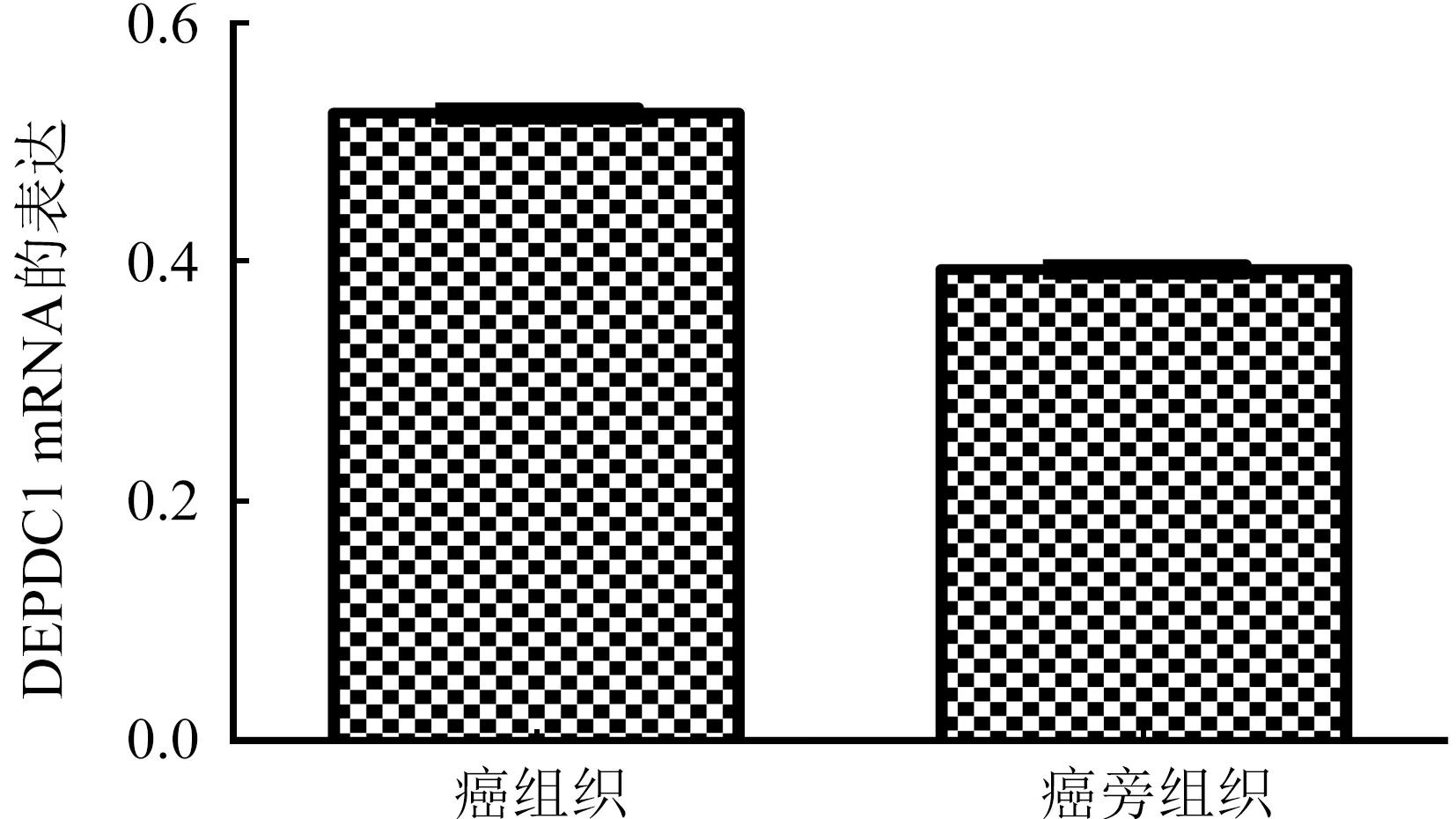
图2 DEPDC1 mRNA在肝癌组织及癌旁组织中的表达
2.3 DEPDC1的表达与NBNC-HCC临床病例特征的相关性 整理入组的56例NBNC-HCC患者相关临床病例资料,结合DEPDC1免疫组织化学染色和评分情况行统计学分析,以肝癌组织中DEPDC1表达评分的中位数为界值,高于此界值定义为DEPDC1高表达组,低于此界值定义为DEPDC1低表达组。DEPDC1高、低表达组的患者临床特征见表1。肝癌患者在DEPDC1高表达组,其肿瘤分化程度较低表达组低;TNM分级较低表达组晚;甲胎蛋白DEPDC1高表达组明显高于低表达组,差异比较有统计学意义(P<0.05);同时DEPDC1高表达组的微血管癌栓发生率为69.7%,较低表达组34.5%明显增高,差异比较有统计学意义(P<0.05)。DEPDC1表达与肝癌患者年龄、性别、肿瘤大小未见明显关联(P>0.05)。
2.4 DEPDC1的表达与NBNC-HCC预后的相关性 56例NBNC-HCC患者进行预后随访,整理预后信息,在肝癌组织中DEPDC1的高、低表达可较好地预测肝癌患者的预后情况。DEPDC1高表达组患者预后较差(中位总体生存期为42个月),而DEPDC1低表达组患者预后较好(中位总体生存期为56个月),DEPDC1低表达组与高表达组相比,其总体生存期差异有统计学意义(P<0.001,图3)。

表1 DEPDC1表达程度与肿瘤临床病例数据之间的关系

图3 总体生存期曲线
3 讨论
近年来流行病学研究显示,随着抗肝炎病毒药物的不断发展,病毒相关性肝癌的发病率则呈现逐步降低的趋势。相反,NBNC-HCC的发病率逐步升高,占所有肝癌病例的6.8%~17.3%[2]。可以预见NBNC-HCC的治疗将逐步得到重视。由于既往NBNC-HCC在所有肝癌患者中仅占据较少部分,且由于其背景疾病涉及范围较广,包括酒精性肝病、NAFLD、代谢性疾病(糖尿病、高脂血症、含铁血黄素沉积症)等[2],导致其相关临床特点较复杂,研究较少。其与肝炎相关性肝细胞癌在分子机制、细胞通路方面的异同,也缺乏比较研究。
目前,手术切除仍然是治疗肝细胞癌的最有效手段。然而,由于肝癌起病较隐匿,大多数患者确诊时已无法手术切除。由于NBNC-HCC患者背景肝病发病率较高,难以得到重视,早期发现的概率较低,因此有部分研究提示NBNC-HCC患者手术切除率比肝炎病毒相关性肝癌患者低[8]。对于接受手术的患者,术后肿瘤的复发和转移仍然是影响手术效果的首要原因,手术仅仅是治疗的一环,多学科、多手段综合治疗逐步成为主流。基于上述现状,研究NBNC-HCC发生发展过程中的基因变化,筛选药物治疗的靶点,有着重要的临床意义。
DEPDC1基因编码一种高度保守的蛋白,大小约92 kDa。该蛋白作用广泛,涉及转录调控、细胞有丝分裂以及凋亡。其在膀胱癌、前列腺癌、多发骨髓瘤、胶质瘤中均有过表达的报道[9-10],提示此蛋白在肿瘤的发展过程中起到了重要作用。有研究提示,DEPDC1蛋白在微管为靶标的化疗过程中,能够通过JNK依赖的途径,促使BCL-2家族抗凋亡MCL-1蛋白下调,抑制细胞凋亡[11]。膀胱癌中DEPDC1和ZNF-224基因可共同促进NF-κB信号通路表达[12];另有研究表明,DEPDC1蛋白在调节前列腺癌细胞G1期向S期转变过程中发挥重要作用,并通过E2F途径与肿瘤的生长及骨转移关系密切[10]。已有报道提示在肝细胞癌中DEPDC1的表达与预后相关[13]。但在NBNC-HCC患者中,DEPDC1是否与在肝炎病毒相关性肝癌具有同样的促进作用尚无证据。
本研究首先通过实时定量PCR证实在肝癌组织中,DEPDC1基因高表达率为73.2%;免疫组化染色发现肝癌组织DEPDC1染色均呈阳性着色,且肝癌组织中的表达显著高于癌旁组织。表示在NBNC-HCC组织中,DEPDC1的高表达为常态。在DEPDC1高表达组,肿瘤分化程度较低表达组低,TNM分级晚,甲胎蛋白值较高,同时微血管癌栓发生率(69.7%)较低表达组(34.5%)明显增高。目前认为,肿瘤的生物学行为是影响预后的决定性因素,包括肿瘤的分化程度、侵袭性、表面标记、血管形成、免疫逃逸等诸多方面。而TNM、甲胎蛋白、微血管癌栓是分化程度的具体体现。大量研究均表明,甲胎蛋白水平与HCC的分化程度及预后显著相关[14]。同时微血管癌栓的出现导致肿瘤经门脉播散,已被证实是肝癌转移、复发的主要途径。这些都提示DEPDC1基因在NBNC-HCC发展中的作用与肿瘤的生物学行为直接相关。这一结果基本与既往报道的肝炎病毒相关性肝癌中结果类似,提示DEPDC1基因的作用很可能位于多种致癌因素作用最终的共同通路上。
综上所述,本研究从基因及组织学水平检测了NBNC-HCC组织中DEPDC1的表达情况,发现DEPDC1基因在NBNC-HCC组织中高表达,并与肿瘤的分期及分化程度相关。结合既往的研究结果,提示DEPDC1基因在肝细胞癌发展中发挥重要作用,且很可能是多种致癌因素最终的共同通路,有着重要的临床意义。
