化学计算中的守恒思想
2019-02-15史永鑫
史永鑫
(安徽省芜湖市安徽师范大学附属中学 241001)
守恒思想是中学化学计算中最常用的重要解题思想之一,包括质量守恒、原子守恒、得失电子守恒、电荷守恒等方面.其特点是技巧性很强,可以大大简化计算步骤,从而快速解题.例如在Cu、Ag等金属及其合金与HNO3反应的相关计算中可以将守恒思想用到极致.
笔者用来自一线教学中的一道经典例题进行交流,以供读者参考.

(1)稀释后的溶液中HNO3的物质的量浓度.
(2)被还原的HNO3得到的电子的物质的量.
(3)生成NO气体的体积(标准状况).
解析为了审题更直观,首先根据题意写出化学反应的表达式:
Cu+HNO3→Cu(NO3)2+NO2↑+NO↑+H2O
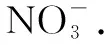
由Cu原子守恒:
n(Cu2+)=n(Cu)=3.2 g/64 g/mol=0.05mol
又根据电荷守恒(溶液的电中性原理):
由于溶液呈酸性,故c(OH-)忽略不计,所以等式:
成立,而H+~HNO3,故n(HNO3)=n(H+)=0.20×1-0.05×2=0.1 mol,即稀释后c(HNO3)=0.1 mol/L.
(2)根据氧化还原反应中得失电子守恒:
被还原的HNO3得到的n(e-)恰好等于反应中Cu失去的n(e-),
即n(e-)HNO3得=n(e-)Cu失=2×0.05mol=0.10mol.
(3)设n(NO)=xmol,n(NO2)=ymol:
分析N原子情况:
反应前n(N)=n(HNO3)前=0.26mol
根据N原子守恒:
x+y+0.20=0.26mol ①
再次利用得失e-守恒:
3x+y=0.10mol ②
联立方程①②解得:
n(NO)=x=0.02mol,n(NO2)=y=0.04mol
标准状况下V(NO)=448mL.
答案:
(1)稀释后c(HNO3)=0.1 mol/L.
(2)被还原的HNO3得n(e)=0.10mol.
(3)标准状况下V(NO)=448mL.
点评本题中两次用到“原子守恒”,两次用到“得失电子守恒”,一次用到“电荷守恒”,守恒思想在这里可谓已经用到极致.
类似习题:
1. 56g Fe粉投入500g稀HNO3中,两者恰好完全反应放出NO,溶液增重26g,则反应后溶液中的金属阳离子为( ).
A.只有Fe3+
B. 只有Fe2+
C.有Fe2+和Fe3+
D.无法确定
答案:A,提示:得失电子守恒
2. 14 g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( ).
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
答案:C,提示:得失电子守恒
3. 某单质能跟浓硝酸反应.若参加反应的单质与硝酸的物质的量之比为1∶4,则该元素在反应中所显示的化合价可能是( ).
A.+1 B.+2 C.+3 D.+4
答案:BD,提示:得失电子守恒,原子守恒
4.将1.92 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( ).
A.1mol B.0.05mol C.1.05mol D.0.11mol
答案:D,提示:Cu原子守恒,N原子守恒
5.1.92 g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况).将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为( ).
A.504mL B.168mL C.336mL D.224mL
答案:C,提示:得失电子守恒
6.在隔绝空气的情况下,9.8 g Fe、Mg混合物溶于一定量某浓度的稀硝酸中,当金属完全溶解后,收集到0.2 mol NO气体,在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为( ).
A.18g B.20g C.22g D. 4.96 g
答案:B,提示:Fe、Mg原子守恒,得失电子守恒