基于肌红蛋白的氧激活蛋白的理性设计
2019-02-15于洋
于 洋
(北京理工大学 化学与化工学院 生化工程系 合成生物系统研究所,北京 100081)
金属蛋白是以含有金属离子或者金属配位化合物作为辅因子的蛋白质。在蛋白质组中,有超过1/3的蛋白质属于金属蛋白[1]。金属蛋白催化了生命活动中的很多重要反应,包括水氧化、氧气还原、固氮、CO2固定等。这些金属酶的催化效率、选择性等往往超过了小分子催化剂,同时具有酶催化固有的反应条件温和、选择性高的特点。由于这些优点,金属酶,如P450单加氧酶、漆酶、裂解性多糖单加氧酶等,也广泛应用在工业生物催化的领域[2-3]。
很多复杂的金属酶,如光系统Ⅱ、细胞色素c氧化酶和固氮酶等分子量很大,大部分酶还是膜蛋白,这为酶蛋白的制备和应用带来了困难[1]。同时,由于这些复杂金属酶中含有多个金属中心,不同金属中心的光谱(紫外-可见光、电子顺磁共振和Mossbauer等)重叠,使得活性中心之外的金属中心往往会干扰针对活性中心的机制研究[4]。
为了克服天然金属酶研究中存在的难于纯化、产量低的问题,化学家通过合成小分子模型化合物,模拟蛋白尤其是金属蛋白的活性中心进行研究,解析酶催化中的关键结构特征。然而,研究者越来越多地发现,蛋白质并非简单作为金属辅酶的容器和配体的提供者,而是通过对金属中心的氢键等非共价相互作用,对金属辅酶进行精细调控,以使其催化性质与功能匹配[1]。构建模型化合物无法完全重现金属中心在蛋白质中的配位环境。
为了将模型化合物易于研究和蛋白质对活性中心精细调控的优势结合,研究者们发展了理性设计构建人工酶的研究方法。通过使用分子量小、结构简单、易于表达的骨架蛋白,模拟天然金属酶的功能,可以大大简化分离纯化的工作量,更重要的是排除天然蛋白中多个辅酶、蛋白亚基的干扰。而蛋白质骨架又方便地提供了通过氨基酸残基精细调控蛋白功能的手段。与小分子化合物相对应,这种在小蛋白骨架中实现复杂天然酶的结构、光谱或者功能特性而得到的突变体,通常称为模型蛋白或者模型人工酶。
金属酶参与的一大类反应涉及氧(O2或者H2O2)的激活[1]。其中,含血红素的蛋白催化了多样的反应(图1)。由图1可以发现,血红素分子能以相对一致的配位环境,高效、高选择性地结合O2或者H2O2,通过相似的中间体,实现对底物1,2或者4电子的氧化,从而催化不同反应。以相似的血红素辅因子实现多样的反应,说明了蛋白质对血红素的性质有精细的调控;而反应中间体和途径的相似性,为不同血红素蛋白之间的相互转换提供了可能。

图1 不同血红素酶通过相似的途径活化O2,催化不同的反应Fig.1 Heme enzymes activate oxygen through similar routes,and catalyze diverse reactions
1 以肌红蛋白为骨架蛋白的氧激活蛋白的理性设计
研究者是否可以基于对天然金属酶的知识,在最简单的血红素蛋白中,通过理性设计,实现其他种类血红素蛋白的催化活性?
在众多含血红素的蛋白质中,肌红蛋白(myoglobin,Mb)是较简单的一个,它的分子量约1.7×104,其结构中含1个血红素分子,是人类最早解析结构的蛋白[5]。而且,它是1个结合O2的蛋白,功能简单,研究也非常透彻。基于这些优势,肌红蛋白是模拟其他血红素酶的最佳起点(图2)[6]。
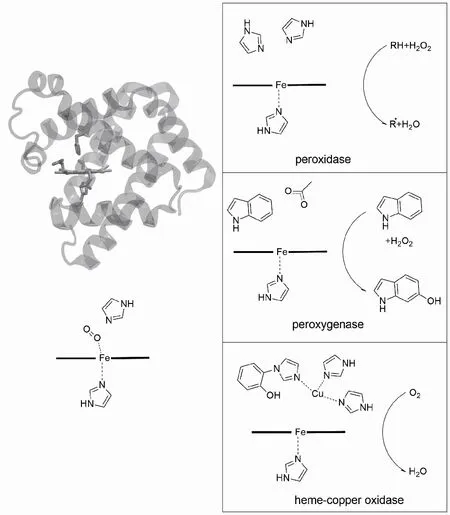
图2 肌红蛋白作为骨架蛋白,模拟多种血红素蛋白的结构功能Fig.2 Many heme enzymes′ function can be realizedin artificial enzymes using myoglobinas scaffold protein
野生型肌红蛋白具有一定的过氧化物酶(peroxidase)的活性[7],但是其活性远低于天然的过氧化物酶。在天然的过氧化物酶中,血红素远端口袋中组氨酸的Nε与Fe的距离是0.55~0.60 nm,而在肌红蛋白中,第64位的组氨酸Nε与Fe的距离仅为0.44 nm。Matsui等[8]通过点突变的方法,系统改变了肌红蛋白中的这一距离。其中,F43H/H64L Mb突变体比野生型的活性提高了11倍,而L29H/H64L的过氧化物酶活性反而降低。Guo等[9]和Dong等[10]在肌红蛋白的远端口袋中保留了原来的64H,引入了另1个组氨酸——L29H,得到的突变体过氧化物酶活性提高了3.7倍,而引入第3个组氨酸F43H不会进一步提高酶活。另一方面,如果移除64H,构建出底物通往血红素中心的分子通道,同时构建出29H和43H,则L29H/F43H/H64A Mb突变体能表现出类似天然过氧化物酶的催化活性[11]。这些研究说明组氨酸在过氧化物酶催化中有重要作用,它在空间上的正确定位可以促进O—O键的异裂,提高过氧化物酶活性。
与过氧化物酶相比,过加氧酶(peroxygenase)和P450单加氧酶(P450 monooxygenase)活化H2O2形成的活性物种CompoundⅠ可以直接与底物反应,催化底物的加氧反应,这类反应常见于天然产物、药物分子的合成中[2]。过加氧酶可以催化底物的直接加氧反应,与P450单加氧酶相比,它可以直接接受过氧化氢,而不需要还原剂或者还原蛋白的作用,因而更加受到工业催化领域研究者的青睐。野生型肌红蛋白缺乏过加氧酶或P450单加氧酶的反应活性。Ohashi等[12]和Garner等[13]通过将肌红蛋白中的血红素替换为席夫碱(salen、salophen)-金属配合物,令其有效催化不对称环氧化及磺化氧化等反应,构建了人工酶。
在单加氧酶中,血红素的远端口袋中有1对常见的带负电氨基酸和含羟基氨基酸,通过氢键与结合的O2作用,将电子“拉”离O2分子,促进O—O键的异裂[14-15]。O—O键的异裂产生的CompoundⅠ(FeIV=O radical物种)是一种强氧化剂,可以直接氧化底物。Yang等[16]通过在肌红蛋白中引入V68D突变模拟P450单加氧酶中的带负电氨基酸,使突变体催化磺化氧化反应的速率提高了1 600倍。在此基础上,Pfister等[17]构建了肌红蛋白F43W/H64D/V68I Mb突变体,通过F43W突变将底物吲哚环作为氨基酸侧链固定在活性中心附近,以H2O2为氧化剂,直接观察到了F43W侧链的羟基化。这一人工酶的构建,也说明了负电氨基酸(64D)对于单加氧酶活性的重要调控作用。
氧化酶位于细胞呼吸链的末端,催化了O2还原为H2O的反应,其催化过程涉及O2的激活、O—O键的异裂、氧的完全还原等步骤(图1)。氧化酶,如细胞色素c氧化酶(CcO)等催化了细胞内90%以上O2的还原,催化速率可以达到50~1 000 s-1[18-19]。它们在高效反应的同时维持了反应的选择性,几乎不产生具有细胞毒性的活性氧中间体(reactive oxygen species,ROS)。CcO作为1个分子量超过4.00×105的蛋白复合体,其O2的还原发生在由血红素和铜离子(CuB)组成的双核中心(图3)。CcO的活性中心具有保守的结构特征,包括由近端组氨酸配位的血红素分子,远端口袋中3个组氨酸配位的CuB铜离子,指向血红素的酪氨酸以及酪氨酸和与CuB配位的1个组氨酸形成的共价交联。

(a)细胞色素c氧化酶的活性中心(PDB ID:1OCC)灰色圆球为铜离子;(b)F33Y-CuBMb(PDB ID:4FWX)和F33imiTyr-CuBMb(浅灰色,计算模拟结构)的比较图3 天然和人工设计的氧化酶的活性中心结构[20]Fig.3 Active site structures of naturaland artificial oxidases[20]
以上从天然蛋白质生化研究和晶体结构中得到的活性中心结构特征指导了将肌红蛋白理性设计为具有活性的氧化酶的研究。Sigman等[21]首先在肌红蛋白中引入了L29H/F43H的突变,新引入的2个组氨酸加上原有的H64,形成了3个组氨酸的结构特征,紫外-可见光谱与晶体结构均证明这一突变体——CuBMb可以结合铜离子,形成CuB中心。进一步在CuBMb中引入酪氨酸(F33Y或G65Y,图3(b))使肌红蛋白可以催化O2还原的反应,成功将肌红蛋白这一储存O2的蛋白转化为人工氧化酶[22]。
然而,CcO中的酪氨酸-组氨酸之间的共价交联是在天然蛋白中自发产生的,无法在肌红蛋白中通过常规的点突变得到。为了在肌红蛋白中模拟这一结构特征,Liu等[20]通过基因密码子扩展的技术,将1个模拟酪氨酸-组氨酸共价交联的非天然氨基酸imiTyr引入肌红蛋白中(图3(b))。所得到的imiTyr-CuBMb人工酶不仅展示了O2还原的活性,而且反应只产生了4%的副产物H2O2,其反应速率和选择性与F33Y-CuBMb相比都有了很大的提高。通过对CcO活性中心结构特征的模拟,研究者在肌红蛋白中实现了氧化酶的活性。人工氧化酶的成功设计也验证了3个组氨酸配位的CuB中心,酪氨酸、酪氨酸和组氨酸共价交联对于氧化酶酶活的作用。
氧化酶模型蛋白也为研究氧化酶的反应机制等提供了一个有力工具。活性中心的酪氨酸作为天然氧化酶中的保守氨基酸,一直被认为在反应中提供了质子和电子,可能形成1个自由基中间体。通过在人工氧化酶F33Y-CuBMb的第33位引入一系列有不同氧化还原电势、pKa的非天然氨基酸,Yu等[23-24]在不对整体结构造成扰动的前提下,精细调整第33位酪氨酸的氧化还原电势、pKa等性质,测试发现突变体的氧化酶活性与酪氨酸的pKa和氧化还原电势呈负相关,说明酪氨酸对于酶活有重要影响,也间接支持了酪氨酸参与反应的假说。Yu等[23,25]通过冷冻终止反应捕捉了F33Y-CuBMb与O2和H2O2反应的中间体,在电子顺磁共振波谱中发现了酪氨酸自由基的存在,并通过将酪氨酸33Y替换为具有不同电子顺磁共振信号的非天然氨基酸,证明了这一自由基位于活性中心的第33位酪氨酸上。这些研究直接证明了活性中心的酪氨酸参与了氧化酶的催化反应,为揭示氧化酶的反应机制提供了新的证据。
基于肌红蛋白的氧化酶模型,蛋白的酶活仅为天然蛋白的1/400或者更低,这种差异很难通过反应活性中心的改造弥补。CcO活性中心之外的结构揭示了天然蛋白有1个高效的电子传递通路,将电子从底物传递到活性中心。类似的,Yu等[26]通过引入还原蛋白,为肌红蛋白高效提供电子,可以提高模型蛋白的电子传递效率,从而将人工氧化酶的酶活提高400倍(50 s-1),达到了天然酶的活性水平。Mukherjee等[27]进一步将肌红蛋白突变体偶联到电极表面,实现电子的高效传递,将氧化酶的酶活大大提高到5 000 s-1,其电化学表现超过了小分子化合物[27]。这些研究也揭示了虽然通过模拟活性中心可以得到人工金属酶,但是提高人工金属酶的酶活还需要考虑电子传递等其他因素。
2 其他血红素酶的改造方法及应用
金属蛋白的设计改造可以通过定向进化、计算机设计、非天然氨基酸引入等多种策略实现。其中,Arnold课题组的Brandenberg等[28]通过定向进化,将P450单加氧酶、细胞色素c等血红素蛋白改造为催化卡宾、氮宾转移的人工酶,实现了环丙烷合成、C—Si、C—C键形成等多个自然界不存在的反应。Sun等[29]发展了组合活性中心饱和突变策略(combinatorial active-site saturation test,CAST)用于定向进化,成功改变了多种工业酶的立体选择性。Liu等[30]通过在荧光蛋白中引入非天然氨基酸,并在蛋白上定点标记Ni配合物,实现了光催化的CO2还原。Das等[31]开发了Rosetta套件作为蛋白质理性设计的有力工具。
血红素酶作为一大类重要的金属酶,在激活O2中经历了一系列共同的中间体,而不同的血红素酶功能的区别往往在于在血红素-氧中间体结构中氢键、疏水相互作用、质子/电子供体的可及性等对于Fe—O配位环境的精细调控不同。与前述的金属蛋白中通过定向进化或者计算设计的思路不同,血红素酶的设计往往依赖通过对于天然酶的结构研究,提取天然血红素酶活性中心的保守结构特征,通过结构特征模拟的策略,在简单的骨架蛋白中模拟多种激活氧的金属蛋白的功能。通过类似的理性设计策略,肌红蛋白还可以模拟一氧化氮还原酶(NOR)[32-33]、羟胺还原酶[34]、亚硝酸盐还原酶等氮氧化物转化相关酶的功能。
血红素酶的设计也可以结合其他方法。例如,Mirts等[35]最近在Rosetta的辅助下在细胞色素c过氧化物酶的血红素结合口袋中设计了铁硫簇的结合位点,模拟了天然的亚硫酸盐还原酶,并通过进一步改造将模拟酶的活性提高到了天然酶的同一量级。Liu等[20]在肌红蛋白中引入非天然氨基酸模拟天然的酪氨酸-组氨酸共价交联,实现了氧化酶的功能。
在实现对天然酶活性、功能的模拟后,模拟酶反过来可以为天然酶的研究提供新的切入点。由于可以在同一个骨架蛋白中模拟不同的酶,研究者在同一个蛋白中比较不同的酶活性和反应机制。通过比较基于肌红蛋白的CcO和NOR的模型蛋白,Bhagi-Damodaran等[36-37]发现活性中心的第2个金属离子对于O—O键断裂或N—N键形成的不同倾向性,而金属离子对血红素中心氧化还原电势的调控在其中起了重要作用,从而阐述了2个非常相似的金属蛋白不同反应性的原理。Wu等[38]通过结构研究发现肌红蛋白中的氢键网络对于其亚硝酸盐还原酶活性非常重要,而同样的氢键网络也可能促进过氧化物酶的活性。
3 总结与展望
综上所述,通过理性设计、引入非天然氨基酸等方法,将天然金属蛋白的结构特征引入肌红蛋白等小分子量、易研究的骨架蛋白中,实现对天然蛋白结构、功能的模拟,可以得到模型蛋白。基于模型蛋白可以进一步对天然蛋白的反应机制等进行研究,得到新的知识,最终形成了设计-构建-测试-学习的闭环。对于氧激活蛋白的模拟和理性设计,不仅推动了对于O2激活反应的机制研究,也产生了一些活性较高,甚至超过天然金属酶活性的人工酶。这些人工酶有望应用于天然产物的选择性氧化、燃料电池的酶电极构建以及催化新反应,实现新分子的合成。
