宫颈高级别病变的HPV分布特征及其在LEEP术后随访中的应用价值探讨
2019-02-15殷啸俊
李 冉 殷啸俊
江苏省昆山市第二人民医院妇产科,江苏昆山 215300
宫颈癌是最常见的妇科恶性肿瘤,宫颈上皮内瘤变(CIN)属于癌前病变,据统计,全世界每年约有1%~2%的妇女被诊断为CINⅡ~CINⅢ。CINⅡ和CINⅢ若不及时治疗有进展为宫颈癌的风险,未经治疗的CINⅡ,有32%可自然消退,56%持续存在,14%疾病进展,超过12%的CINⅢ进展为宫颈癌[1]。因此,对CIN早期治疗是防治宫颈癌的关键。宫颈环形电切术(LEEP)是一种新型的电切疗法,可用于对宫颈癌前病变的早期治疗,具有手术时间短,术中出血少,术后愈合快的优点[2]。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月~2018年12月因阴道镜活检提示宫颈高级别病变而住院行宫颈环形电切术,有完整随访资料的100例患者的临床病例资料。年龄21~68岁,平均(36.8±12.0)岁。纳入标准:治疗前均行HPV检测,首次治疗为宫颈环形电切术,宫颈LEEP病理结果提示切缘阴性。排除标准:存在盆腔放化疗史以及子宫切除病史的;近期服用过免疫抑制药物的;随访依从性差及存在精神异常的。研究均得到患者的知情同意及伦理委员会批准。
1.2 方法
1.2.1 HPV检测 采用人乳头状瘤病毒基因分型(23型)检测试剂盒(产品备案号:浙杭械备20140019号;产品批号17080501;深圳亚能生物技术有限公司提供),采用PCR体外扩增与DNA反向点杂交相结合的DNA芯片技术检测HPV的型别。此试剂盒可检测出6种低危型别HPV(83、6、11、42、43、81),17种高危型别HPV(16、18、31、33、39、35、45、52、51、53、58、59、56、66、68、82、73)。此检测技术具有高度的灵敏度、准确性及特异性,可重复性好。
1.2.2 宫颈环形电切术 手术由在复旦大学附属红房子医院宫颈疾病中心进修,且取得合格证书的医生操作,使用同一台设备(电子阴道镜设备,深圳市金科威实业有限公司,SLC-2000B;环形电切环,美国Ellmar公司,频率为3.8MHz,输出功率为40~50W)。术前碘伏消毒外阴、阴道,宫颈表面碘试验。根据碘不染色区面积大小选择相应型号的宫颈电切环,切除面积为碘不染色区外周3~5mm,切除深度为10~15mm,切除组织标记后送病理检查,报告切缘情况。
1.2.3 病理诊断 采用二级分类法将SIL分为低级别病变和高级别病变,LSIL相当于CINⅠ,HSIL相当于CINⅡ和CINⅢ。
1.2.4 观察指标 统计入选宫颈高级别病变病例中HPV感染的型别及阳性情况,计算HPV的感染率,分析HPV亚型的分布情况;追踪随访患者手术后半年,术后12个月HPV的感染情况,分析术前以及术后HPV感染率的差异,随访登记复诊期间的病变转归情况,分析术后HPV阳性与CIN持续存在和复发的关系。
1.2.5 术后随访 患者术后第一年每3个月复查一次,以后每半年复查一次。疗效判定:宫颈细胞学正常或阴道镜检查正常确定为随诊正常,治疗后半年内无CIN病变存在为治愈,半年内发现CIN病变存在为病变持续存在,治疗半年后发现CIN病变为复发,随访期间定期进行高危HPV检查。
1.3 统计学方法
采用SPSS19.0统计学软件进行数据处理和统计分析,每个随访时间节点HPV的感染率比较采用χ2检验和Fisher精确概率法进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 宫颈高级别病变中HPV的感染率
CINⅡ级58例,HPV阳性率为84.48%,单一感染率为81.63%,双重感染率为16.33%,CINⅢ42例,HPV阳性率为90.48%,单一感染率为84.21%,双重感染率为13.16%,CINⅡ及CINⅢ中HPV感染率比较,差异无统计学意义(P>0.05)。
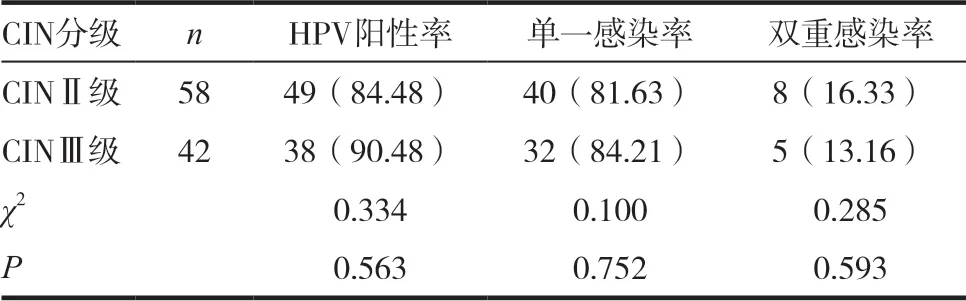
表1 宫颈高级别病变中HPV的感染率[n(%)]
2.2 宫颈高级别病变HPV亚型的分布情况
本研究共检测出12种HPV亚型,其中高危型 有16、18、33、52、31、58、56、39、68、53,低 危 型有6和81型,感染率最高的两种亚型为HPV16及HPV33,构成比为36.78%及25.29%。
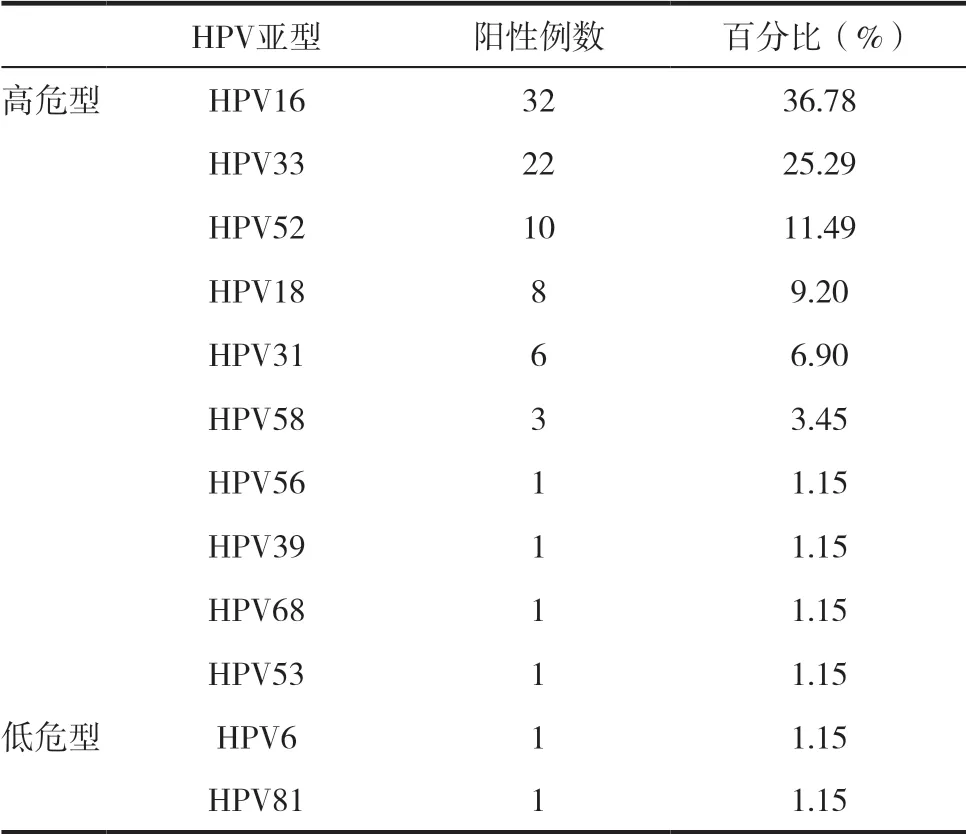
表2 HPV宫颈高级别病变中HPV亚型的分布情况
2.3 宫颈高级别病变手术前后的HPV阳性情况及术后HPV感染与CIN持续存在和复发的关系
所有患者进行了至少6个月的密切随访。患者中HPV的总阳性率术前为87.0%,术后6个月HPV总阳性率为30%,术后12个月HPV总阳性率为12%,差异有统计学意义(χ2=12.246,P=0.000)。CINⅡ及CINⅢ患者的术前及术后HPV阳性率差异均无统计学意义(术前阳性率χ2=0.071,P=0.791;术后6个月阳性率χ2=2.260,P=0.133);术后12个月阳性率(χ2=2.352,P=0.125)。见表3。术后HPV阳性患者,宫颈病变持续存在和复发率明显高于阴性患者,差异有统计学意义(χ2=10.028,P=0.007)。见表4。

表3 手术前后HPV的感染情况比较[n(%)]
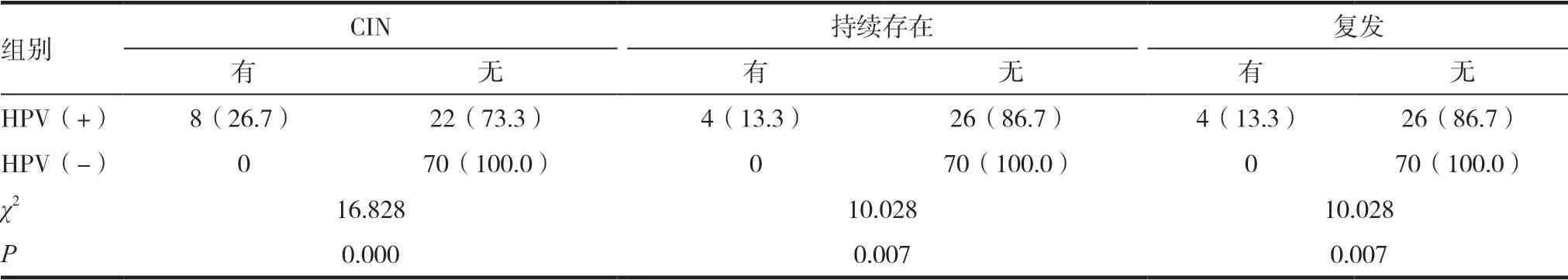
表4 术后HPV感染与CIN持续存在和复发的关系[n(%)]
3 讨论
3.1 HPV感染与宫颈高级别病变的关系
目前的研究已经证实,高危型HPV持续感染是导致宫颈癌发生发展的必要条件[3]。感染HPV的型别、含量及持续时间决定病变的发展与预后,所以HPV检测在宫颈高级别病变中有着至关重要的作用。在本研究中,入选病例都是由高危型HPV的单一感染或者多重感染所致,且单一感染占绝大多数,无HPV低危亚型的单一感染,表明宫颈高级别病变主要由高危型HPV持续感染所致。至于HPV单一感染与多重感染与宫颈疾病的关系,目前意见尚未统一[4-5],有研究表明,多重感染提示机体免疫机制清除病毒不理想,是病毒持续感染的高危因素,容易病变进展,最终发展为宫颈癌。不同HPV亚型对宫颈上皮的致病力不同,且存在较大差异。HPV分型检测对宫颈病变的病因学及早期发现癌前病变具有重要的意义。有研究指出[6],虽然各级别宫颈病变的HPV感染型别存在差异,但HPV16、18、58、33在宫颈高级别病变中具有较高的检测频率,具有较高的致癌性。杜毅新[7]在对512例CIN患者HPV分型检测的报告中指出,HPV阳性率前五位的亚型是HPV16、58、52、33、31。Clifford等[8]也发现某些HPV型别的感染更容易进展为宫颈癌,如HPV16及HPV18。Shi hai Huang等[9]的研究中也发现HPV16或者HPV18在宫颈高级别病变中所占的比率较高。Zoltan Hernad等[10]的研究表示HPV16或者HPV18持续感染30个月后发展为宫颈高级别病变的风险是其它亚型的200倍。本研究表明,宫颈高级别病变的HPV感染,以单一感染占绝大多数,其次为二重感染,三重感染率极少,与既往报道基本一致。本研究中宫颈高级别病变的感染亚型,感染率最高的为HPV16及HPV33。有研究证实[11],HPV33与HPV16关系紧密,为HPV16相关亚型,属于同一种系。对于这两个亚型感染的患者,应密切随访,及早发现宫颈病变并给予积极治疗。
3.2 宫颈锥切术后HPV的随访
近年来,由于宫颈三阶梯筛查的普及,细胞学异常及HPV16/18阳性-阴道镜-宫颈活检的规范筛查流程,宫颈上皮内瘤变的检出率逐渐提高。有研究表明,宫颈高级别病变若不及时治疗,约有66%的患者会进展为原位癌,2%进展为浸润癌,发生宫颈癌的风险是正常妇女的4~5倍[11],而宫颈上皮内瘤变进展为宫颈癌约需要10年左右的时间,因此针对宫颈上皮内瘤变进行及早诊断和治疗可有效的预防疾病进展为宫颈癌。LEEP手术在20世纪90年代首先兴起于欧美国家,并广泛应用于治疗宫颈病变。其原理为高频电刀接触宫颈组织产生阻抗,引起局部高热,快速切割组织,并可以有效的止血。其优点是手术简单,易操作,标本边缘碳化少,出血少,手术时间短,已有多数研究证实,LEEP手术不仅和宫颈冷刀锥切术一样可以切除CIN病灶,甚至比宫颈冷刀锥切术能更好的去除HPV病毒。目前宫颈锥切术作为宫颈高级别病变治疗的首选已得到普遍认可,但术后仍有1% ~ 25%的失败率[12-13],故锥切术后随访非常重要。对宫颈锥切术后HPV感染的情况进行随访,有助于了解高危患者治疗后的病变进展情况,及早发现病变的残留以及复发。Lee JK等[14]报道了行宫颈锥切治疗且手术切缘阴性的患者在术后6个月HPV检测的结果,HPV的转阴率为82.6%。KIM等[15-16]对287例接受宫颈锥切手术且术后切缘阴性的患者进行追踪随访,在术后6个月时HPV的转阴率为85.7%,本研究的研究结果表明,LEPP术后6个月HPV的转阴率为70%,术后12个月的转阴率为88%,术后半年内转阴率略低于报道水平,考虑与样本量局限与感染型别不同,清除速率不同有关。鉴于宫颈高级别病变治疗后HPV 的消退需要一定的时间,HPV在术后半年的消退最明显,随着随访时间的延长,HPV消退的速度逐渐增加,有报道术后2年,HPV清除率高达99%,故手术治疗后不需要急于复查HPV,可等待至术后半年再复查。本研究追踪术后HPV阳性与宫颈病变持续存在或者复发的关系,也采用了术后半年的时间节点。结果证实,术后HPV阴性患者病变持续存在或复发的风险相对较低,可以减少随访次数,HPV持续阳性者复发风险高。
总之,对于宫颈高级别病变,可积极行LEEP手术治疗,避免病变进展为癌,术后加强HPV的监测随访,及早发现病变残留或者复发。
