以髓源抑制性细胞为靶点的竹荪多糖抗肿瘤机制研究
2019-02-15王小红
江 洪 王小红
1.杭州市第一人民医院,浙江杭州 310006;2.浙江省肿瘤医院,浙江杭州 310022
目前肿瘤的常规治疗方法为手术切除、放疗和化疗,尽管取得了一些进展,但诸如肺癌等治疗效果不佳,而且肿瘤复发和转移是困扰临床肿瘤治疗的普遍难题,究其原因,在于现有治疗的目标仍然集中在肿瘤细胞本身,而忽略了其微环境的重要性。肿瘤微环境与肿瘤细胞之间是“土壤与种子”的关系,肿瘤恶变过程,就是肿瘤细胞与其微环境共进化的过程,其结果就是肿瘤细胞实现免疫逃逸,接触肿瘤微环境中的免疫负调控状态,成为肿瘤治疗的新策略。
髓样抑制性细胞(myeloid derived suppressor cells, MDSC)诱导的免疫抑制是导致免疫治疗失败的重要原因。近年来研究发现,在荷瘤小鼠或者肿瘤患者的主要免疫器官内存在大量的免疫抑制细胞。这群细胞伴随着肿瘤的生长在肿瘤部位、血液、外周淋巴器官以及骨髓中逐渐聚集。它们主要是处于不同分化阶段的骨髓来源的细胞,如未成熟的巨噬细胞、粒细胞、树突状细胞以及骨髓前体细胞,它们往往共同表达CD11b和Gr1标志,通过抑制CD4+和CD8+T细胞的功能以及促进肿瘤血管的新生来发挥作用,被称为髓样抑制性细胞或骨髓来源的抑制性细胞(myeloid derived suppressor cells, MDSC)[1-4]。研究表明MDSC主要通过抑制CD4+、CD8+T细胞的功能和促进肿瘤新血管形成而发挥作用[5-6]。
诱导MDSC成熟分化有助于肿瘤排斥。目前尝试用来清除MDSC或阻断其功能的方法很多,但效果并不十分理想。其中包括抗体介导的细胞清除、促进MDSC分化成熟和选择性阻断MDSC发挥功能的分子途径等[7-9]。Suzuki等[10]用Gemcitabine选择性减少荷瘤鼠的脾脏MDSC,增强了小鼠的抗肿瘤免疫反应,小鼠肿瘤发生率下降。Kusmartsev等[11]使用ARTA在体内促进荷瘤鼠MDSC分化为成熟的树突状细胞 (DC)、巨噬细胞、粒细胞,增强CD4和CD8介导的抗肿瘤免疫反应,延长肿瘤疫苗作用时间。De Santo等[12]对能影响MDSC精氨酸代谢但毒性较小的Nitro aspirin进行了Ⅰ/Ⅱ期临床实验,显示它具有一定的应用前景。然而,因为这些药物或抑制剂有较大的副作用,限制了其在患者体内的应用。此外,有研究尝试用抗小鼠Gr1单克隆抗体RB6-8c5清除荷瘤小鼠体内的Gr1阳性细胞,也能取得一定抗肿瘤效果。但是这种方法也存在不足,因为除MDSC以外的大量嗜中性粒细胞也表达Gr1,体内去除嗜中性粒细胞后宿主容易并发感染;并且非连续性应用单克隆抗体容易导致MDSC数量反弹。总之,目前仍无有效的方法来消除MDSC的免疫抑制功能进而用于肿瘤治疗。
真菌多糖具有诱导MDSC成熟分化的潜质。已有的研究结果显示[13],分离自香菇的多糖MPSSS对MDSC具有良好的促分化作用,可有效降低荷瘤小鼠MDSC在脾细胞中的比例,促进其成熟分化为M1型巨噬细胞,并可以逆转MDSC对CD4+T细胞增殖的抑制作用。分离自莪术及雪菊的多糖也有类似恢复T细胞增殖的效应[14-15]。
本课题组前期发现竹荪多糖具有体内抗肿瘤效应,而靶向MDSC已成为新的肿瘤治疗策略,因此拟从微环境的角度,研究竹荪多糖对MDSC的效应及分子机制。本研究的开展将为竹荪多糖在肿瘤治疗中的应用提供新思路。
1 材料与方法
1.1 实验材料
竹荪粗多糖购自杭州众芝康菇生物科技有限公司。CD11b抗体、Gr1抗体、Ly6C抗体购自美国BD公司。1640培养基购自美国Gibco公司。新生小牛血清(NCS)购自杭州四季青公司。胎牛血清(FBS)购自德国PAN公司。链霉素、青霉素(100U/ml)购自北京鼎国生物公司。红细胞裂解液(RLB)购自美国Sigma公司。流式细胞分析仪(FACSCalibur,美国BD公司)、流式细胞分选仪(FACSAria,美国BD公司)、电热恒温干燥箱(天津泰斯特公司)、酶标仪(美国Bio-Rad公司)、显微镜(CKX41,日本奥林巴斯公司)、4℃离心机及吊篮式离心机(美国Beckman)、高速低温离心机Thermo Micro21R(美国hermo公司)、超纯水制备系统(美国Millipore)、超净工作台(哈东联)、傅里叶变换红外光谱Vector 33型(德国 Bruck 公司),C57BL/6小鼠和BALB/c小鼠采购自北京维特利华公司。
1.2 竹荪粗多糖的制备
实验原材料竹荪粗多糖由杭州众芝康菇生物科技有限公司提取,具体方法如下:取1kg竹荪,加入水10L,沸水提取,时间2h。加热浓缩至小体积,对流动水透析48h,透析内液浓缩后离心,1∶1加入30%的三氯乙酸溶液,在4℃条件下反应4h,加10% NaOH溶液中和至pH 7左右,扎袋对流动水透析48h,透析内液浓缩后离心,上清液加入3倍体积的无水乙醇,静置过夜。离心收集沉淀,于40℃干燥,得粗多糖。
1.3 竹荪多糖的提纯
竹荪粗多糖溶于水中,用15%乙醇再次醇沉,10000rpm离心5min,取上清,放入烘箱中烘干,得到15%醇沉的竹荪多糖上清干燥物,命名为DP15。
1.4 竹荪多糖的光谱扫描
红外光谱法是真菌多糖鉴定初级结构中常用的工具,用于分析多糖的糖环构想和糖苷键的类型。称取2mg竹荪多糖 DP15,与适量的KBr粉末混合,研磨均匀后进行压片。将制好的压片放入红外光谱仪内进行扫描,扫描区间为400~4000cm-1,用 Nexus 系统软件对采集到红外吸收图谱进行分析。
1.5 竹荪多糖对肺癌荷瘤小鼠的抗肿瘤作用的体内外实验
1.5.1 肺癌荷瘤小鼠模型构建 路易斯肺癌细胞系LLC皮下接种于C57BL/6小鼠皮下,接种密度均为1×106/只,构建移植瘤模型。本实验经杭州市第一人民医院生物安全与伦理委员会批准。
1.5.2 竹荪多糖DP15作用于LLC荷瘤小鼠的生存率的观察实验 将构建好的LLC荷瘤小鼠模型进行处理,分为实验组和对照组,实验组10只小鼠,对照组18只小鼠;实验组腹腔注射DP15(25mg/kg),每3天一次;对照组腹腔注射1640+/+培养液(25mg/kg);定期查看荷瘤小鼠的生存情况,观察时间为41d。
1.5.3 竹荪多糖DP15作用于LLC荷瘤小鼠的肿瘤体积的观察实验 将构建好的LLC荷瘤小鼠模型进行处理,分为实验组和对照组,每组5只小鼠;实验组腹腔注射DP15(25mg/kg),每3天一次,对照组腹腔注射1640+/+培养液(25mg/kg);定期测量荷瘤小鼠的肿瘤生长情况,观察时间为25d;肿瘤体积(mm3)计算公式为:长×宽×高。
1.5.4 LLC荷瘤小鼠的脾细胞悬液的制备 LLC荷瘤小鼠制备21d后,深度麻醉处死小鼠;取小鼠脾脏在PBS缓冲液中进行研磨,经100目滤网过滤后离心(1500r/min)3min,去上清;加入红细胞裂解液(RLB)裂解1min,加入5mL PBS重悬,过滤后离心(1500r/min)3min,去上清;加入1640+/+培养基重悬,细胞板计数得到细胞液浓度,加入1640+/+培养基调至所需终浓度,得到脾脏单细胞悬液。
1.5.5 光镜下直接观察竹荪多糖DP15作用于LLC荷瘤小鼠脾细胞的形态变化 取生长状态良好的LLC荷瘤小鼠的脾细胞悬液,以4×106个细胞/孔,接种于12孔细胞培养板上,培养基为1640+/+;实验组加入1.2mL的125μg/mL的竹荪多糖DP15,对照组加入等量的1640+/+,37℃、5% CO2培养箱中培养,每3天后更换一次培养基;10d后光镜下观察LLC荷瘤小鼠脾细胞的形态变化。
1.5.6 流式细胞学检测竹荪多糖DP15作用于LLC荷瘤小鼠的脾细胞的MDSC的比例变化 接种于24孔细胞培养板,抗体为Gr1、CD11b,竹荪多糖DP15的浓度为0.1mg/mL。
1.5.7 流式细胞学检测不同浓度的竹荪多糖DP15作用于LLC荷瘤小鼠的脾细胞的MDSC的亚群比例变化 脾细胞接种于24孔细胞培养板,接种密度为2×106/孔,37℃、5% CO2培养箱培养72h,抗体为CD11b、Ly6C,竹荪多糖DP15的浓度分别为125,250和500μg/mL。
1.6 竹荪多糖作用于MDSC的信号通路研究
LLC荷瘤小鼠的脾细胞悬液,经流式细胞分选仪分选出CD11b和Gr1双阳性细胞,按1×106个细胞/孔,接种于12孔细胞培养板上,培养基为1640+/+;实验组加入1.2mL的不同浓度的竹荪多糖DP15(125μg/mL,250μg/mL和500μg/mL),检测P53基因和Bcl-2的表达变化;还观察了固定浓度(125μg/mL)DP15作用下,不同时间点(16h,24h和48h)P53基因表达的变化。对照组加入等量的1640+/+,37℃、5% CO2培养箱中培养。
MDSC细胞经过竹荪多糖DP15做上述处理后,用RIPA细胞裂解液进行裂解,置冰中40min后,先各取1μL蛋白待测,再加入4×Loading Buffer,100℃加热10min后放入-80℃冷藏。将待测蛋白稀释至50μL,并配置BSA及AB液,60℃放置15min后用酶标仪测量562nm处吸光值。测得数值代入公式计算蛋白上样量。配置10%和12% SDS-PAGE(聚丙烯酰胺)凝胶电泳分离胶,电泳分离,80V恒压电泳至溴酚蓝跑出。取出胶体转膜,100V恒压电泳70min后将胶转得膜中目标蛋白相应位置所在条带剪下。用3% BSA封闭1h后,分别按比例配置、加入目标蛋白的相关一抗4℃孵育过夜,80min后洗5×5min,再加入目标蛋白对应二抗。60min后洗5×5min,取出条带,加入显影液后置于曝光仪中进行曝光。
1.7 统计学分析
2 结果
2.1 竹荪多糖的红外光谱分析
竹荪多糖DP15的光谱扫描结果显示在3600~3200cm-1之间的吸收峰,主要是由多糖羟基的伸缩振动引起的,2800cm-1附近的吸收峰是C-H伸缩振动引起的,1600cm-1附近的吸收峰可能是因为水的存在,1000cm-1附近的吸收峰是由于吡喃环中的伸缩振动引起的,800cm-1附近的吸收峰表明 β-葡萄吡喃糖存在。见图1。

图1 竹荪多糖DP15的红外扫描结果
2.2 体内抗肿瘤实验
实验组竹荪多糖DP15作用于LLC荷瘤小鼠的生存时间较对照组明显延长,实验组与对照组比较,差异具有统计学意义(P<0.01)。见图2A。竹荪多糖DP15作用于LLC荷瘤小鼠的肿瘤体积明显小于对照组,实验组与对照组比较,差异具有统计学意义(P<0.05)。见图2B。
2.3 竹荪多糖作用下脾细胞的形态
光镜下直接观察竹荪多糖DP15作用于LLC荷瘤小鼠脾细胞的形态变化,结果显示DP15可诱导荷瘤小鼠脾脏贴壁细胞发生分支状改变,而对照组贴壁细胞呈圆形。见图3。
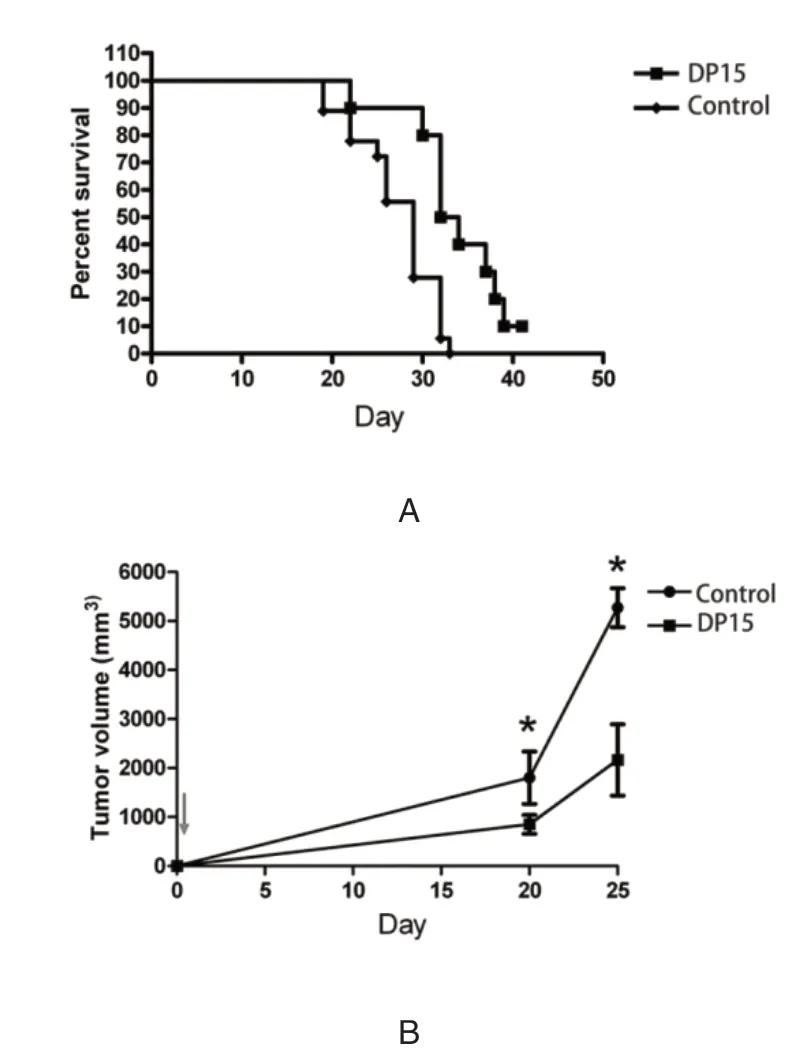
图2 竹荪多糖DP15组和对照组作用于LLC荷瘤小鼠的生存率及肿瘤体积的变化
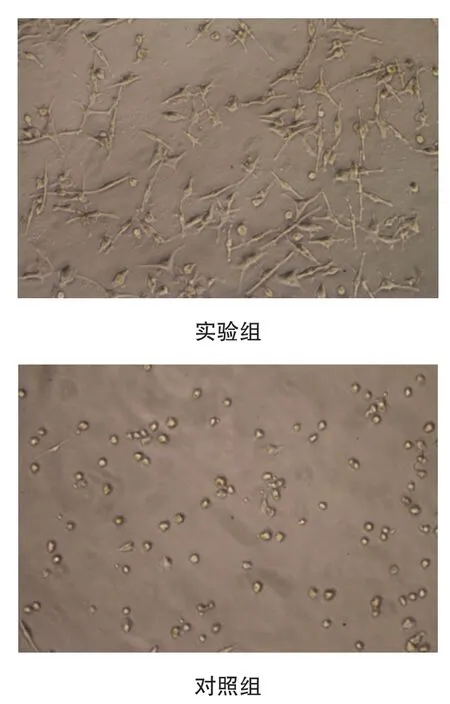
图3 竹荪多糖DP15体外诱导荷瘤小鼠脾脏贴壁细胞发生分支状改变
2.4 竹荪多糖作用后MDSC比例
流式细胞学检测竹荪多糖DP15作用于LLC荷瘤小鼠的脾细胞的MDSC的比例变化,结果显示DP15可显著下调CD11b+Gr1+细胞比例(DP15组与对照组为:44% vs 77%)。见图4。
2.5 竹荪多糖作用后MDSC亚群
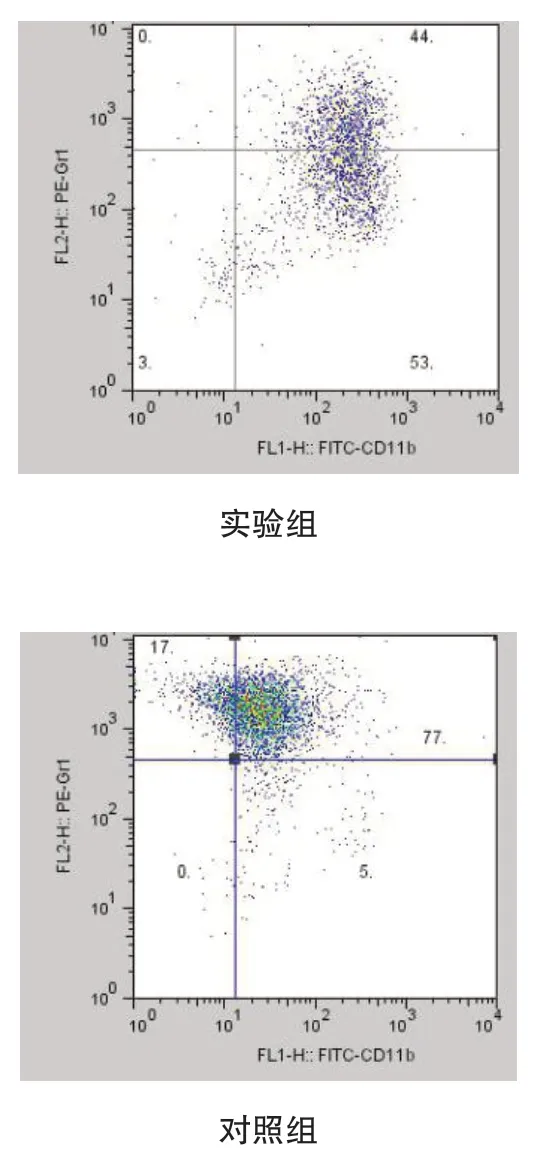
图4 竹荪多糖DP15明显下调体外培养荷瘤小鼠脾细胞中CD11b+Gr1+细胞的比例
流式细胞学检测不同浓度竹荪多糖DP15作用于LLC荷瘤小鼠的脾细胞的MDSC的比例变化,结果显示DP15可显著影响多个细胞亚群的比例,其中CD11b-亚群比例下降,CD11b+Ly6Chigh和CD11b+LY6Cint亚群比例上升,且呈现剂量-效应关系。见图5。

图5 竹荪多糖DP15诱导荷瘤小鼠MDSC亚群分化
2.6 信号通路研究
竹荪多糖DP15通过上调P53基因表达水平及下调Bcl-2基因表达水平促进MDSC发生凋亡(图6)。
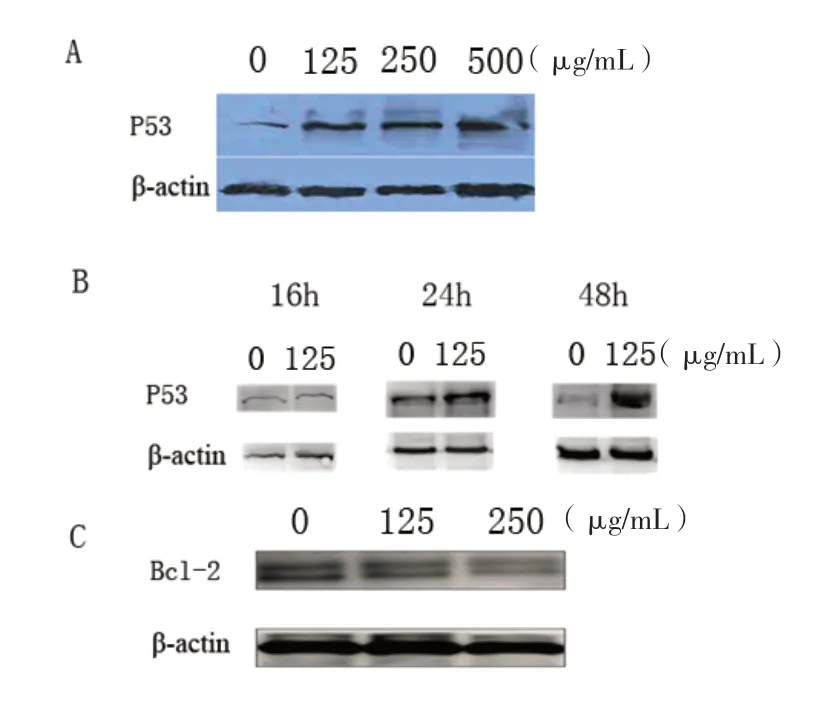
图6 竹荪多糖DP15可上调LLC荷瘤小鼠脾脏中MDSC的P53基因表达水平及下调Bcl-2基因表达水平
3 讨论
单纯依靠化疗药物杀伤癌细胞具有很大的局限性,也容易导致正常细胞的损伤,依靠生物活性因子激活免疫细胞,通过免疫细胞杀伤癌细胞造成的免疫杀伤是治疗癌症的发展方向,因此抗肿瘤活性因子及新型药物具有迫切的技术市场需求。
MDSC主要是处于不同分化阶段的骨髓来源的细胞,如未成熟的巨噬细胞、粒细胞、树突状细胞以及骨髓前体细胞,它们往往共同表达CD11b 和Gr1 标志,主要通过抑制CD4+、CD8+T细胞的功能和促进肿瘤新生血管形成而发挥作用。诱导MDSC的成熟分化有助于抑制肿瘤生长[16]。
竹荪中活性的成分较多,多糖是其中具有较高活性的一种大分子物质,目前研究发现竹荪多糖具有抗肿瘤作用[17-19]。Ukai等[20]研究发现竹荪多糖T-4-N(相对分子质量5.5×106)、T-5-N(相对分子质量5.5×106)在小鼠体内5mg/kg用量下即可抑制S180皮下移植瘤的生长(抑制率为58%);Zhong等[21]发现竹荪多糖PDI(相对分子质量6.5×104)在体外直接抑制S180细胞生长,用5mg/mL处理S180细胞72h后,对S180抑制率为13.9%,并诱导其凋亡增加及阻滞细胞周期有关,该效应与凋亡相关基因 Bcl-2、Bax、P53 及细胞周期蛋白 Cy-clin D、CDK4 相关;Deng等[22]发现竹荪多糖PD3(相对分子质量5×105)可在体内抑制S180细胞生长,但在体外模型中对S180没有抑制作用,该研究推测PD3 不是依靠细胞毒性杀伤肿瘤细胞,而是激活了机体免疫细胞,从而发挥间接杀伤肿瘤的作用,研究 RPD3 抑制 S180 的活性,结果发现 RPD3 抑瘤效应更强,RPD3 是 PD3 经 NaOH 处理后变性再透析脱碱复性的产物,结构分析显示 RPD3的糖链结构更松散,研究者推测这种结构变化有利于暴露出更多的侧链结构,从而更多的结合免疫细胞表面的相应受体,刺激细胞增殖; Liao等[23]通过研究竹荪多糖与锌的螯合物DP1-Zn,发现其浓度增加至250μg/mL时剂量依赖性的显著抑制人类乳腺癌细胞MCF-7细胞的生长,虽然对于人类正常细胞,此浓度的DP1-Zn会引起一定程度的细胞凋亡,但是相比于它对癌细胞的细胞毒性还是安全的,基于上述结果,MCF-7细胞可以作为靶细胞系进一步评估DP1-Zn的抗肿瘤活性。
本研究结果显示DP15可显著下调CD11b+和Gr1+细胞比例,DP15对MDSC多个亚群的效应存在差异。进一步运用Western Blot检测其相关的凋亡基因如P53和Bcl-2,发现P53表达上调而Bcl-2表达下调,说明DP15是通过诱导MDSC凋亡而下调其比例。后续将检测竹荪多糖刺激MDSC后信号通路蛋白因子如STAT1,STAT3,STAT6的变化及重要的核转录因子NF-κB的变化进一步研究其分子机制。
4 结论
DP15通过诱导MDSC凋亡从而下调MDSC比例,从而发挥抗肿瘤效应。
