中枢神经系统血管炎的影像特征及研究进展
2019-02-14柴圣婷
柴圣婷 夏 爽*
中枢神经系统 (central nervous system,CNS)血管炎是一组表现为炎症和破坏性特点的脑血管炎性病变,可累及任何大小的血管,具体发病机制尚不清楚。病人的临床表现缺乏特异性,病情的轻重和进展情况各异,缺乏特异性的实验室检查指标。传统的血管造影被认为是诊断疾病的最佳成像工具,但通常只能显示管腔形态的不规则和狭窄。脑活检可能是唯一有价值的诊断手段,但可能出现假阴性的结果。MR高分辨力血管壁成像(high-resolution vessel wall imaging,HR-VWI)作为一种无创性的检查方法,在CNS血管炎的诊断及疗效监测方面具有重要价值。本文就CNS血管炎的诊断标准、影像特征及HR-VWI在鉴别诊断和治疗随访方面的应用予以综述。
1 CNS血管炎的分类及诊断标准
1.1 分类及病变类型 文献中对CNS血管炎有多种分类方案,如根据病理学CNS血管炎可分为肉芽肿性、淋巴细胞性和坏死性血管炎[1-2]。根据病因学可分为原发性中枢神经系统血管炎(primary angiitis of the central nervous system ,PACNS)和继发性 CNS血管炎。当血管炎局限于脑、脑膜或者脊髓时,被称为PACNS,是一种非动脉粥样硬化性的管壁炎症和坏死性病变,常累及柔脑膜和脑实质的中小血管[1]。继发性CNS血管炎为系统性或全身性疾病,如系统性红斑性狼疮、风湿性关节炎、硬皮病、皮肌炎、重叠性胶原病和干燥综合征等自身免疫疾病所引起的血管炎,以及感染、药物和肿瘤相关的过敏性血管炎。根据CNS血管炎累及血管的大小分为大、中、小血管炎。颅内大血管包括颈内动脉、基底动脉、椎动脉颅内段、大脑中动脉的M1段、大脑前动脉的A1段及大脑后动脉的P1段等,其病变主要为巨细胞性动脉炎和大动脉炎;中血管是指与大脑中动脉分叉远端管径大小相似的血管,中血管炎主要见于结节性多动脉炎和川崎病;小血管是指超出数字减影血管造影(DSA)分辨力的血管,小血管炎包括IgA血管炎、Behcet病、Cogan综合征、显微镜下多血管炎、嗜酸性肉芽肿性多动脉炎等[3]。而不同类型的血管炎在血管的大小上会有重叠。
1.2 诊断标准 基于临床经验和已发表文献的证据提出的PACNS的诊断标准,虽然没有经过验证,但已经被广泛应用于临床研究和观察中,具体为:①表现为获得性的无法解释的神经或者精神缺损症状;②脑血管造影具有典型的血管炎特征或者脑活检样本证实为血管炎;③除外系统性血管炎和其他造成相似血管造影或病理特征的疾病。诊断继发性CNS血管炎通常是直接通过组织活检证实,或者基于一种全身性炎症或者感染性病变的基础上间接通过影像方法来诊断。
PACNS因其临床表现多样,缺乏特异性的诊断标志物,证实诊断需要进行活检。毋庸置疑,组织病理学证据是诊断PACNS的金标准,但在一些神经影像上表现为复发性脑卒中和血管异常的病人中,阳性活检的结果可能较低。因此,诊断标准允许在缺乏其他病因的情况下基于血管成像做出诊断。最近Schuster等[4]的研究将PACNS按照MR检查[包括常规MRI和MR血管成像(MRA)]的特征分为2个亚型,指导选择确诊手段。该研究认为在神经影像上表现为脑实质和柔脑膜强化或者肿块样病变的小血管PACNS的病人建议选择脑组织活检,发生在大血管的PACNS活检的价值可能不大,因为假阴性率较高,这可能是由于血管炎性病变局限于颅内近端或者中等大小的血管,而这些区域脑活检并没有包含覆盖,因而建议选择其他无创检查手段,如 HR-VWI。
2 不同影像技术对诊断CNS血管炎的价值
颅内血管管径相对细小,大脑中动脉的管径为3~5 mm,管壁厚度 0.5~0.7 mm,加之颅内血管扭曲,方向多变,因此需要高信噪比的亚毫米级的空间分辨力成像工具,以获得良好的影像对比来准确评估管壁。
2.1 传统管腔成像 DSA、CT血管成像 (CTA)和MRA可观察管腔形态变化,确定病变累及范围,准确描绘血管狭窄、血管闭塞和血管瘤。传统血管造影的分辨率(0.2 mm)和时间分辨率(0.25 s)均为当前应用的成像技术中最佳,被认为是诊断PACNS的最佳成像工具。PACNS典型的DSA表现包括交替出现的狭窄和扩张,形似串珠,可以是光滑或不规则的,通常发生在双侧但也可出现在单支血管[2,5]。在血管炎中其他的变化可包括动脉瘤、多个分支的孤立性的血管狭窄区、圆周样或者偏心性的血管异常以及突然中断的多发的闭塞。
管腔成像只能够提供管腔形态的改变,不能反映造成其形态特征的病理过程和机制。很多血管病变如可逆性脑血管收缩综合征(reversible cerebral vasoconstriction syndrome,RCVS)、Moyamoya病、颅内动脉粥样硬化、动脉夹层、放射相关的血管病等都可有相似的管腔形态改变[6]。发生在大血管的脑血管炎早期改变不是很明显,因管腔的轻度变化相对于大血管很难观察到。DSA在检测小动脉病变方面的分辨率则优于CTA和MRA,但对于管径<0.2 mm的低于其分辨率的血管显示不佳,因此小血管炎常常难以发现。总之,脑血管造影作为PACNS诊断标准有其局限性,敏感度为40%~90%,特异度也较低(30%)[1]。此外,DSA 是一种有创性检查方法,有一定的风险性以及射线暴露和对比剂毒性。
2.2 超声 灰阶超声和彩色多普勒超声已被证明是评估巨细胞动脉炎的理想方法。灰阶超声具有较高的分辨率(约为0.1 mm),能够显示小血管及管壁的细节。彩色多普勒超声能够提供血流信息。在急性颞动脉炎时,颞动脉水肿的管壁表现为低回声特征,称为“晕征”[7],大部分病人用皮质醇类固醇激素治疗1~3周后消失。此外,尽管超声有助于对浅表异常动脉活检位置的选定,但其不能穿透骨,故仅局限于颅外脑血管检查。
2.3 正电子发射体层成像 (PET)/CT 氟脱氧葡萄糖(FDG)PET可以检测葡萄糖的利用并显示局部代谢情况,能够较好地反映管径>4 mm的血管的炎性改变。系统性红斑性狼疮主要在顶叶及顶枕区出现低代谢。当临床表现和其他影像特征不具特异性时,PET/CT有助于证实血管炎性病变的存在。另外,PET/CT也有助于随访和监测疾病的活动性[8]。PET在检测系统性或者全身性大血管炎方面非常敏感,但是由于其低空间分辨率以及邻近脑实质的摄取增加而不适用于CNS血管炎的评估。
2.4 HR-VWI 近年来颅内三维(3D)血管壁成像技术的应用逐步增加。3D采集能通过增加脑覆盖面积以及运用各向同性扫描,可以在任何平面重建各向同性体积采集,这对于扭曲的颅内血管是优势。虽然二维(2D)和3D技术都有很高的空间分辨率,但3D技术的分辨率能高达0.4 mm3[9]。为了更好地显示颅内管壁特征,充分抑制颅内动脉血流信号尤为重要,由此产生的技术称“黑血技术”。大多数黑血MR技术都是通过抑制颅内血流信号来清楚地显示管壁,为了更好地观察外壁特征,抑制颅内血管周围的脑脊液信号也很重要。获得黑血成像的方法包括双反转恢复序列、四反转恢复序列、基于运动感知预脉冲的序列、自旋回波技术以及3D可变重聚焦翻转角 (v ariable refocusing flip angle,VRFA)序列等。3D-VRFA是迄今为止应用最广泛的3D技术。早期的研究主要集中在T1高分辨力MRI,它能够实现黑血和黑脑脊液,从而清楚地描述管壁。此外,T1高分辨力MRI能在注射钆对比剂后评估管壁强化特征。
HR-VWI是诊断累及大中血管的CNS血管炎的重要工具。关于CNS血管炎的血管壁影像特征已有了初步的共识。研究[10-14]发现血管炎通常表现为节段性多血管累及的特征,受累血管的典型特征表现为光滑、明显、均匀的向心性强化(图1)。这种表现是与动脉粥样硬化性病变 (偏心不均匀强化)和RCVS(无或者轻度强化)鉴别的一个关键点。而最近有文献[15]报道,在CNS淋巴瘤的病人中颅内血管壁也可表现为向心性强化,这表明管壁向心性强化的特征具有相对低的特异性。值得注意的是,CNS血管炎也可表现为光滑偏心性管壁增厚和强化[11]。但Schuster等[4]报道,活检证实的PACNS并没有观察到管壁的强化,甚至在疾病的后续进程中14例病人中仅有3例出现管壁的明显强化,这可能还是由于炎症累及较小血管超出了管壁成像的分辨能力。
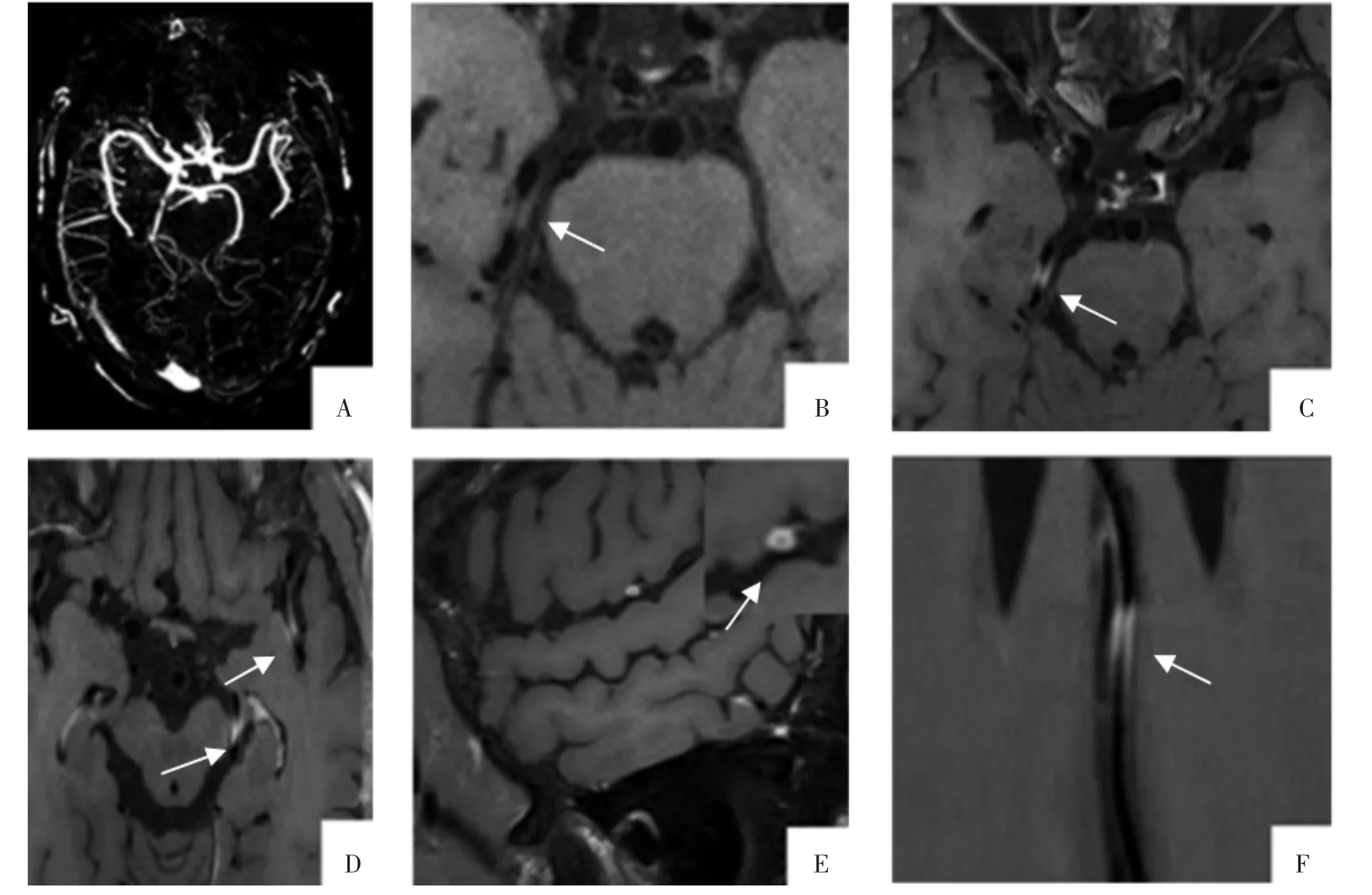
图1 病人男,49岁,右侧肢体活动障碍伴言语不利3个月,诊为CNS血管炎。A图 MRA示左侧大脑中动脉所在区域侧支循环较对侧减少。右侧大脑后动脉横断面T1WVWI增强前(B图)及增强后(C图)显示P2段局部管壁增厚并呈明显强化。D图 横断面增强示左侧大脑中动脉M2段、大脑后动脉P2段管壁呈节段性向心性明显强化。E图 矢状面增强见左侧大脑中动脉M3段管壁呈光滑圆周样向心性强化。F图 多平面重组示右侧大脑前动脉A3段管壁呈节段性向心性明显强化。
3 HR-VWI在CNS血管炎的鉴别诊断和治疗随访中的价值
3.1 CNS血管炎的主要鉴别诊断 PACNS与颅内动脉粥样硬化、Moyamoya病、RCVS鉴别有一定难度,但狭窄变化随着时间而自发演变的过程可能有助于鉴别,如PACNS在几个月的时间可能会进展,颅内动脉粥样硬化和烟雾病相对稳定,RCVS可能会消退。PACNS如果不及时治疗可能会导致卒中,甚至死亡。因此,早期诊断并在确诊的病例中进行免疫抑制治疗至关重要。
3.1.1 RCVS RCVS是类自限性疾病,表现为突发的反复发作的雷击样头痛,伴或不伴其他的神经系统症状,多是由于软脑膜血管或Willis环收缩所致。一些典型的RCVS的病例可通过已知的诊断标准与CNS血管炎相鉴别,但对于临床上有些难以鉴别的病例,血管造影的结果往往不能提供更多的诊断信息。颅内血管壁成像显示管壁呈向心性轻度光滑增厚,轻度或者没有强化,也没有明显的T2高信号成分,这与其非炎症性的血管痉挛的病理生理过程相符合。近年一些研究[11,16]表明,颅内血管壁成像在鉴别血管炎和RCVS中具有重要价值。
3.1.2 Moyamoya病 Moyamoya病是一种进展性闭塞性疾病,好发于儿童和青年人,通常累及颈内动脉的末端及Willis环。单侧或者双侧颈内动脉床突上端的狭窄会使脑基底部的侧支异常发育。目前已发表文献中关于Moyamoya病的血管壁成像的表现基本形成一个共识:Moyamoya病血管的外直径往往要比颅内动脉粥样硬化病人更小,信号强度相对均匀,通常缺乏管壁强化,如果有强化,往往是向心性的[17-18]。强化特征的不同可能与疾病的期相有关,静止期出现轻微强化或者无强化。
3.1.3 颅内动脉粥样硬化 颅内动脉粥样硬化性疾病是造成缺血性卒中的主要原因。在形态上通常是偏心性的,不均匀性的轻到中度强化。但也可出现类似血管炎的圆周样管壁强化,在这种情况下,用T2W血管壁成像可能有助于鉴别[19]。此外,不均匀的T2高信号的外部重塑性病变通常累及颅内动脉分支的近端或者分叉处,这是与其他血管病变的一个重要鉴别点。斑块的强化可能与炎性反应或者新生血管的形成有关[20]。
3.2 治疗随访中的应用 过去几年临床上使用HR-VWI技术主要是为了在缺乏组织病理学证据的情况下对血管炎和动脉粥样硬化性病变或者RCVS等病变进行鉴别。近年来开始有研究者关注该技术在治疗随访中的作用。Pfefferkorn等[12]研究报道,4例CNS原发大动脉炎病人的HR-VWI可见血管壁为中度到明显强化,经免疫抑制治疗后,其中2例病人稳定强化的特征持续存在了2个月,另外2例病人6个月后强化消失。Saam等[13]报道了1例颅内动脉炎病人多支动脉受累,管壁明显强化,随访3个月后强化程度轻度降低,6个月后进一步明显降低。Obusez等[11]的研究中纳入13例血管炎病人,6例进行了HR-VWI随访,其中4例管壁光滑向心性强化的病人经13.5个月的随访显示强化仍稳定存在,而在另2例病人中所见到的光滑向心性管壁强化和增厚在平均随访7个月后完全消失。此项研究相较于前两项研究中的管壁增厚和强化时间更长,因此将管壁强化作为临床治疗的一个真实反应指标很有前景,但需要进一步研究和观察。
颅外动脉血管炎的研究表明在临床急性症状期管壁强化最明显,而且随着激素治疗强化程度逐渐减低或者消失。然而一些颅内血管炎的病人在使用长期免疫抑制治疗后仍稳定强化数月。关于治疗后稳定强化是表明存在持续活动性炎症,还是对于治疗的低反应,还是免疫抑制治疗不充分,或是由于炎症破坏内皮细胞而使对比剂漏到管壁而形成的这些问题,目前还没有定论,需要更大的前瞻性研究来解决这些问题。
4 小结和展望
CNS血管炎的诊断具有很大难度,传统的血管成像只能显示受累血管的狭窄程度,超声和PET/CT对于颅内血管炎的诊断价值也有限。近年来HRVWI在其诊断和随访方面的研究相应增多,然而,还需要大量的研究来阐述血管炎的不同特点,包括流行病学的特征、病理、诊断工具和治疗策略等。面对这些挑战,制定CNS血管炎的影像诊断标准必需多学科多中心的协作才能实现。
