大脑中动脉CTA-MIP后处理参数的优化及初步研究
2019-02-14陈明山
陈明山 邢 刚
脑血管病是目前严重威胁人类健康,具有高致残率、高死亡率的一组高发疾病[1-2]。大脑中动脉(middle cerebral artery,MCA)是颈内动脉的直接延续,其管腔粗大,是最容易发生血液循环障碍的脑动脉之一[3]。传统最大密度投影(MIP)后处理技术用于MCA成像时,投影前后血管影像有重叠,不能充分显示重叠血管关系。目前CT血管成像(CTA)MIP的分段显示后处理技术是利用多平面重组(MPR)后处理方法,以冠状面、矢状面、横断面多个参考平面调整重组基线的重组层厚及偏移角度,使CTAMIP影像与靶血管等目标结构长轴平行,达到减少重叠干扰的效果,但是由于重组影像质量多取决于医生随机性后处理方法,缺乏统一的参数标准,使得处理后获得的影像质量因人而异。本文旨在探讨在CTA-MIPMPR平台上分析MCA血管分段显示效果与层厚及角度的关系,确定最佳后处理参数,为全景式展示MCA各段血管提供规范化影像信息。
1 资料与方法
1.1 一般资料 回顾性分析2014年6月—2016年6月在天津市泰达医院因疑似MCA缺血行头颅CTA及DSA检查的100例病人 (764处节段血管)资料,其中男 60例,女 40例,年龄50~75岁,平均(64.3±10.7)岁。纳入标准采用全国第四届脑血管疾病会议修订的指南标准[4]。排除脑出血、蛛网膜下腔出血等出血性脑卒中、颅内动静脉畸形、烟雾病和巨大动脉瘤及由心源性疾病引发的缺血性脑血管疾病。所有病人于检查前均进行碘过敏试验,并签署知情同意书。
1.2 设备与方法 采用荷兰Philips公司Brilliance iCT 128层CT扫描设备。扫描参数:管电压120 kV,管电流 250~332 mA,管球转速 0.5 s/r,螺距 0.664,准直128×0.625 mm。病人取仰卧位,由足向头侧扫描,扫描范围为第2颈椎下缘到颅顶。智能触发点兴趣区(ROI)置于降主动脉气管分叉水平,触发阈值=150 HU。采用双通道高压注射器,经肘前静脉以5 mL/s流率注入碘佛醇(恒瑞医药,含碘320 mg/mL)50 mL,并注入30 mL 0.9%生理盐水进行稀释。数据采集层厚0.9 mm,层间距0.45 mm。在星云工作站Analysis后处理平台获得 3D容积再现 (VR)及CTA-MIPMPR 影像(窗位 200/窗宽 500)。
1.3 数据测量 由2名放射科主治医师对CTAVR影像的空间跨度(space distance,SD)及走行角度(space angle,SA)进行测量,测量2次并计算其平均值及95%可信区间(CI)。①SD测量:在VR平台,根据MCA空间走行,测量M1段冠状面、M2段矢状面、M2-5段矢状面及斜冠状面空间跨度距离SD1、SD2、SD3及SD3'。②SA测量:在VR平台,测量双侧MCA M1段冠状面、M2段矢状面、M2-5段冠状面的偏移角度SA1、SA2、SA3以及M2-5段矢状面的外旋角度SA3′、SA3″。③协同定位点:M1段冠状面及M2-5段冠状面为“蝶鞍中点”、M2段矢状面及M2-5段矢状面上为“外囊中点”。
1.4 参数测量及分组 CTA-VR上各动脉段SD及SA的统计测量值分别见表1、2。根据SD、SA各自95%CI内及邻近数值选取测试值,并根据临床操作需要,分别设定CTA-MIP检查中MPR影像选层厚度(D)和MPR参考平面重组基线的偏移角度(A)的不同测试值,将D、A的不同组合作为测试参数,在MPR-MIP平台对 CTA-MIP影像 (窗位200/窗宽500)进行测试分组。先按照不同的D值分为3组,这3组再分别按照不同A值分为3个亚组,共9组。
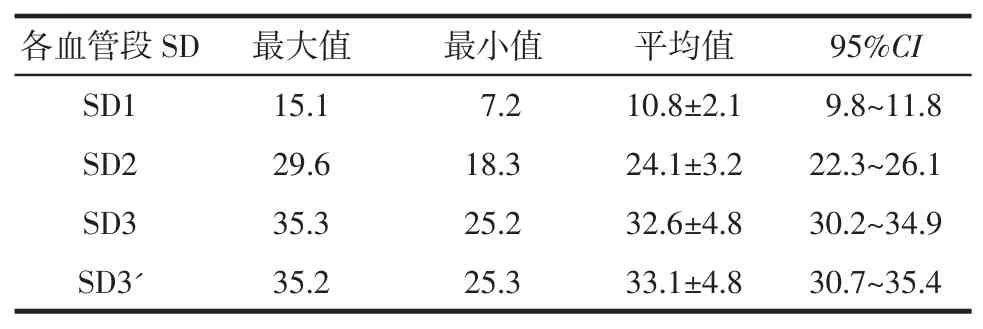
表1 CTA-VR影像上MCA各段的SD测量值 mm
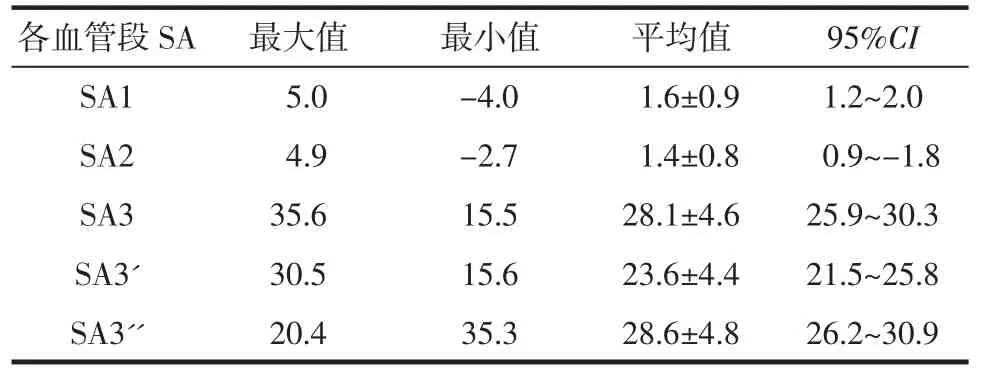
表2 CTA-VR影像上MCA各段的SA测量值 (°)
1.4.1 M1段冠状面 D值分别为 8、10、15 mm;A值(重组基线矢状方向偏移)分别为 5°、0°、-5°。分为组 1(8 mm、-5°),组 2(8 mm、0°),组 3(8 mm、5°),组4(10 mm、-5°),组 5(10 mm、0°),组 6(10 mm、5°),组 7(15 mm、-5°),组 8(15 mm、0°),组 9(15 mm、5°)。
1.4.2 M2段矢状面 D值分别为 20、25、30 mm;A值(重组基线冠状方向偏移)分别为-5°、0°、5°。 分为组 1(20 mm、-5°),组 2(20 mm、0°),组 3(20 mm、5°),组 4(25 mm、-5°),组 5(25 mm、0°),组 6(25 mm、5°),组 7(30 mm、-5°),组 8(30 mm、0°),组 9(30 mm、5°)。
1.4.3 M2-5段 ①低头冠状面,D值分别为30、35、40 mm;A值(重组基线矢状方向低头偏移)分别为 25°、30°、35°。分为组 1(30 mm、25°),组 2(30 mm、30°),组 3(30 mm、35°),组 4(35 mm、25°),组 5(35 mm、30°),组 6(35 mm、35°),组 7(40 mm、25°),组 8(40 mm、30°),组 9(40 mm、35°)。 ②外旋矢状面,D 值分别为 30、35、40 mm;A 值:轴转(横断面参考平面重组基线外旋角度)时分别为25°、20°、25°,矢转(矢状面参考平面重组基线外旋角度)时分别为 25°、30°、30°。 分为组 1(30 mm、25°/25°),组 2(30 mm、20°/30°),组 3(30mm、25°/30°),组 4(35 mm、25°/25°),组 5(35 mm、20°/30°),组 6(35 mm、25°/30°),组 7(40 mm、25°/25°),组 8(40 mm、20°/30°),组 9(40 mm、25°/30°)。
1.5 影像评价 由2名放射科医师(副主任和主任医师)分别采用双盲法对选值区间的各组影像进行综合评价,当意见不一致时采用高级别医师意见。
1.5.1 影像质量评分标准 ①4分,在靶分段血管重组影像中显示该段血管全长,对比度极好,主血管及分支血管连续、边缘锐利,整体影像质量非常好,无重叠血管干扰。②3分,在靶分段血管重组影像中显示该段血管长度≥2/3该段血管全长,对比度极好,主血管及分支血管连续、边缘锐利,整体影像质量非常好,重叠血管干扰极少。③2分,在靶分段血管重组影像中显示该段血管长度≤2/3该段血管全长,对比度好,主支血管连续、边缘锐利,整体影像质量较好,重叠血管干扰少。④1分,在靶分段血管重组影像中显示该段血管长度≤2/3该段血管全长,对比度好,主血管及分支血管不连续、边缘欠锐利,整体影像质量差或重叠血管干扰多。
1.5.2 管腔狭窄程度分组 MCA狭窄率计算及狭窄程度分级均参照Samuels标准[5],即狭窄率=(1-Ds/D n)×100%,Ds为MCA最狭窄处的血管管径,Dn为正常处血管管径,正常管径首选狭窄近心端正常MCA管径,次选狭窄远心端正常MCA管径,管径测量采用电子尺测量像素方法。根据血管狭窄率分为正常组、狭窄率<50%组、狭窄率50%~90%组和闭塞组。
1.6 统计学处理 采用SPSS22.0统计软件对数据进行分析。符合正态分布的计量资料以均数±标准差)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法进行检验。应用受试者操作特征(ROC)曲线分析优化CTA-MIP显示血管狭窄的准确度。一致性分析采用Kappa检验,κ<0.4为一致性较差,0.4≤κ≤0.7为一致性中等,κ>0.7为一致性良好。P<0.05为差异有统计学意义。
2 结果
2.1 MCA各段的优化参数
2.1.1 M1段冠状面 组1~9的影像质量评分分别为 1.74±0.71、2.07±0.71、1.45±0.72、2.81±0.61、3.26±0.61、2.79±0.64、3.41±0.84、3.85±0.51、3.13±0.80,9组影像质量评分差异有统计学意义(F=36.97,P=0.027),组间两两比较差异均有统计学意义。其中,组8的影像质量评分高于其他各组(均P<0.05)。即MCA M1段最优化参数为冠状面、层厚15 mm、角度偏移 0°。
2.1.2 M2段矢状面 组1~9的影像质量评分分别为 1.54±0.31、2.16±0.61、1.45±0.73、3.01±0.49、3.36±0.53、3.05±0.51、2.41±0.74、2.85±0.31、2.13±0.65,9组影像质量评分差异有统计学意义(F=32.73,P=0.014),组间两两比较差异均有统计学意义。其中,组5的影像质量评分高于其他组(均P<0.05)。即MCA M2段矢状面的最优化参数为矢状面、层厚25 mm、角度偏移 0°。
2.1.3 M2-5段 ①低头冠状面,组1~9影像质量评分分别为 2.60±0.44、2.71±0.41、2.92±0.41、3.04±0.45、3.15±0.34、3.41±0.40、1.27±0.67、1.38±0.86、1.65±0.82,9组影像质量评分差异有统计学意义(F=40.61,P=0.004),组间两两比较差异均有统计学意义。其中,组6的影像质量评分均高于其他组(均P<0.05)。②外旋矢状面,组1~9的影像质量评分分别为 2.28±0.38、2.58±0.40、3.01±0.41、2.74±0.41、3.16±0.40、3.42±0.33、1.26±0.45、1.59±0.82、1.90±0.84,9组影像质量评分差异有统计学意义(F=39.31,P=0.011),组间两两比较差异均有统计学意义。其中,组6的影像质量评分均高于其他组 (均P<0.05)。因此,M2-5段最优化参数为①低头冠状面、层厚35 mm、角度偏移35°;②外旋矢状面、层厚35 mm、轴转 25°、矢转 30°。
2.2 优化CTA-MIP与DSA检查结果比较 优化CTA-MIP诊断血管狭窄的敏感度、特异度、阳性预测值、阴性预测值、ROC曲线下面积分别为90.5%、97.7%、87.5%、98.3%、0.941。 CTA与DSA检查结果的一致率为 96.5%,κ=0.783,一致性良好(表 3,图 1)。
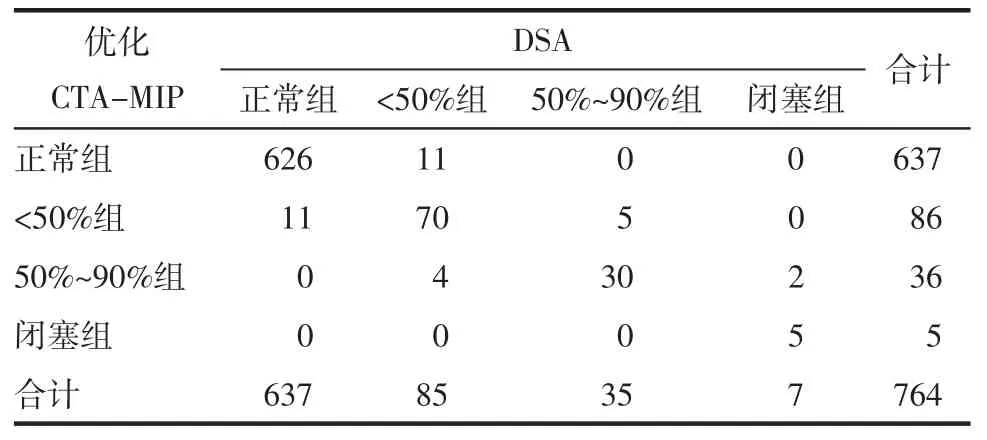
表3 优化CTA-MIP与DSA诊断血管狭窄率的结果对照
3 讨论
MCA是颈内动脉直接延续部分,是缺血性脑血管病的主要责任血管[6-7]。影像检查方法包括DSA、MRA、CTA等。目前DSA仍是血管检查的金标准,但因其有创、费用高、易引起并发症及风险大的缺点,使其不能成为血管病的首要检查方法[8]。MRA因受分辨力和血流的影响,与DSA相比,其阳性预测值较低[9],只能作为一般的筛查手段。CTA能够快速、无创地评价颅内外血管形态、管腔直径、走行及毗邻结构,评价颅内大动脉狭窄或闭塞的准确性很高,在部分研究中甚至超过DSA[10]。
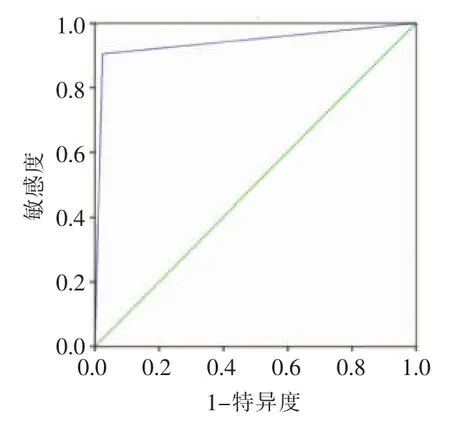
图1 优化CTA-MIP诊断血管狭窄的ROC曲线
多层螺旋CTA常应用的后处理技术包括MPR、VR、MIP等。MPR具有影像重叠少、任意斜面成像、局部细微结构显示好等优点。MIP相比于传统的VR更为简单,最大的优势是提高小分支动脉的显示能力[11],显示细节清楚、真实且优于VR[12],但全脑MIP存在非靶区血管重叠干扰的不足。MIP-MPR是基于MIP显示血管优势的基础上,利用MPR技术,根据血管走行方位上血管跨度及走行角度,调整以横断面、冠状面及矢状面参考平面重组基线的重组层厚及偏移角度,使CTA-MIP影像与靶血管等目标结构长轴平行,进行分段显示,达到减少重叠干扰的优化效果,提高重组影像质量。
在CTA-MIP检查中,MCA分段优化显示的研究国内外尚未见报道。由于分段重组影像多由医生随机性后处理完成,缺乏统一的参数标准,使得处理后影像质量因人而异,成像效果差异较大,因此研究MCA分段显示后处理参数优化,对保证重组影像质量具有重要意义。
本研究中,MCA M1段以冠状面、层厚15 mm、角度偏移0°获取其分段显示MRP-MIP后处理影像质量最优,此优化模式重组(图2A)不仅清晰显示其颈内动脉分叉至岛阈转角处全长、走行及主干血管的直径,还可清晰显示周围的邻近组织;在分支血管方面,可以清楚显示主要穿支动脉外侧豆纹动脉,且减少周围重叠血管的干扰。最佳参数重组影像在显示较为复杂MCA变异情况时影像质量不佳,无法显示其全程血管,该种变异是颈内动脉终末分支发出以前另有一支较大的MCA[13],比较罕见,在后处理中只显示一根MCA。本研究发现,在MCA M1段标准冠状面MRP-MIP后处理重组中,选层厚度增加可造成蝶鞍区骨质对M1近段的遮盖干扰;选层厚度减小会造成M1跨度大区域血管重组缺失,重组基线在标准冠状面的前后角度偏移造成M1段末端血管的重组缺失,这是导致重组影像质量下降的主要原因。MCA M1段是脑血管阻塞、颅内动脉瘤的好发部位,主要分支动脉豆纹动脉是供应内囊的主要穿通动脉,M1段的优化分段显示为神经科医生进行血管内介入治疗及外科手术术前评估提供重要的影像资料。
本研究中,MCAM2段以矢状面重组、层厚25mm、角度偏移0°获取其分段显示影像质量最优,此优化模式重组(图2B)“平铺”式地展开M2段,清楚显示在岛池内从膝部处至环状沟处的上M2段干型,在主干上以双干型多见,其中上干为主型常见,多分支多干型M2段,部分血管会有交叉重叠现象。该MRP-MIP后处理重组选层厚度增加可造成M2段周围浅静脉显影干扰,选层厚度减小使得M2分支远端血管无法进入重组区域,造成重组缺失,重组基线在标准矢状面的左右偏移造成M2段两端血管被周围的颞骨或顶骨遮盖干扰,造成重组影像质量下降。M2段上支优势型最常见,而双支对称型仅占到不足1/5。在外科手术中,术者若分离到一支较粗大的MCA并不意味着该病人一定是单干型病人,需仔细游离,充分暴露,而避免损伤。该优化模式重组影像可为术前提供准确的M2段干型的影像信息。
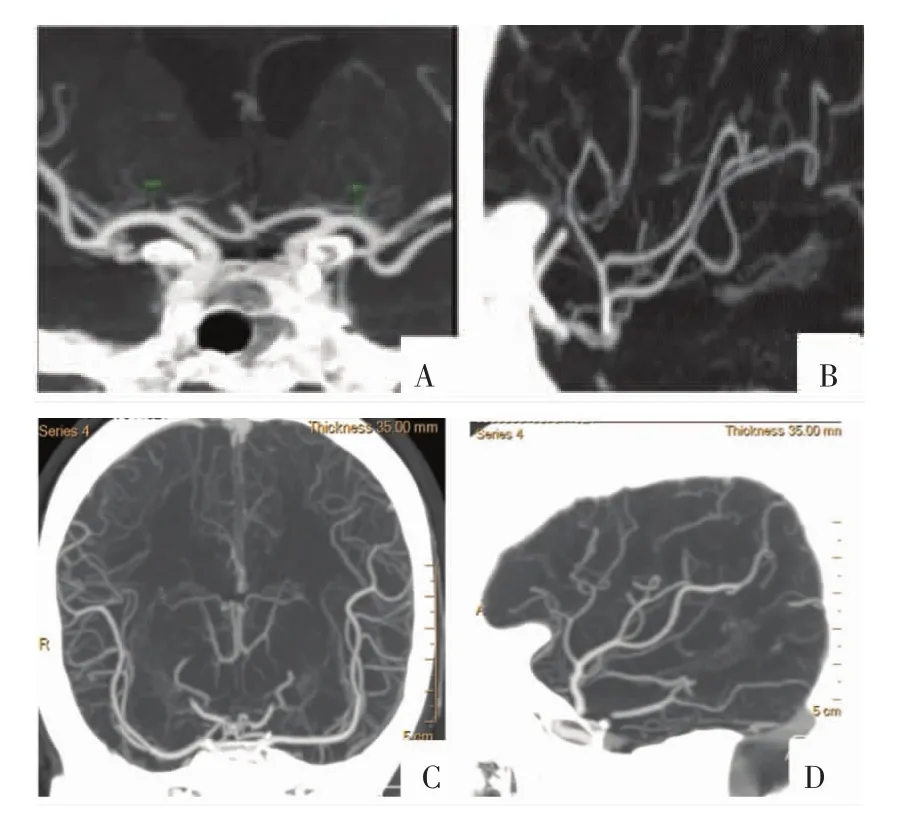
图2 病人男,58岁。正常MCA各段不同优化位CTA-MIP影像。A-D图分别为M1段冠状面、M2段矢状面、M2-5段低头冠状面、M2-5段外旋矢状面影像。
本研究中M2-5段的低头冠状面重组(层厚35 mm、角度偏移 35°)及外旋矢状面重组(层厚35 mm、轴转25°、矢转30°)获取其分段显示影像质量最优,该模式重组(图2C、2D)不仅能够清晰显示M2段主干绕岛叶前端进入外侧裂的U形结构,而且可以部分观察M3-5段穿行于外侧裂向外走行情况,在显示M2-5段走行方面发挥优势。外旋矢状面模式重组“平铺”式地展开M2-5段血管,无重叠地展示了MCA的分叉结构及血管分布情况。研究中还发现,MRP-MIP后处理重组在选层厚度增加时可造成M2-5段周围颞骨麟部及顶骨遮盖干扰,而选层厚度减小及外旋角度变小时可使M5段远端血管无法进入重组区域进而造成重组缺失,使得影像质量下降。该优化模式重组影像可以观察MCA M2-5段整体走行及分支分布情况,判断营养部位的血流情况,为MCA近端重度狭窄病人的介入治疗及预后评估提供影像学支持。
本研究MRP-MIP优化重组影像将MCA不同层面结构显示在同一个二维平面上,达到类似DSA的效果。但由于MCA CTA-MIP分段显示是对靶血管的局部成像,利用的扫描信息较少,与其他三维后处理方法相比空间分辨力有所下降;由于部分容积效应的影响,整个背景密度增加,末梢细小血管可能遗漏,血管边缘可能变得较模糊,导致血管的狭窄率被高估。
本研究将优化CTA-MIP与其DSA进行对比研究,观察其优化效果的临床价值。Bash等[14]在对比CTA与DSA诊断颅内动脉狭窄或闭塞的研究中发现,CTA的敏感度为98%,阳性预测值为93%。Nguyen-Huynh等[15]报道了相似的结果,CTA在诊断狭窄率>50%或闭塞时有极高的敏感度(97.1%)与阳性预测值(99.5%)。本研究显示优化CTA-MIP的敏感度、阳性预测值略低于上述传统CTA对比研究结果,可能原因是观察者对狭窄的认识程度不同,以及操作旋转未达病变标准切线位水平。本研究中发现优化CTA-MIP不仅对闭塞血管诊断的敏感度和阳性预测值均达到了100%,而且能显示血管远端情况(图3A、3B),这一点优于DSA,因为DSA是一过性、瞬时成像,对于有代偿的重度狭窄血管的远端侧支供血血管无法显示(图3C)。本研究与DSA检查结果一致率为96.5%,一致性较高,能较好地判断狭窄程度(图4)。因此,CTA-MIP优化后处理分段不仅能较好地判断管腔直径及狭窄程度,而且可以显示严重狭窄或闭塞远端血管。
总之,在CTA-MIP检查中,预设的层厚和角度对MCA分段优化显示影像质量至关重要,其优化显示对狭窄程度的评价与DSA有较高一致性。基于优化的选层厚度及偏移角度,利用MPR技术,CTAMIP分段显示能够清晰展示MCA各段管腔大小、走行及分支细节,同时通过建立优化参数标准,使影像医师对MCA血管的诊断更具针对性及标准化,为脑血管优化显示研究提供了全新的方法及理念。本研究尚存在一定局限性,未纳入烟雾病及血管畸形等少见病例,今后的研究需要加大对这2种病例的收集并行更进一步的研究。
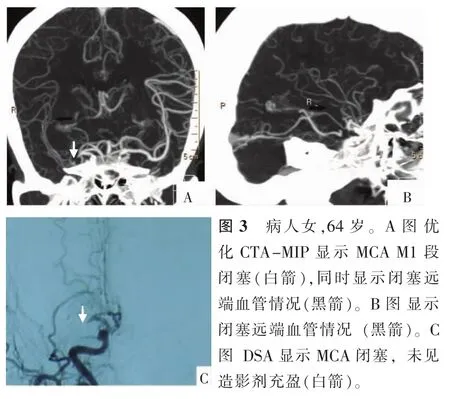
图3 病人女,64岁。A图 优化CTA-MIP显示MCA M1段闭塞(白箭),同时显示闭塞远端血管情况(黑箭)。B图显示闭塞远端血管情况 (黑箭)。C图 DSA显示MCA闭塞,未见造影剂充盈(白箭)。

图4 病人男,68岁。A图优化CTA-MIP图显示MCA M1段中度狭窄(白箭)。B图同一病人DSA显示MCA M1段中度狭窄(白箭)。
