轻度认知障碍病人脑铁沉积的定量磁敏感图研究
2019-02-14赵田镜陈家飞胡晓飞
郑 波 赵田镜 陈家飞 胡晓飞
认知功能损害是中老年人群中普遍存在的一个问题,其中轻度认知障碍(mild cognitive impairment,MCI)是指正常老化导致的认知功能下降和早期痴呆之间的一种状态[1]。MCI病人的独立生活能力不受影响,但存在客观的认知功能损害证据。研究表明,MCI可能是阿尔茨海默病(Alzheimer’sdisease,AD)的早期表现,病人由MCI转化为痴呆的比例高达7.1%,而这一比例在认知功能正常的受试者中只占0.2%[1]。对MCI阶段的病人做出准确诊断并采取干预措施,可有效降低其罹患痴呆的风险,减轻社会和家庭的负担[2]。MCI作为一种神经退行性改变,大脑的铁沉积可能在其中担当重要角色[3]。而定量磁敏感图(quantitative susceptibility mapping,QSM)已被证实可以对脑组织的铁沉积进行无创定量分析[4-5]。本研究拟采用QSM分析MCI病人大脑铁沉积的特点,为揭示MCI的脑损害机制及疾病诊断提供科学依据。
1 资料与方法
1.1 临床资料 于2016年5月—2017年4月通过张贴海报、义诊宣传的方式在社区中招募符合研究纳入标准的MCI病人30例和正常对照者(normal control,NC)30 名。其中 MCI组年龄(58.20±6.78)岁,男 18 例,女 12 例,受教育(10.47±3.14)年;NC 组年龄(56.97±4.77)岁,男 15 名,女 15 名,受教育(11.06±2.41)年。 2 组间年龄(t=0.815,P=0.419)、性别(χ2=0.606,P=0.438)和受教育水平(t=-0.831,P=0.409)匹配,差异均无统计学意义。MCI诊断依据《精神障碍诊断与统计手册(第五版)》(DSM-Ⅴ):①自诉或家属告知记忆力减退;②存在客观的认知功能损害的证据;③总体认知功能正常;④日常生活能力未受损,即日常生活能力量表≤23分。2组纳入标准:年龄45~70岁,性别不限,右利手,受教育≥6年。2组排除标准:①存在大脑器质性病变,如脑卒中、脑肿瘤、脑外伤等;②存在痴呆征象[简易精神状态检查表(mini-mentalstateexamination,MMSE)≤24 分]的受试者或其他精神疾病史的病人;③存在心脏、肝脏、肾脏等器官的严重损害;④糖尿病病人及血压控制不佳的高血压病人;⑤视觉和听觉功能严重受损;⑥MRI扫描禁忌证,如幽闭恐惧症、金属假体植入等。本研究方案通过医院伦理委员会审查,实验过程严格遵照实验方案开展。所有受试者均被告知详细的实验流程,并签署知情同意书。
1.2 量表测试 对所有受试者的认知功能水平进行测试,涵盖主要的认知功能领域:①总体认知功能的评估采用MMSE和蒙特利尔认知评估量表(Montreal cognitiveassessment,MoCA);②注意-执行功能的评估采用连线测试A和B(trail makingtest A and B,TMT-A,TMT-B)、分类词语流畅性测试(category verbal fluency test,VFT);③记忆功能的评估采用听觉词语学习测试(auditory verbal learning test,AVLT)中的短时和长时延迟记忆测试,Rey-Osterri eth复杂图形测试(Rey-Osterrieth complex figure,ROCF)中的延迟记忆测试;④语言功能评估采用波士顿命名测试(Boston naming test,BNT);⑤视空间功能评估采用ROCF临摹测试。实施测试者经过专业培训并具有相关资质,对受试者的分组情况不知情。
1.3 设备与方法 采用Simens Avanto1.5 TMRI扫描设备,16通道线圈。采集常规T1WI、T2WI和液体衰减反转恢复(FLAIR)影像以排除脑的器质性病变,然后行磁敏感加权成像(susceptibility weighted imaging,SWI)用于后续的定量分析。SWI采用三维流量补偿扰相梯度回波序列,行横断面扫描,TR=28 ms,TE=20 ms,翻转角=17°,层数=80,层间距=0.4 mm,矩阵 256×256,体素为 1 mm×1 mm× 2 mm,带宽=100 Hz,扫描时间5 min 32 s。
1.4 数据分析 所有受试者的 T1WI、T2WI和FLAIR影像经放射科医师评估是否存在大脑器质性病变。然后采用磁化率成像与相位伪影消除工具(SMART)对原始SWI图像进行预处理,该过程符合标准的预处理步骤[6]。基于预处理完成的数据,采用核磁共振信号处理(signal processing in nuclear magnetic resonance,SPIN)软件测量兴趣区(ROI)的磁化率值作为铁含量的推定值,ROI包括海马、丘脑、尾状核头、壳核、苍白球、红核、黑质,以及额叶皮质、顶叶皮质、枕叶皮质(图1)。大脑器质性病变评估和ROI勾画均由2名有3年以上工作资历的放射科诊断医师完成,同一ROI的磁化率值取2名医师测值的平均值,对于有异议的问题请更高年资的医师参与讨论并达成一致意见。
1.5 统计学分析 采用SPSS19.0软件对数据进行统计分析。计量资料以均数±标准差s)表示,计数资料以例表示。采用χ2检验对2组间性别进行比较。对连续变量进行Kolmogorov-Smirnov正态分布检验,并对符合正态分布的变量进行独立样本t检验。以年龄、性别和受教育年数作为协变量,采用偏相关分析探讨MCI病人大脑铁沉积与认知功能改变之间的关系。P<0.05为差异有统计学意义。QSM数据的组间比较结果进行Bonferroni校正 (10个脑区的左、右侧行组间比较,P<0.001表示差异有统计学意义)。
2 结果
2.1 2组间量表测试评分资料比较 MCI组MMSE、MoCA、AVLT-短时延迟记忆、AVLT-长时延迟记忆评分均低于NC组 (均P<0.05),MCI组完成TMT-B的耗时长于NC组(均P<0.05),其余的认知功能量表测试结果差异均无统计学意义(均P>0.05),详见表1。
2.2 2组间各脑区QSM数据比较 2组的QSM数据均符合正态分布。MCI组的双侧海马、左侧丘脑、右侧尾状核头、左侧壳核的磁化率值均高于NC组(均P<0.05),经Bonferroni校正后MCI组双侧海马的磁化率值均高于NC组(均P<0.001)。
2.3 MCI组量表评分与QSM改变的相关分析 左侧海马磁化率值与AVLT-短时延迟记忆(rs=-0.531,P=0.004)、AVLT-长时延迟记忆(rs=-0.412,P=0.033)评分呈负相关,右侧海马磁化率值与AVLT-短时延迟记忆 (rs=-0.590,P=0.001)、AVLT-长时延迟记忆(rs=-0.414,P=0.032)评分亦呈负相关(图 2)。海马磁化率值与TMT-B耗时之间无相关性。
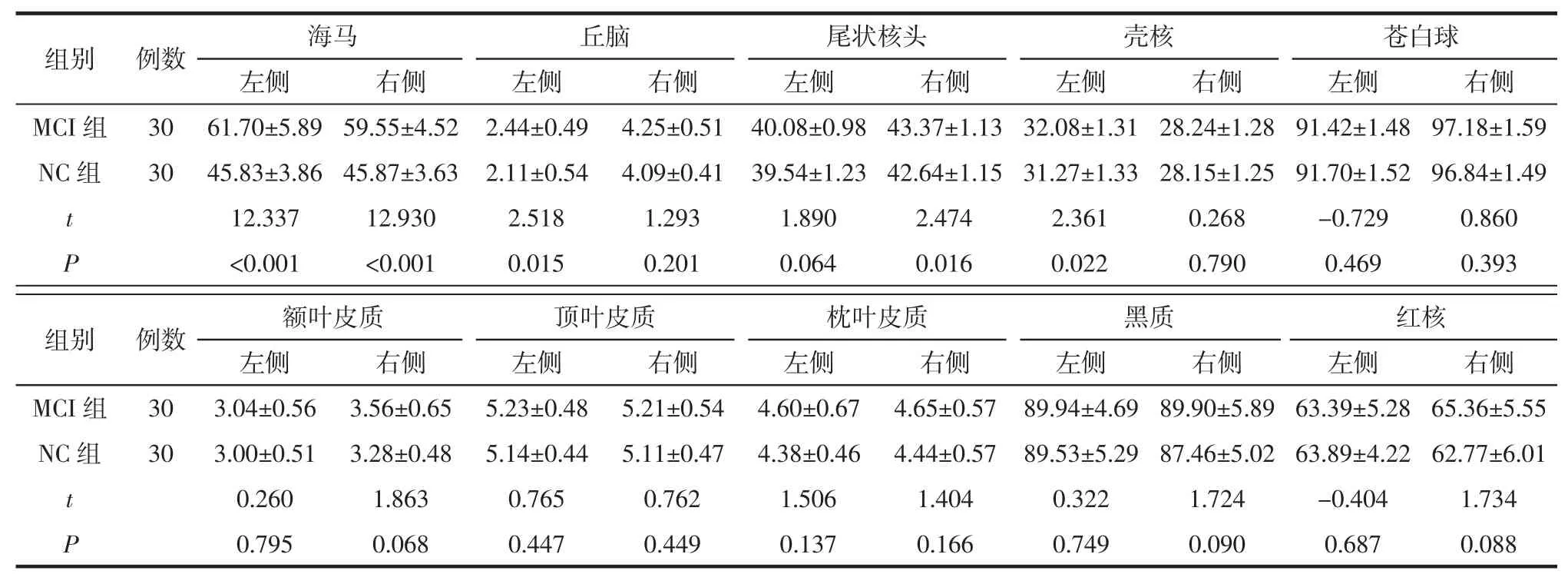
表2 MCI组与NC组各脑区磁化率值比较 ppb
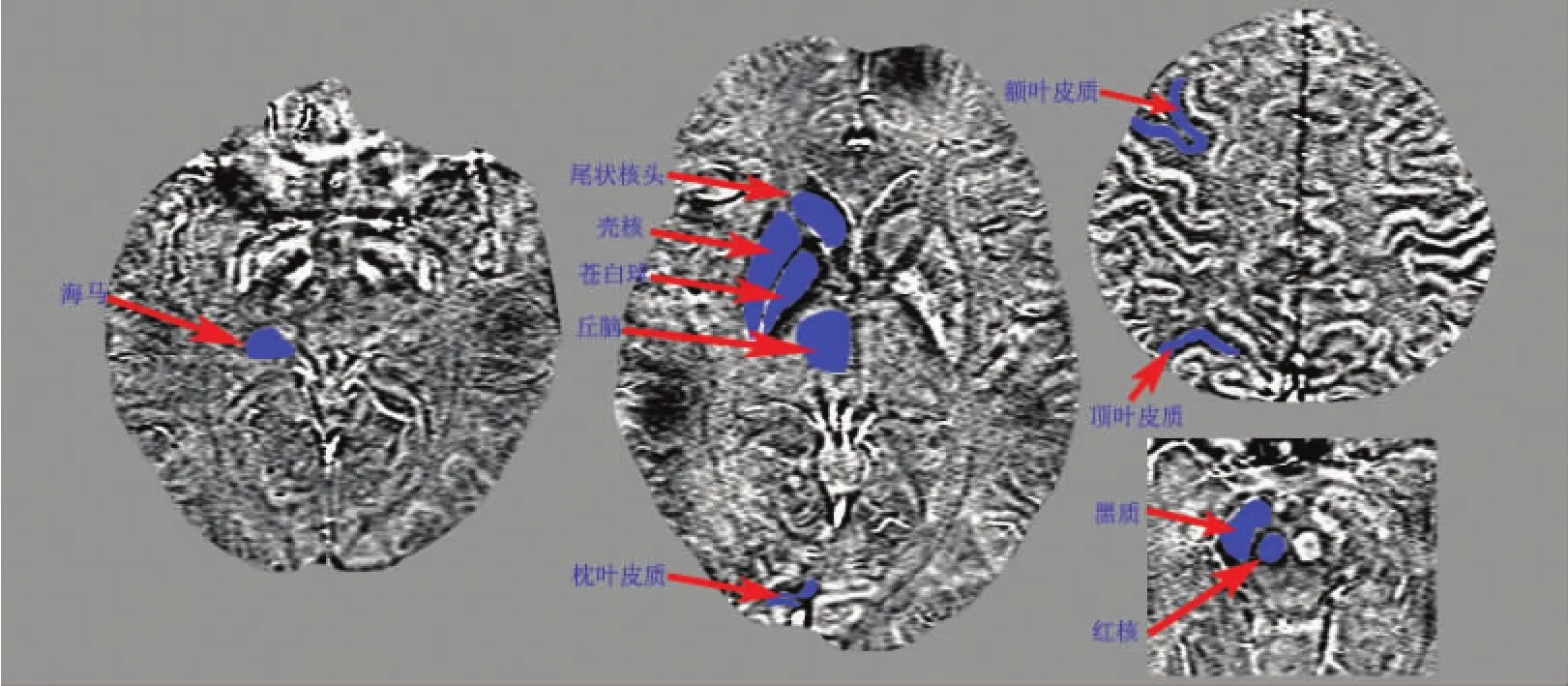
图1 ROI勾画示意图
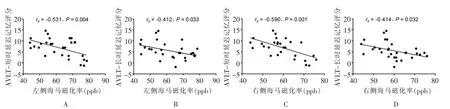
图2 相关分析图。A图为左侧海马磁化率值与AVLT-短时延迟记忆评分之间相关分析图;B图为左侧海马磁化率值与AVLT-长时延迟记忆评分之间相关分析图;C图为右侧海马磁化率值与AVLT-短时延迟记忆评分之间相关分析图;D图为右侧海马磁化率值与AVLT-长时延迟记忆评分之间相关分析图。
3 讨论
本研究采用QSM法对MCI病人多个脑区的铁含量展开定量分析,发现MCI病人存在双侧海马的磁化率值显著升高,其中海马的磁化率值升高与病人的记忆水平下降密切相关,提示MCI病人大脑存在以海马为主的铁沉积,大脑铁沉积可能是MCI病人认知功能损害的风险因素之一。
QSM是近年来在SWI的基础上发展而来的一种新的图像后处理技术,它通过对相位信息进行重建、去缠绕、去背景等预处理获得场图,在场图的基础上重建出磁化率图像。与SWI的不同之处在于,QSM无需依赖几何学参数,因而可对磁敏感物质的磁化率水平进行定量分析[7]。这种无创的定量检测方式已经成功应用于帕金森氏病[8]、肌萎缩侧索硬化[9]等神经退行性病变的研究中。而对于MCI的研究,目前多直接采用SWI数据进行铁沉积测量[10],或采用QSM数据对同时伴有糖尿病的MCI病人进行铁沉积的分析[11]。本研究采用QSM法测量单纯MCI病人脑铁沉积,能够更准确地反映MCI病人脑铁沉积的特点,为深入理解MCI病人认知功能损害的机制提供神经影像学依据。
本研究的QSM定量分析结果显示MCI病人存在部分脑区铁沉积。已有研究[12-13]证实,大脑在正常老化和神经退行性改变过程中存在铁沉积,铁沉积可能通过氧化应激作用导致神经元的损伤。铁主要以亚铁离子的形式进入细胞并以三价铁离子的形式储存于铁蛋白中,但当发生铁沉积时,细胞内的铁蛋白被消耗完毕,大量的亚铁离子通过芬顿反应生成活性氧簇物质。活性氧簇的强氧化能力一方面可以通过损害铁蛋白功能和阻碍铁蛋白mRNA转录翻译的过程,导致铁蛋白中的铁被释放出来及降低新生铁蛋白的水平,形成恶性循环[3];另一方面还攻击细胞内的抗氧化系统,损害蛋白质、膜脂、碳水化合物、DNA等细胞组分,最终导致细胞死亡[12]。已有研究[14]表明,在帕金森病、AD、Hallervorden-Spatz病等神经变性疾病中,铁沉积引发的氧化应激可能是导致神经元死亡的首要原因。在MCI病人中已发现其血清铁蛋白的水平显著高于健康对照组,因此MCI可能存在发生脑铁沉积的基础条件[10]。本研究采用QSM法发现MCI组双侧海马的铁含量显著升高,左侧丘脑、右侧尾状核头、左侧壳核的铁含量较对照组而言有升高的趋势,验证了MCI病人存在大脑铁沉积的假设。
MCI病人大脑铁沉积主要发生在双侧海马,并且铁含量与记忆功能水平下降密切相关。海马是整合情景记忆信息的关键脑区[15],也是AD病人大脑最易发生损伤的区域[16]。有研究[17-18]发现海马体积的减小与MCI向AD转化密切相关,进展期的MCI病人右侧海马的萎缩率显著高于稳定的MCI病人。考虑到MCI通常被认为是AD的前驱期,同时本研究发现MCI病人海马铁沉积与记忆功能呈负相关关系,因此推测MCI病人的海马铁沉积有可能成为预测MCI向AD转化的影像学标志。与NC组相比,我们还发现MCI病人在TMT-B测试中的表现较差。有研究[19]证实孤立的壳核出血会导致病人额叶功能受损,进而发生注意-执行功能障碍;多发性硬化临床孤立综合征病人的壳核也存在与任务负荷相关的注意-执行功能障碍[20]。因此,我们推测MCI病人壳核铁含量水平升高趋势可能与TMT-B耗时增加有关。而记忆、注意-执行功能这些认知功能领域的损害最终导致病人在总体认知功能评价(MMSE、MoCA)中得分低于对照组。
本研究存在以下局限性:①本研究是在体研究,缺少病理证据对研究结果加以证实;②MCI病人大脑铁沉积的确切机制尚不明确,有待进一步研究;③相对较小的样本量限制了本研究的统计效力,在未来的研究中加大样本量有望解决这一问题。
综上,本研究采用QSM法测定MCI病人大脑代表区域的磁化率值,发现MCI病人存在以双侧海马为主的铁沉积。海马铁沉积有可能成为预测MCI病人记忆功能损害的影像学标志。
