血糖波动对人脐静脉血管内皮细胞腺苷酸活化蛋白激酶和过氧化物酶增殖物激活受体γ共激活因子1α的影响
2019-02-14田翰林常柏田文静
田翰林,常柏,田文静
据世界卫生组织统计,2014年全球成年人群糖尿病(DM)发病率高达9%[1],2015年国际糖尿病联合会数据显示,全球DM患病人数已达到4.15亿,我国2015年DM患病人数居世界首位,高达1.1亿[2]。同时DM大血管病变是公认的高致残疾病因素。近年中外研究发现,血糖波动相较于单纯性高血糖对血管内皮损伤更为严重,具体机制尚不明确。腺苷酸活化蛋白激酶(AMPK)是一个由α、β、γ亚基形成的三聚体,被称为细胞能量的“燃料开关”“感受器”“低能警示系统”。受磷酸腺苷/三磷酸腺苷(AMP/ATP)比值调控,对细胞内能量代谢极为敏感,同时影响生理性一氧化氮(NO)产生、caspase-3凋亡因子表达,从而影响血管内皮的功能[3-4];过氧化物酶体增殖物活化受体γ共激活因子1α(PGC-1α)作为AMPK的下游效应分子,参与线粒体系统合成和个体合成的过程,从而影响内皮细胞能量代谢[5]。本研究于2016年12月通过蛋白质印迹法(Western blot)和反转录-聚合酶链反应(RT-PCR)分别检测高糖/血糖波动下人脐静脉内皮细胞(HUVECs)中AMPK、PGC-1α的蛋白表达与信使RNA(mRNA)表达,以探讨血糖波动对血管内皮的影响。
1 材料与仪器
HUVECs(天津医科大学内分泌研究所),DMEM培养液、0.25%胰蛋白酶、胎牛血清(Gibcu公司),肝素钠、明胶、内皮细胞生长因子(Sigma公司),AMPK,PGC-1α抗体,anti-β(CST公司)。显微镜、全自动图像分析仪(日本奥林巴斯公司),荧光定量PCR仪(Applied Biosystems公司),台式低/高速离心机(德国Eppendorf 公司),PCR试剂盒(北京康为世纪生物科技有限公司)。
2 实验方法
2.1细胞培养实验分组和干预HUVECs复苏后用含10% 胎牛血清的5 mmol/L含葡萄糖和氨基酸(Glu DMEM)的低糖培养液,置于37 ℃,5%CO2无菌培养箱内培养。每24 h换液一次,每2~3 d传代1次。取对数生长期的第3代HUVECs,倒掉培养液,经胰蛋白酶消化后制成细胞悬液,以105/mL浓度接种于六孔板中,参照文献[6]设计血糖浓度、换药时间以及分组模式,将细胞分为三组:正常组用5 mmol/L Glu DMEM培养液,每24 h换液一次(模拟正常糖环境);高糖组用25 mmol/L Glu DMEM培养液(模拟高糖环境),每24 h换液一次;血糖波动组用25 mmol/L Glu DMEM培养液和5 mmol/L Glu DMEM培养液,每8 h交替更换一次培养液(模拟血糖波动环境),将三组模型置于37 ℃,5%CO2细胞培养箱培养48 h,对相应指标进行观察。
2.2流式细胞仪技术检测HUVECs凋亡用不含乙二胺四乙酸(EDTA)的胰酶消化收集细胞,磷酸盐缓冲液(PBS)洗涤细胞2 次,2 000 r/min离心5 min,收集1×105~5×105细胞;将细胞重悬于结合缓冲液500 μL,加入Ca2+依赖性磷脂结合蛋白(Annexin V-FITC)5 μL和核酸染料(PI)5 μL,轻混匀,室温避光反应15 min,1 h内进行分析。流式细胞仪激发波长Ex=488 nm。用未经凋亡诱导处理的正常细胞作为对照,进行荧光补偿调节去除光谱重叠和设定十字门的位置,每组做3个平行反应。
2.3Westernblot检测高糖及血糖波动对AMPK和PGC-1α蛋白表达的影响取干预后的细胞用预冷的PBS冲洗两遍,加入细胞裂解液5 min,12 000 r/min低温离心15 min,聚氰基丙烯酸正丁酯试剂检测法(BCA法)检测总蛋白量,每样品取20滴上样,蛋白质双向电泳(DS-PAGE电泳)分离,转膜,10 V恒压通电80 min。加一抗:抗AMPK(1∶1 000稀释)、抗PGC-1α(1∶1 000),4 ℃过夜孵育。辣根过氧化物酶(HRP)标记的特异性二抗(1∶2 000) 及HRP标记的抗生物素抗体(1∶1 000) 室温下孵育1 h。显影、定影、洗片。结果用凝胶成像软件定量扫描条带灰度,以目的蛋白条带/β-acting蛋白条带的比值反映各自的蛋白表达水平,每组取6个样本测试。
2.4RT-PCR检测高糖、血糖波动对AMPK与PGC-1αmRNA表达影响将干预后的细胞,超纯RNA提取试剂盒提取组织总RNA,引物序列:AMPK上游引物5′-TGGCAAACATGAATTGACTGG -3′;下游引物5′-GCTTGAGGTTCTGAATTTCTCTG-3′;产物长度113 bp;PGC-1α上游引物:5′-AGAAGCGGGAGTC TGAAA GG-3′,下游引物:5′-CAGTTCTGTCCGCGTTGTG-3′,产物长度 483 bp;用HiFi-MMLVcDNA 第一链合成试剂盒进行反转录,反应条件:95 ℃预变性10 min,1个循环;95 ℃、15 s,60 ℃、20 s,72 ℃、30 s,共45个循环。扩增后,60~95 ℃进行融解曲线分析,目的基因和对照基因的Ct值经荧光定量分析仪自动采集给出,采用2-ΔΔCt法计算基因相对量,每组取6个样本测试。
3 实验结果
3.1各组内皮细胞凋亡率比较数据及统计结果见表1。整体分析(单因素方差分析)及两两比较(LSD-t检验)显示:内皮细胞凋亡率的4个指标,各组间差异有统计学意义(P<0.05)。结合数据看:早晚期细胞凋亡指标由高至低依次为血糖波动组、高糖组、正常组;机械损伤细胞指标由高至低依次为高糖组、血糖波动组、正常组;存活细胞指标由高至低依次为正常组、高糖组、血糖波动组。

表1 高糖、血糖波动对HUVECs凋亡率影响
注:两两比较显著性标记a、b分别为和正常组、高糖组比较,P<0.05
3.2各组内皮细胞AMPK和PGC-1α相对蛋白表达的变化各组细胞AMPK和PGC-1α蛋白条带图见图1,数据及统计结果见表2。整体分析(单因素方差分析)及两两比较(LSD-t检验)显示:各组内皮细胞AMPK和PGC-1α蛋白表达,各组间差异有统计学意义(P<0.05)。结合数据看:均以血糖波动组为最低,正常组最高。
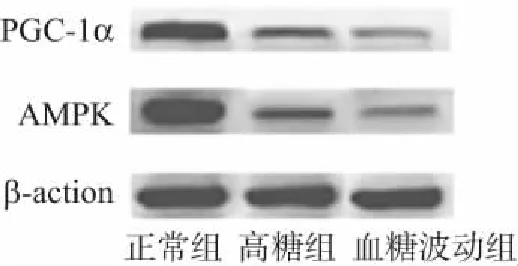
图1 不同血糖水平下脐静脉内皮细胞AMPK和PGC-1α蛋白的表达
3.3各组内皮细胞AMPK和PGC-1α相对基因表达的变化数据及统计结果见表3。整体分析(单因素方差分析)及两两比较(LSD-t检验)显示:细胞AMPK和PGC-1α相对基因表达,各组间差异有统计学意义(P<0.05)。结合数据看:两基因表达水平都是血糖波动组为最低,正常组最高。

表2 各组细胞AMPK和PGC-1α相对蛋白表达
注:两两比较显著性标记a、b分别为和正常组、高糖组比较P<0.05

表3 各组细胞AMPK和PGC-1α相对基因表达
注:两两比较显著性标记a、b分别为和正常组、高糖组比较,P<0.05
4 讨论
高血糖可直接损伤内皮细胞,诱发其分泌与释放趋化因子、黏附分子等炎性介质的平衡失调,以至于刺激血管内皮细胞炎症反应;同时高糖可间接引起内质网应激、胰岛素抵抗、氧化应激和脂代谢紊乱等病理反应,导致内皮细胞功能紊乱,降低存活率,促进凋亡。高糖环境亦可活化多元醇通路,增强己糖胺途径,蛋白激酶C 激活等,导致改变细胞氧化还原状态,介导细胞功能损害[7-8]。血糖波动对血管功能造成损害是多途径的,且其对血管内皮细胞的损伤相较于单纯性高糖更为严重[9-10]。本研究结果显示,体外血糖波动及持续高糖培养可诱导HUVECs发生凋亡,且血糖波动组凋亡率高于高糖组。
AMPK受AMP/ATP比值调控,氧化应激、缺血缺氧、代谢产物等导致AMP/ATP比值升高的因素都可通过AMPKα1亚基172位苏氨酸磷酸化或直接变构激活AMPK。AMPK激活后,通过下游SIRT1/PGC-1α 信号途径,引起线粒体氧化磷酸化能力增强,开启生成ATP产能的途径[11]。AMPK也通过对游离脂肪酸(FFA)氧化的促进从而拮抗FAA造成的内皮细胞脂毒性,以此对血管内皮产生保护[12]。AMPK通路中,其通过调节内皮-氧化氮合酶活性,刺激NO 的产生,改善内皮功能[13-14]。活化的AMPK 通过其下游的靶分子如组蛋白脱乙酰酶(SIRT1)、FOXO和PGC-1α抑制核因子-κB(NF-κB)信号,随后降低炎性因子的表达[15]。高糖引起的血管内皮细胞中caspase-3的活性在AMPK激活时可被抑制,从而减少细胞凋亡[16]。
PGC-1α作为AMPK的下游效应分子,AMPK不仅能增加PGC-1α的表达,且直接能够导致其磷酸化,此过程是PGC-1α依赖性介导的PGC-1α的启动子激活所必需的。研究表明:细胞能量代谢中线粒体起着决定性作用,作为能量代谢最重要的场所,对细胞生长、增值、凋亡以及信号转导等过程直接参与。而线粒体的生成中PGC-1α可能是其关键调控因子,可对生物刺激调控线粒体表达与合成直接做出相应反应[17-18]。被PGC-1α调控的线粒体生成信号途径可能是修复与维持血管内皮细胞线粒体功能的一项主要机制[19]。
本研究中,在高糖及血糖波动状态下血管内皮细胞AMPK和PGC-1α蛋白表达和mRNA表达都呈下降表现,而且血糖波动状态下的表达下降更为明显,细胞凋亡率也更高,但具体损伤机制尚不明确,考虑与血糖波动状态下改变了内皮细胞能量代谢平衡,导致能量消耗异常以至于AMP/ATP比值改变,从而使AMPK激活减少,PGC-1α作为AMPK下游效应分子表达下降,使得整个AMPK通过调节PGC-1α-核呼吸因子-1通路中激活编码线粒体蛋白的核基因和线粒体DNA的转录复制异常,线粒体表达受到影响,内皮细胞修复功能受损[20-21]。另一方面AMPK、PGC-1α表达减少也导致其相应信号通路、合成代谢与分解代谢异常,生理性NO 的产生减少、炎性因子、caspase-3表达上升等自身防御机制异常,继而导致血管内皮损伤。
综上所述,本研究初步结果显示,血糖波动对血管内皮细胞的损害程度高于持续高血糖,部分机制与其影响AMPK/PGC-1α相关通路及细胞能量代谢改变有关,确切机制值得进一步探讨。
