侧脑室注射鼠神经生长因子对阿尔茨海默病转基因模型小鼠学习能力及行为学的影响
2019-02-14李善华周利张霞何华琼
李善华,周利,张霞,何华琼
阿尔茨海默病 (AD) 即老年性痴呆,是老年人常见的一种中枢神经系统隐匿、进行性脑功能衰退性神经疾病。AD病人具有持续进行性的智能衰退的特点,其认知和记忆功能进行性下降,临床出现智力衰退、进行性痴呆并最终导致人格及性格完全改变,严重者生活不能自理,需要长期照顾,增加家庭负担并严重影响病人生存质量[1]。临床研究表明,鼠神经生长因子(mNGF)具有促进受损中枢神经元生长分化作用,对受损中枢和外周神经元均有营养作用,可通过加速损伤神经纤维及轴索的再生来促进损伤神经功能的恢复[2-3]。鉴于mNGF在临床应用治疗AD已取得了一定的疗效,但其缺乏相关的动物研究,特别是电生理结合学习记忆能力方面的研究,本实验于2017年5—8月通过侧脑室注射mNGF,采用膜片钳记录技术和国内外公认的行为学检测方法来观察和研究其治疗AD转基因模型小鼠作用,分析作用机制。
1 材料与方法
1.1实验动物AD转基因模型小鼠20只(C57BL/6J),老年正常C57BL/6J小鼠10只,均为雄性,体质量(20.0±1.0)g,周龄为7周。动物基线资料如性别、体质量和周龄比较差异无统计学意义(P>0.05)。动物均购自北京医科利昊生物科技有限公司 [许可证SYXK(鄂)2017-0031]。将20只老年痴呆转基因小鼠(C57BL/6J)采用随机数字表法分为AD组和实验组,每组10只,另取10只老年正常C57BL/6J小鼠设为老年组作为对照。遵偱3R原则(替代、减少、优化),实验过程中充分保证动物福利、给予动物人道关怀。动物自由饮水并饲以颗粒饲料,动物房12 h交替光照,相对湿度保持在75%左右,恒温(22~24)℃。动物处置也符合伦理学原则。
1.2仪器与试剂Morris水迷宫视频跟踪分析系统WMT-100(成都泰盟软件有限公司,型号:WMT-100);鼠脑立体定位仪(上海玉研科学仪器有限公司);玻璃电极拉制仪(日本 Narishige 公司,型号:PP-83);膜片钳放大器 (英国 Campden 公司,型号:Mul-ticlam p700A ),振动切片机(英国Campden公司,型号:752M);注射用mNGF(厦门北小之路生物工程有限公司,批号:017082408);小鼠脑源性神经营养因子(BDNF) 和神经生长因子 (NGF);酶联免疫吸附测定(ELISA)试剂盒(南京金益柏生物科技有限公司)。
1.3给药方法将实验组小鼠麻醉后固定于小鼠立体定位仪,用微量注射器将20 μL 注射用mNGF准确注射于侧脑室内,间隔10 d注射一次,共注射3次。老年组注射等量0.9%氯化钠注射液作为对照,治疗同实验组。
1.4海马回脑薄片的制备及全细胞膜片钳记录方法参照文献[4],先将人工脑脊液通95%O2+5%CO2饱和并放入冰箱(4 ℃)备用。小鼠用断头器断头,咬骨头钳去顶骨,迅速分离出小脑组织,置于 4 ℃ 95%O2+5%CO2饱和人工脑脊液中浸泡5 min,修整海马回区域,用振动切片机切成约300~400 μm厚度的海马回脑薄片。然后在人工脑脊液中用针头分离出海马回CA1区,再孵育 1 h备用。参照文献[5],用Mul-ticlam p700A 膜片钳放大器进行全细胞膜片钳记录海马CA1区群峰电位(PS)和自发性动作电位 (AP),记录的PS和AP采用Pclamp软件分析。记录前先用PP-83 控制仪拉制玻璃微电极( 直径约1~2 μm ),微电极用pH为7.2标准电极内液充灌30 min,灌前用0.22 μm滤膜过滤后,使充灌后的微电极内封接电阻为 2~6 MΩ。海马CA1区全细胞膜片钳记录在20~25 ℃的室温下进行,记录时将备用海马回CA1区脑薄片移入浴槽中,用恒流泵持续灌注95%O2+5%CO2混合人工脑脊液,然后推进微电极,使微电极尖端与细胞膜形成巨阻抗,封接成功后抽吸破膜(负压破膜使电极内液与细胞内液相通)即可形成全细胞记录。
1.5BDNF和NGF蛋白检测参照文献[6],取给药前后分离好的海马回CA1区脑薄片,采用免疫组化法检测脑薄片蛋白阳性表达。先将标本石蜡包埋后切片、烤干、脱蜡,滴一抗(BDNF),4 ℃ 过夜,阴性对照滴加磷酸缓冲盐(PBS)溶液。隔日后室温下复温,滴二抗工作液,37 ℃孵育10 min,辣根酶标记 10 min;用二氨基联苯胺(DAB)显色,苏木素复染,然后分化、返蓝、脱水、封片。高倍镜下随机取10个视野,各计数100个细胞,分别计算BDNF和NGF蛋白阳性表达。脑薄片SP染色后BDNF和NGF蛋白阳性为胞浆棕黄色或黄褐色。用图像分析软件统计各组平均光密度 (MOD)值。
1.6实时定量聚合酶链式反应(PCR) 取分离好的海马回CA1区脑薄片,一步法提取脑薄片总RNA,取1μg总RNA,用AMV反转录酶进行反转录,反转录产物PCR扩增,以β-actin为内参,检测BDNF和NGF mRNA表达。引物序列见表1。PCR反应条件为:93 ℃ 30 s、94 ℃ 3 min、64 ℃ 30s、71 ℃ 1 min,35个循环,71 ℃ 7 min。以目的基因灰度值/β-actin灰度值之比表示BDNF和NGF mRNA的相对值[7]。

表1 引物序列表
1.7Morris水迷宫实验在鼠神经生长因子侧脑室注射前和第40天进行 Morris 水迷宫空间探索实验,测试时随机选取四个象限中的任意一点,将小鼠头向上,面向池壁放入水中,记录小鼠 60 s内穿越原平台次数,用空间探索实验来观察大鼠运行轨迹来评估大鼠学习和记忆能力(评估4次取均值)[8]。
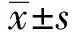
2 结果
2.1mNGF对小鼠脑薄片海马回CA1区BDNF、NGF蛋白阳性表达的影响老年组治疗前后脑薄片海马回CA1区BDNF、NGF蛋白阳性表达无明显变化。治疗前,AD组和实验组小鼠BDNF、NGF均低于老年组(P<0.05)。治疗第40天,AD组低于老年组(P<0.05),实验组小鼠BDNF和NGF蛋白阳性表达则明显升高,与AD组和治疗前同组比较差异有统计学意义(P<0.05)。具体数据见表 2。
2.2mNGF对小鼠脑薄片海马回CA1区BDNFmRNA、NGFmRNA表达的影响老年组治疗前后脑薄片海马回CA1区BDNF mRNA、NGF mRNA无明显改变。AD组和实验组小鼠治疗前后BDNF mRNA、NGF mRNA均低于老年组(P<0.05)。治疗第40天,实验组BDNF mRNA、NGF mRNA表达明显提高,与AD组和治疗前同组比较差异有统计学意义(P<0.05)。具体数据见表3。
2.3mNGF对小鼠全细胞膜片钳记录海马CA1区PS和AP结果的影响老年组治疗前后脑薄片海马回CA1区PS和AP膜电位保持在正常水平,且治疗前后无明显改变。AD组小鼠治疗前后PS和AP膜电位均高于老年组(P<0.05)。实验组小鼠治疗前PS和AP膜电位高于老年组(P<0.05),治疗第40天,PS和AP膜电位降低,与AD组和治疗前同组比差异有统计学意义(P<0.05)。具体数据见表4。

表2 小鼠治疗前后BDNF、NGF蛋白阳性表达比较
注:与老年组比较,aP<0.05;与治疗前同组比较,bP<0.05;与AD组比较,cP<0.05

表3 小鼠治疗前后BDNF mRNA、NGF mRNA 表达比较
注:与老年组比较,aP<0.05;与治疗前同组比较,bP<0.05;与AD组比较,cP<0.05

表4 小鼠治疗前后海马CA1区PS和AP膜电位比较
注:与老年组比较,aP<0.05;与治疗前同组比较,bP<0.05;与AD组比较,cP<0.05

表5 小鼠治疗前后空间探索穿台次数和定位航行逃避潜伏期比较
注:与老年组比较,aP<0.05;与治疗前同组比较,bP<0.05;与AD组比较,cP<0.05
2.4mNGF对小鼠Morris水迷宫测试结果的影响在定位航行试验中,老年组治疗第40天游泳次数和逃避潜伏期与治疗前同组比较差异无统计学意义(P>0.05)。治疗前,AD组和实验组的逃避潜伏期均较老年组明显延长(P<0.05)。但治疗第40天,实验组逃避潜伏期较AD组明显缩短,与AD组和治疗前同组比较差异有统计学意义(P<0.05)。在空间探索试验中,各组在撤去平台60 s后,AD组和实验组治疗前小鼠跨越平台次数比较差异无统计学意义(P>0.05)。治疗第40天,实验组小鼠跨越平台次数明显高于AD型组(P<0.05),老年组运动轨迹主要在原平台位置,AD组则主要分散在外周,而实验组运动轨迹在两者之间。具体数据见表5。
3 讨论
mNGF是从大鼠颌下腺提取的一类蛋白质,研究表明,mNGF可改善丙烯胺和己二酮致小鼠中毒性周围神经病肢体运动障碍,可提高受损神经—肌肉动作电位幅度、缩短动作电位潜伏期,对中毒性周围神经病具有保护作用,可促进损伤神经功能恢复[9]。本实验通过侧脑室直接注射mNGF,减少影响吸收各环节,观察其对AD转基因模型小鼠学习记忆能力及行为学的影响,分析可能机制。
在本实验,实验组小鼠分3次(间隔10 d)侧脑室注射mNGF进行干预性治疗,AD组和老年组同时间点注射等量0.9%氯化钠注射液对照。在治疗前和治疗第40天用Morris水迷宫视频跟踪分析系统进行定位航行和空间探索实验;采用全细胞膜片钳记录海马CA1区诱发的PS和AP膜电位;采用免疫组化法检测小鼠海马区脑组织BDNF和NGF及其基因表达水平。结果显示实验组以上各指标均优于AD组,提示侧脑室直接注射mNGF可改善AD小鼠学习记忆能力。
NGF是最早发现的神经营养因子,主要通过递质乙酰胆碱(Ach)发挥对神经纤维的修复和再生作用,对感觉神经元、多巴胺能神经元、交感神经元和运动神经元等均具有促进存活及保护作用[10-11]。BDNF广泛存在于神经系统中的一类蛋白质,尤以海马区含量最为丰富,BDNF对正常神经元的分化、发育、成熟及受损神经元的修复均有促进作用,而大脑海马区与学习记忆能力密切相关[12-13]。因此,研究mNGF对NGF和BDNF有重要意义。本实验中,实验组小鼠脑薄片海马回CA1区BDNF和NGF蛋白阳性表达及BDNF mRNA、NGF mRNA明显升高,提示侧脑室直接注射mNGF可显著地调控海马回CA1区中的BDNF和NGF蛋白阳性表达及BDNF mRNA、NGF mRNA的表达,保护及修复受损的神经元细胞。实验中我们还观察到老年组治疗前后脑薄片海马回CA1区PS和AP电位保持在相对正常水平,且治疗前后无明显改变。AD组小鼠治疗前后PS和AP膜电位均高于老年组(P<0.05)。实验组小鼠治疗前PS和AP膜电位高于老年组(P<0.05),治疗第40天,PS和AP膜电位降低,与AD组和治疗前同组比较差异有统计学意义(P<0.05)。这提示AD转基因模型小鼠中枢神经系统存在持续性退化性损伤,AD组小鼠脑薄片海马回CA1区PS和AP膜电位高于对照的老年组,这可能是多巴胺能神经元或胆碱能神经元损伤造成膜电位升高。当侧脑室直接注射mNGF后,mNGF可能发挥了抗胆碱酯酶作用,使神经元突触Ach恢复至正常水平,受损神经元异常升高的膜电位得以恢复,从而减轻异常膜电位对神经元持续性或伤害性刺激,使受损的神经元得以修复。实验组小鼠跨越平台次数明显高于AD型组,但低于老年组,老年组运动轨迹主要在原平台位置,AD组则主要分散在外周,而实验组运动轨迹在两者之间。这说明海马回CA1区BDNF和NGF蛋白阳性表达及BDNF mRNA、NGF mRNA高表达可改善AD小鼠学习记忆能力和行为学,而mNGF可促进其合成、营养和修复受损神经元[14]。
综上所述,mNGF能促进AD转基因模型小鼠学习记忆能力,这对改善其行为学起到促进作用。其作用机制可能与调控海马回CA1区中的BDNF和NGF蛋白阳性表达及BDNF mRNA、NGF mRNA的表达密切相关。同时,mNGF也可能通过影响胆碱能神经突触释放神经递质Ach,抑制异常膜电位来减轻神经功能损伤和退化,促进AD转基因模型小鼠脑能量的代谢,修复和营养受损中枢神经来改善AD转基因模型小鼠学习和认知功能。
