高比表面积g-C3N4负载Keggin型Cu单晶取代杂多酸特异性光催化还原CO2制CH4
2019-02-14时晓羽李会鹏蔡天凤
时晓羽,李会鹏,赵 华,蔡天凤
(辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001)
利用光催化还原CO2,一方面可以将太阳能转化为化学能,另一方面可以将CO2还原为碳氢燃料实现碳循环,是一种可持续的能源生产方式,可以减缓温室效应,保障能源安全[1-3]。
石墨相氮化碳(g-C3N4)是一种不含金属的绿色半导体催化剂,具有可调变的层状结构和可替换的C、N原子[4],易于改性。此外,g-C3N4还具有适宜的禁带宽度(2.7 eV)、廉价的原料来源、较强的C—N共价键、强化学/热稳定性、较强的还原性能等优点[5-6],使其在光催化领域具有极大的应用潜力。但g-C3N4光生电子-空穴易复合、量子效率低、比表面积较低。在改性方法中,与其他半导体形成异质结构是一种常用且有效的手段。
杂多酸是含有杂原子的多酸类化合物,是具有强氧化性、强酸性的宽禁带材料,在紫外光照射下具有较高的光响应活性,可发生电子空穴对的分离[7]。通过将杂多酸固载在载体上,能够有效提高它的比表面积,使其具有更高的催化活性及选择性。
本工作采用模板剂法合成了高比表面积的g-C3N4,将Keggin型Cu单取代的杂多酸盐负载到g-C3N4上,对制备的催化剂进行了FTIR、XRD、N2吸附-脱附、UV-Vis漫反射光谱、EIS光谱、荧光光谱表征,通过光催化还原CO2对催化剂的活性及稳定性进行了考察,并对反应机理进行了探究。
1 实验部分
1.1 光催化剂的制备
1.1.1 Cu单晶取代Keggin型杂多酸的制备
将二水合钨酸钠0.11 mol(36.285 7 g)和二水合磷酸氢二钠0.01 mol(1.560 1 g)按摩尔比为11∶1分别溶于适量蒸馏水中,混合,加热至沸腾,反应30 min后停止加热,边搅拌边加入H2SO4溶液调节pH至5左右,加入一定量的CuCl2调节pH=2,稳定反应2 h后冷却至室温,加适量乙醚于反应液中,震荡至没有油状液体滴下,静置,分离,取下层萃取液,于60 ℃下干燥,研磨得白色粉末状产品,记为PW11Cu。
1.1.2 高比表面积g-C3N4的制备
将三聚氰胺与SBA-15(制备方法见文献[8])按质量比3∶1溶于水溶液中,于90 ℃下混合搅拌6 h,离心、干燥,得到的固体粉末在550 ℃下煅烧4 h,制得高比表面积g-C3N4,记为 PCN。
1.1.3 PCN负载PW11Cu催化剂的制备
分别称取0.053,0.111,0.176,0.250 g的PW11Cu溶于去离子水中,加入1 g PCN,在60 ℃水浴中搅拌混合3 h,然后搅拌至干,得到的固体粉末在300 ℃下煅烧 4 h,即得PCN负载PW11Cu催化剂,记为 x%PCN,x=5,10,15,20。
1.1.4 g-C3N4负载PW11Cu催化剂的制备
为比较催化剂的性能,以块状g-C3N4为载体制备15%g-C3N4催化剂。首先将10 g三聚氰胺放在30 mL坩埚中,在550 ℃下煅烧2 h,得到块状g-C3N4。将0.176 g的PW11Cu溶于去离子水,加入1 g块状g-C3N4在60 ℃水浴中搅拌混合3 h,然后搅拌至干,得到的固体粉末在300 ℃下煅烧4 h,制得g-C3N4负载PW11Cu催化剂,记为15%g-C3N4。
1.2 光催化剂的表征
XRD表征采用德国布鲁克公司的D8 Advance型X射线衍射光谱仪,以Cu Kα为辐射源;FTIR表征使用赛默飞世尔科技有限公司的Nicolet iS10型傅里叶变换红外光谱仪,扫描范围600~4 000 cm-1;XPS表征采用赛默飞世尔科技有限公司的Thermo ESCALAB 250型光电子能谱仪;BET表征采用美国Micrometrics公司ASAP 2010型物理吸附仪在-196 ℃下测得;UV-Vis漫反射光谱采用美国安捷伦公司的Agilent Cary 5000型光谱仪进行测定;荧光光谱采用安捷伦科技有限公司Cary Eclipse型荧光分光光度计进行测定。
1.3 光催化还原CO2
利用北京泊菲莱公司的Labsolar-IIIAG型光催化系统进行光催化还原CO2,以300 W氙灯为光源,光照反应时间4 h,将0.02 g催化剂均匀分散于80 mL去离子水中,将CO2充入系统至压力为25 MPa,在暗光下反应30 min至催化剂与CO2达到吸附平衡,而后打开光源反应4 h。产物含量及种类由美国安捷伦公司Agilent 7890A型气相色谱检测。
2 结果与讨论
2.1 催化剂的表征结果
2.1.1 FTIR表征结果
图1为g-C3N4,PCN,x%PCN,PW11Cu的FTIR谱图。由图1可知,对于PW11Cu,在700~1 100 cm-1处出现了Keggin结构的4个特征吸收峰,表明Cu单取代的Keggin型杂多酸已合成[9];对于催化剂g-C3N4、PCN和复合催化剂,810 cm-1处的特征峰归属于三嗪结构单元的伸缩振动[10],1 000~1 700 cm-1附近的特征峰归属于碳氮杂环中C=N和 C—N 的伸缩振动[11],3 000~3 400 cm-1处较宽的特征吸收峰归属于直接加热三聚氰胺后未完全缩聚得到的N—H的伸缩振动[12]。复合催化剂和PCN与g-C3N4的FTIR谱图相似,表明比表面积增加及PW11Cu负载后结构仍与g-C3N4相似;与PCN相比,复合催化剂在887,981 cm-1处出现PW11Cu的特征吸收峰,且峰位向高波数方向移动,表明PW11Cu与PCN不是一种简单的机械混合,而是以化学键的形式结合在一起[13]。
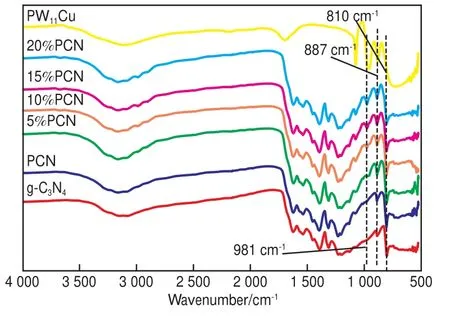
图1 g-C3N4,PCN,x%PCN和PW11Cu的FTIR谱图Fig.1 FTIR spectra of g-C3N4,PCN,x%PCN and PW11Cu.g-C3N4 :graphitic carbon nitride;PCN:high specific surface area g-C3N4;PW11Cu:Keggin type Cu mono-substituted heteropoly acid;x%PCN:different amounts of PW11Cu doped PCN,x=5,10,15,20.
2.1.2 XRD表征结果
图 2为 g-C3N4、PCN、x%PCN 和 PW11Cu的XRD谱图。从图2可知,对于PW11Cu,分别在2θ=7°~12°,16°~22°,25°~30°处有衍射峰,这与Keggin型结构的特征峰一致,表明合成的杂多酸盐具有 Keggin 型结构[14];g-C3N4、PCN和复合催化剂有2个特征峰,2θ=13.1°处的峰对应的是(002)晶面,为melon类结构的特征峰;在2θ=27.5°附近的特征峰为芳香物的层间堆积特征峰,对应(100)晶面[15];对于复合催化剂,在2θ<10°处出现明显的PW11Cu的特征峰,且在2θ=27.5°,13.1°处的峰强度减弱,这表明PW11Cu负载后g-C3N4的结晶度降低。

图2 g-C3N4,PCN,x%PCN和PW11Cu的XRD谱图Fig.2 XRD spectra of g-C3N4,PCN,x%PCN and PW11Cu.
2.1.3 N2吸附-脱附表征结果
图 3 为 g-C3N4、15% g-C3N4、PCN 和 15%PCN催化剂的N2吸附-脱附等温线和孔径分布。
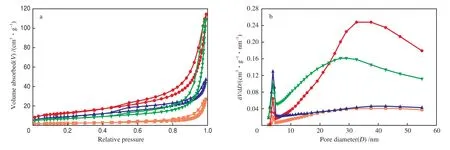
图3 g-C3N4、15%g-C3N4、PCN和15%PCN催化剂的N2吸附-脱附等温线(a)和孔径分布(b)Fig.3 N2 adsorption-desorption isotherms(a) and pore-size distribution curves(b) of g-C3N4,15%g-C3N4(heteropoly acid was loaded on g-C3N4),PCN,15%PCN catalysts.
从图3a可看出,g-C3N4和15%g-C3N4催化剂表现出Ⅱ型等温线,为微孔结构;PCN和15%PCN催化剂表现出Ⅳ型等温线,且在高相对压力处具有H3回滞环,表明PCN和15%PCN催化剂为介孔结构; g-C3N4、15%g-C3N4、PCN 和 15%PCN 催化剂的比表面积分别为7.6,24.9,32.6,46.2 m2/g,PCN和15%PCN催化剂的比表面积分别大于g-C3N4和15%g-C3N4,这主要是由于介孔结构的存在。由图3b可知,g-C3N4和15%g-C3N4的孔径分布集中在3~5 nm处,而PCN和15%PCN的孔径分布集中在5~55 nm处。因此,以SBA-15为模板剂的催化剂的比表面积及孔径均显著提高。
2.1.4 UV-Vis测定结果
图4为催化剂的UV-Vis漫反射谱图及禁带宽度。由图4a可知,g-C3N4催化剂表现出典型的半导体吸收[16],吸收边界为460 nm,与文献的报道结果一致[17-18];负载PW11Cu后,复合催化剂的吸收边界表现出了明显的位移,拓宽至495 nm。这主要是因为负载PW11Cu后改变了催化剂的电子结构。由图4b可知,催化剂的带隙能从2.73 eV降到2.64 eV,表明比表面积的增加及PW11Cu的负载显著影响了催化剂的光学性质及能带结构,提高了可见光的利用率。
2.1.5 EIS和荧光光谱分析结果
光生电子空穴的有效分离能够保证充足的光生电子用于光催化还原CO2。图5a为催化剂的EIS和荧光发射光谱。阻抗弧度越小,电子的转移速率越快,电子-空穴对复合几率越小[19]。由图5a可知,相对于g-C3N4和PCN催化剂,复合催化剂的弧度明显减小,表明阻抗降低,电子-空穴对的复合几率降低;其中,15%PCN表现出最小的弧度,电子-空穴对的复合几率最低。由图5b可知,所有催化剂在460~495 nm处均具有较强的荧光发射峰,与UV-Vis的结果一致。相对于g-C3N4和PCN催化剂,复合催化剂的荧光发射峰强度明显降低,表现出明显的淬灭现象,其中,15%PCN表现出最低的荧光强度,根据荧光发射机理[20],15%PCN的载流子复合几率最低,与EIS结果一致。综上可知,高比表面积及PW11Cu的负载能够显著降低光生电子-空穴的复合几率,但当PW11Cu的掺杂量过高时会形成电子空穴的复合中心,反而不利于电子-空穴的分离。
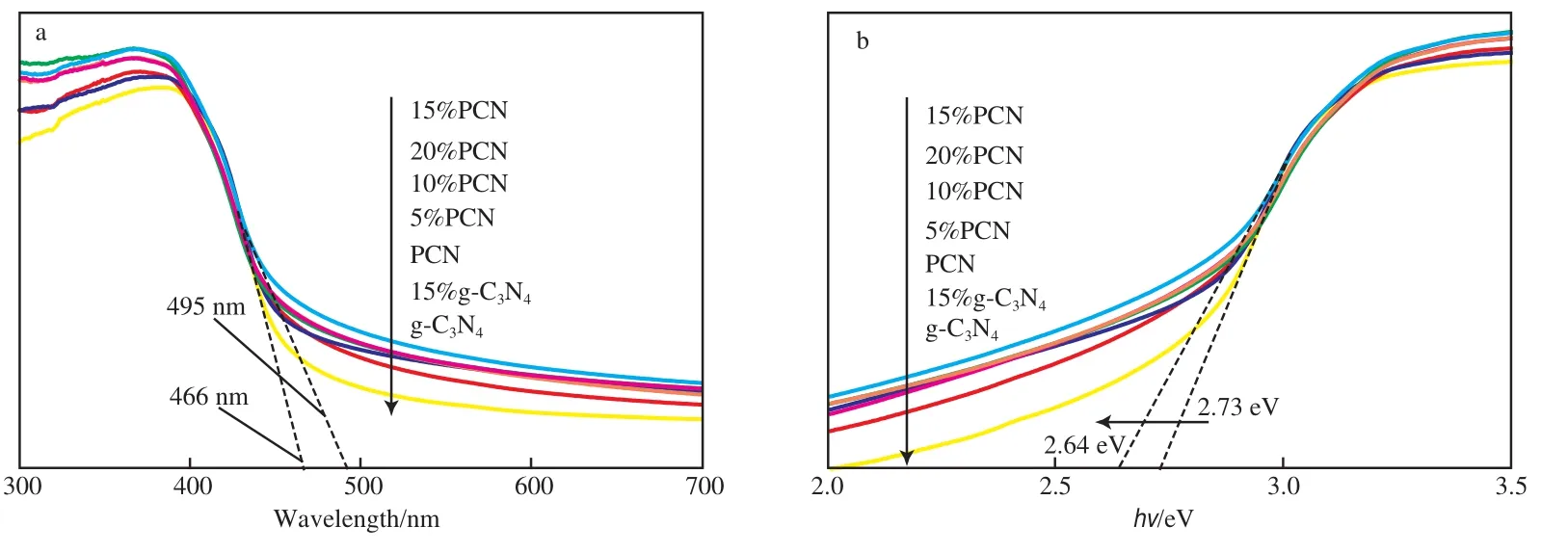
图4 g-C3N4、15%g-C3N4、PCN和15%PCN催化剂的UV-Vis漫反射谱图(a)及禁带宽度(b)Fig.4 UV-Vis diffuse reflection spectra(a) and band gaps(b) of g-C3N4,15%g-C3N4,PCN,15%PCN catalysts.

图5 g-C3N4、15%g-C3N4、PCN和15%PCN催化剂的EIS(a)和荧光发射(b)谱图Fig.5 EIS(a) and photoluminescence(b) spectra of g-C3N4,15%g-C3N4,PCN,15%PCN catalysts.
2.2 催化剂的光催化活性及稳定性评价
图 6为g-C3N4,PCN和x%PCN 光催化剂的催化性能及15%PCN催化剂的稳定性。由图6a可知,CO2的还原产物为CH4,除CH4外无其他还原产物生成。PCN在4 h光照下光催化还原CO2生成 CH4的量为 13.66 μmol/g,分别是 g-C3N4和15%g-C3N4的3.21倍和1.46倍。随PW11Cu负载量的增加,催化剂的活性逐渐升高,其中,15%PCN表现出最佳的催化活性,在4 h光照下光催化还原CO2生成 CH4的量为 32.3 μmol/g,分别是 g-C3N4和15%g-C3N4的7.60倍和3.50倍。此结果表明,比表面积的增加及PW11Cu的负载均能显著提高催化剂的光催化活性,这主要是因为比表面积的增加和PW11Cu的负载均能降低光生电子的复合几率,这与荧光光谱和EIS谱图表征结果相一致,即提高光生电子-空穴的分离效率是提高催化活性的关键。
在300 W氙灯(配以420 nm的滤光片)下照射4 h,通过光催化还原CO2对15%PCN催化剂进行稳定性评价。催化剂使用后,通过离心分离、去离子水洗涤的方式进行回收,由图6b可知,经过5次循环后,还原CO2所生成的CH4量几乎保持不变。表明15%PCN催化剂具有优良的稳定性。随重复次数的增加,CH4量略有下降,这主要是因为在循环过程中催化剂的流失导致的。

图6 g-C3N4,PCN和x%PCN光催化剂的催化性能(a)及15%PCN催化剂的稳定性(b)Fig.6 Photocatalytic performences of g-C3N4,PCN and x%PCN photocatalysts(a) and recycling experiments of 15%PCN photocatalyst(b).Conditions:photocatalysts 2 mg,water 80 mL,80 kPa,300 W,4 h.
3 结论
1)以三聚氰胺、二水合钨酸钠、二水合磷酸氢二钠、CuCl2等为原料,成功制备了Keggin型Cu单晶取代的杂多酸和高比表面积g-C3N4,并将杂多酸负载于g-C3N4上。
2)比表面积的增加及PW11Cu的负载均能有效提高光生载流子的分离效率,拓宽了光响应范围;PW11Cu负载后调节了g-C3N4的能带结构,降低了带隙能,其中,当负载量为15%(w)时,光生电子-空穴的复合几率最低,带隙能最小(2.64 eV)。
3)比表面积的增加及PW11Cu的负载均显著提高了光催化活性,其中,15%PCN表现出最佳的催化活性,生成CH4的量是g-C3N4的7.60倍,循环使用5次后15%PCN催化剂的活性没有明显的降低。
