银杏大麦酒的酿造工艺及品质分析
2019-02-14李傲然胡倬瑜何静仁
李傲然,胡倬瑜,杨 宁,孙 郡,何静仁,何 毅*
(武汉轻工大学 食品科学与工程学院 湖北省农产品加工与转化重点实验室,大宗粮油精深加工省部共建教育部重点实验室,湖北 武汉 430023)
银杏(Ginkgo biloba)又名公孙树。其果实一般为白色,有“白果”之称,具有长梗,外种皮肉质,味甘略苦。银杏果实中富含银杏内酯、黄酮、多酚和银杏酸等药用成分。DEKOSKY S T等[1]研究了银杏在改善记忆和认知方面的相关应用,其还具有益气温肺、止喘咳,抗衰老、保护肝脏等功效[2-3]。
大麦营养成分丰富、全面,含有高纤维、高维生素、低脂肪、低糖、多种微量元素以及β-葡聚糖、α-生育三烯醇、黄酮、γ-氨基丁酸(γ-aminobutyric acid,GABA)、抗性淀粉等多种功能成分[4]。大麦中纤维具有低血糖指数,对糖尿病患者日常生理功能维持有益[5]。AHMEDRM等[6]研究发现,在用双歧杆菌(Bifidobacterium)和嗜酸乳杆菌(Lactobacillus acidophilus)发酵的酸奶中添加大麦β-葡聚糖可以有效降低血浆和肝脏中胆固醇的水平,同时粪便中胆汁酸的排泄增加。IDEHEN E等[7]也研究证明,大麦中富含植物化学物质,具有与癌症、心血管疾病、糖尿病和肥胖等常见营养相关疾病作斗争的潜力。
以银杏果为原料开发的产品众多,在酿酒方面,由银杏果发酵而成的纯天然有保健功能的银杏酒也早已进入市场[8]。银杏果作为优质的酿酒原料,大多都是作为单一的原料用来酿酒。本研究选用银杏和大麦为原料酿造一种口感良好、营养丰富的银杏大麦酒,采用响应面法研究其最佳酿造工艺和酿造过程中总酸、总酚、总黄酮含量的变化规律,然后分析银杏大麦酒的抗氧化活性。为进一步开发兼具银杏与大麦复合香味、营养丰富、保健功效的银杏大麦酒提供参考依据。
1 材料与方法
1.1 材料与试剂
银杏果:产自随州市洛阳镇;大麦:市售;酿酒高活性干酵母:广西丹宝利酵母有限公司;安琪高活性酵母:安琪酵母股份有限公司;福林酚:北京索莱宝科技有限公司;芦丁标准品(纯度≥98%):上海源叶生物科技有限公司;总抗氧化能力检测试剂盒(ABTS法):碧云天生物技术公司;没食子酸(标准品)、硫酸亚铁、水杨酸、酚酞、苯酚等(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
STARTER3100 pH计:普兰德(上海)贸易有限公司;WIATC手持折光仪:上海精密科学仪器有限公司;AL204型电子天平:梅特勒托利多仪器有限公司;SpectraMax M2e酶标仪:美国Molecular Devices公司;Lambda25紫外分光光度计:美国PERKINELMER公司;7890A/5957C气相色谱质谱联用仪:美国Aglient公司。
1.3 方法

1.3.2 菌种的活化
称取适量干酵母,将其投入到10倍35~40℃蒸馏水中,复水15 min,于28℃恒温培养箱中活化2 h。
1.3.3 酵母菌的筛选
将经处理后(大麦粉碎后与打浆好的银杏果混合后糊化、糖化)糖度为20°Bx银杏大麦汁,调节pH至3.6,然后分别加入0.25%安琪高活性干酵母、广西丹宝利酵母、混合酵母(安琪高活性酵母和广西丹宝利酵按1∶1比例混合),在26℃条件下静置发酵13 d,测定其酒精度和糖度,以确定最佳酵母菌。
1.3.4 银杏大麦酒发酵条件优化单因素试验
(1)发酵时间的确定
将经处理后糖度为20°Bx银杏大麦汁,调节pH值至3.6,然后添加0.25%高活性干酵母,在26℃发酵15 d,于第1、3、5、7、9、11、13、15天测定酒液中的酒精度和糖度。
(2)初始糖度的确定
将经处理的银杏大麦汁pH值调至3.6,然后添加0.25%高活性干酵母,调节银杏大麦汁糖度分别至18°Bx、20°Bx、22 °Bx、24 °Bx、26 °Bx,在26 ℃分别发酵13 d,测定各酒液的酒精度和糖度。
(3)接种量的确定
将经处理后糖度为20°Bx银杏大麦汁,调节pH值至3.6,然后分别添加0.10%、0.25%、0.40%、0.55%活性干酵母,在26℃发酵13 d,测定各酒液的酒精度和糖度。
(4)初始pH值的确定
将经处理后糖度为20°Bx银杏大麦汁,调节pH值分别至2.4、2.8、3.2、3.6、4.0,然后添加0.25%活性干酵母,在26 ℃分别发酵13 d,测定各酒液的酒精度和糖度。
(5)发酵温度的确定
将经处理后糖度为20°Bx银杏大麦汁,调节pH值至3.6,然后添加0.25%高活性干酵母,分别在18℃、22℃、26℃、30℃、34℃培养箱中发酵13 d,测定各酒液的酒精度和糖度。
1.3.5 银杏大麦酒发酵条件优化的响应面试验
在单因素试验分析结果基础上,采用Box-Behnken响应面设计方法,选择初始糖度(A)、接种量(B)、初始pH值(C)和发酵温度(D)这4个影响较大的因素,设计4因素3水平响应面试验,以酒精度(Y)为响应值进行优化,因素水平设计见表1。
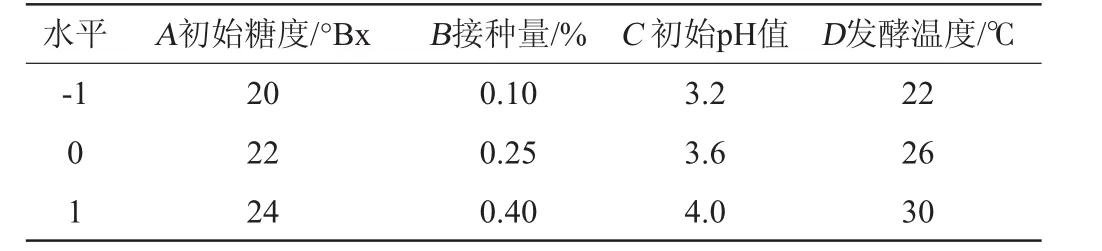
表1 大麦酒发酵条件优化Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken experiments for ginkgo-barley wine fermentation conditions optimization
1.3.6 理化指标的测定
pH值采用STARTER3100 pH计测定;可溶性固形物(糖度):采用手持折光仪测定,所得数值均校正为20℃条件下的数值;总酸含量:采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》中指示剂法测定[9];酒精度:采用分光光度计法测定[10-11]。
总黄酮含量的测定:吸取质量浓度为0.174 561 mg/mL芦丁标准液0 mL、1 mL、2 mL、3 mL、4 mL、5 mL于10 mL的容量瓶中,分别加入5%的NaNO2溶液0.3 mL还原6 min;加入10%的Al(NO3)3溶液0.3 mL络合6 min;加入质量分数为4%(1 mol/L)的NaOH溶液4 mL;最后用体积分数60%乙醇定容,摇匀,显色20 min。在波长506 nm条件下测定吸光度值,绘制芦丁标准曲线,得溶液吸光度值A与芦丁质量浓度C(mg/mL)的回归方程:A=0.012 7C+0.093 3(R2=0.999 6)。再利用紫外分光光度计测定待测液的吸光度值,然后利用回归直线方程得出所取样品液中的总黄酮含量[12]。
总酚含量的测定:采用Folin-Ciocalteu法[13]。精确称取干燥恒质量的没食子酸10.0 mg,溶解后加水定容到100 mL,配成0.1 mg/mL的没食子酸标准溶液。准确吸取没食子酸标准溶液0、0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,于10 mL刻度试管中,加5.0 mL蒸馏水,再加0.5 mL福林酚试剂,摇匀1 min后再加入1.5 mL 20%碳酸钠溶液,于室温反应2 h。在波长760 nm处测定标准溶液的吸光度值,得溶液吸光度值A与没食子酸质量浓度C(mg/mL)的回归方程:A=9.916C+0.003(R2=0.9997)。
准确量取样品0.1 mL于10 mL刻度试管中,按标准曲线制备操作步骤于760 nm波长处进行吸光度值的测定(样液如有沉淀,应过滤后测定)。根据标准曲线的线性方程计算总酚含量。
1.3.7 抗氧化能力测定
(1)羟基自由基清除能力的测定
参照文献[14]采用水杨酸法,于波长510 nm处测定吸光度值。羟基自由基清除率按下式计算:
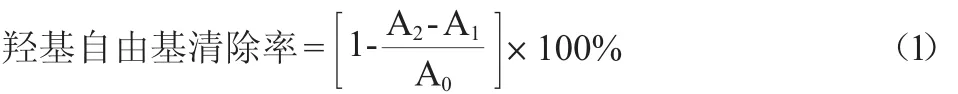
式中:A0为空白对照的吸光度值;A1为无水杨酸时样品的吸光度值;A2为加入样品后的吸光度值。
(2)DPPH自由基清除能力的测定
参照文献[15-16]采用DPPH·法测定清除DPPH·能力。在波长517 nm下测定吸光度值。DPPH·清除率按下式计算:
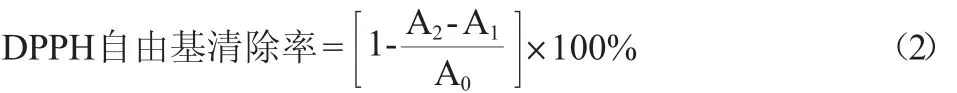
式中:A0为DPPH·与无水乙醇混合液的吸光度值;A1为无水乙醇调零,加入样品溶液后的吸光度;A2为样品溶液与无水乙醇混合液的吸光度值。
(3)ABTS法测定总抗氧化能力
采用ABTS法测定总抗氧化能力。在波长735 nm下测定各种浓度的Trolox标准溶液吸光度值。得到并根据标准曲线(A=-0.778 9C+1.224 5(R2=0.999 3))计算出样品的总抗氧化能力[17]。
1.3.8 数据处理
采用SPSS19.0软件,对试验结果进行统计分析,统计方法采用方差分析进行各试验组间的显著性检验。
2 结果与分析
2.1 发酵菌种的确定
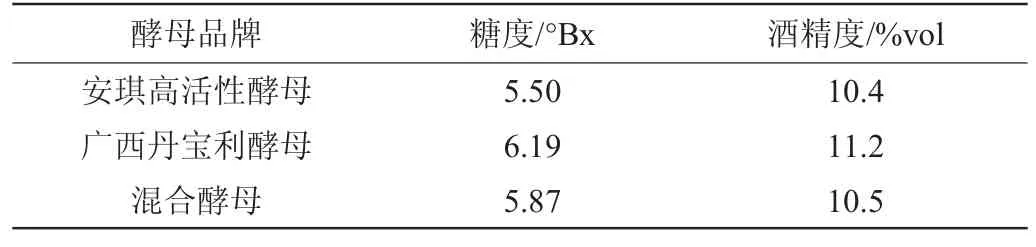
表2 不同酵母对酒精发酵的影响Table 2 Effect of different yeasts on alcoholic fermentation
不同菌种对酒精发酵的影响见表2。在广西丹宝利酵母发酵时,发酵液中酒精度最高,由此可知,广西丹宝利酵母的发酵能力和速率优于安琪高活性酵母和混合酵母。此外,在使用广西丹宝利酵母发酵时,消耗了相对较少的糖分却产生较高的酒精度,综合考虑选择广西丹宝利酵母作为银杏大麦酒的发酵用酵母。
2.2 银杏大麦酒发酵条件优化单因素试验
2.2.1 发酵时间对银杏大麦酒酒精度和糖度的影响
发酵时间对酒精发酵影响的结果见图1。发酵初期的1~7 d,发酵液中的糖含量急剧降低,同时发酵液的酒精度上升至10%vol左右,发酵至13 d时酒精度达到最大值(11.3%vol)。后续发酵银杏大麦酒的酒精度不变,发酵时间过长,对果酒的品质风味会有所影响,综合考虑,发酵时间定为13 d。
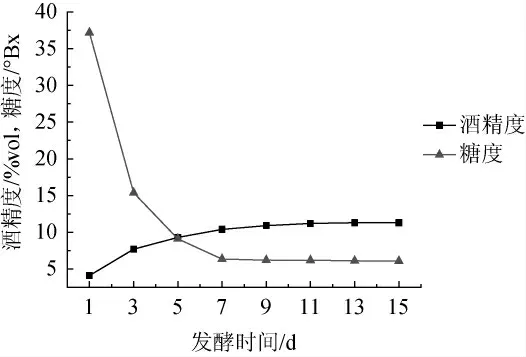
图1 发酵时间对酒精发酵的影响Fig.1 Effect of fermentation time on alcoholic fermentation
2.2.2 初始糖度对银杏大麦酒酒精度和糖度的影响
初始糖度对酒精发酵影响的结果见图2。由图2可知,经同时段发酵,发酵液中酒精度随着初始糖度的增加呈先增后减的趋势。因为糖既是酵母菌的生长繁殖的“必需品”,也是其代谢合成酒精等物质的原料。因此,随着发酵液中初始糖度的增加,酵母菌的生长和代谢速率都加快,酒精产生量增加,但糖度过高则会抑制酵母菌生长繁殖和代谢。综合考虑,确定22°Bx为银杏大麦酒发酵的最佳初始糖度。
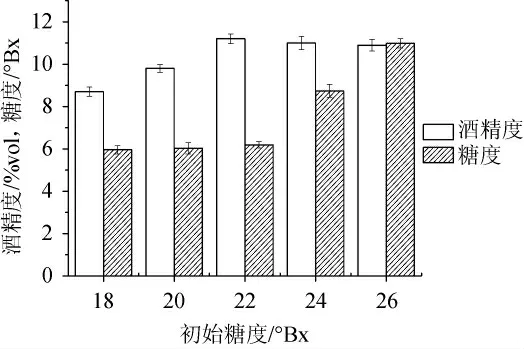
图2 初始糖度对酒精发酵的影响Fig.2 Effect of initial sugar content on alcoholic fermentation
2.2.3 酵母菌接种量对银杏大麦酒酒精度和糖度的影响
接种量对酒精发酵影响的结果见图3。由图3可知,随着接种量的增加,发酵液中糖度持续降低,酒精度呈先增后减趋势。结果表明在一定范围内,酿酒酵母接种量适当增加有利于发酵过程的快速启动和代谢产物生成,有利于酒精的生成,减少污染杂菌的机会[18]。综合考虑,确定0.25%为银杏大麦酒发酵的最佳酵母菌接种量。
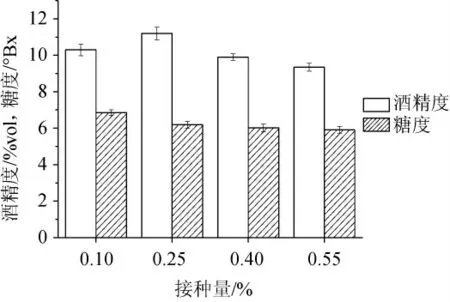
图3 接种量对酒精发酵的影响Fig.3 Effect of inoculum on alcoholic fermentation
2.2.4 初始pH值对银杏大麦酒酒精度和糖度的影响
由图4可知,从pH值2.4开始,随着发酵液初始pH值逐渐增大,银杏大麦酒的酒精度呈先增后减趋势,当发酵液初始pH值为3.6时,酒体中酒精度达到最高。出现变化主要原因是酵母有适合其生长、繁殖和代谢的pH范围。当pH过低或过高时,酵母的生长和繁殖受到抑制,代谢活性降低,产生的酒精量减少。因此,确定pH值3.6为银杏大麦酒酿造的最佳初始pH值。
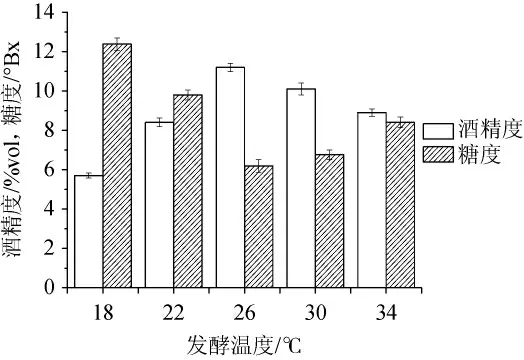
图5 发酵温度对酒精发酵的影响Fig.5 Effect of fermentation temperature on alcoholic fermentation
2.3 银杏大麦酒发酵条件优化响应面试验
2.3.1 响应面设计及结果
将初始糖度、接种量、初始pH值和发酵温度作为评价因素,以银杏大麦酒的酒精度(Y)为响应值,共设29个试验点,银杏大麦酒的响应曲面试验设计方案与试验结果如表3所示。利用Design-Expert软件对表3中试验数据进行多元回归拟合,得到酒精度(Y)对自变量A(初始糖度)、B(接种量)、C(初始pH值)、D(发酵温度)的回归方程[18]:

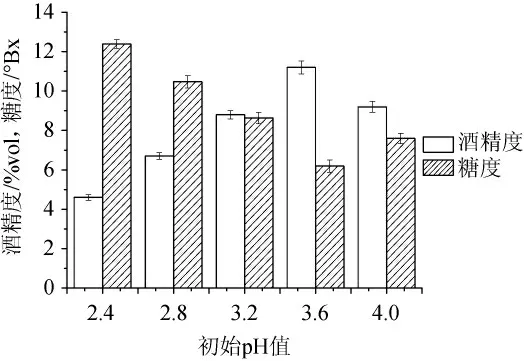
图4 初始pH值对酒精发酵的影响Fig.4 Effect of initial p H value on alcoholic fermentation
2.2.5 发酵温度对银杏大麦酒酒精度和糖度的影响
由图5可知,发酵温度从18℃升高到34℃时,发酵液中酒精度含量呈先增后减趋势。26℃时发酵液中酒精度最高、糖度最低。主要原因是温度影响酵母菌的生长,随着温度升高,酵母对糖的消耗以及代谢产生酒精的速率加快。当温度过高时,酵母老化加快,导致产生的酒精量减少,容易造成杂菌污染,严重影响银杏大麦酒的风味和口感。因此,选择26℃作为银杏大麦酒的最佳发酵温度。
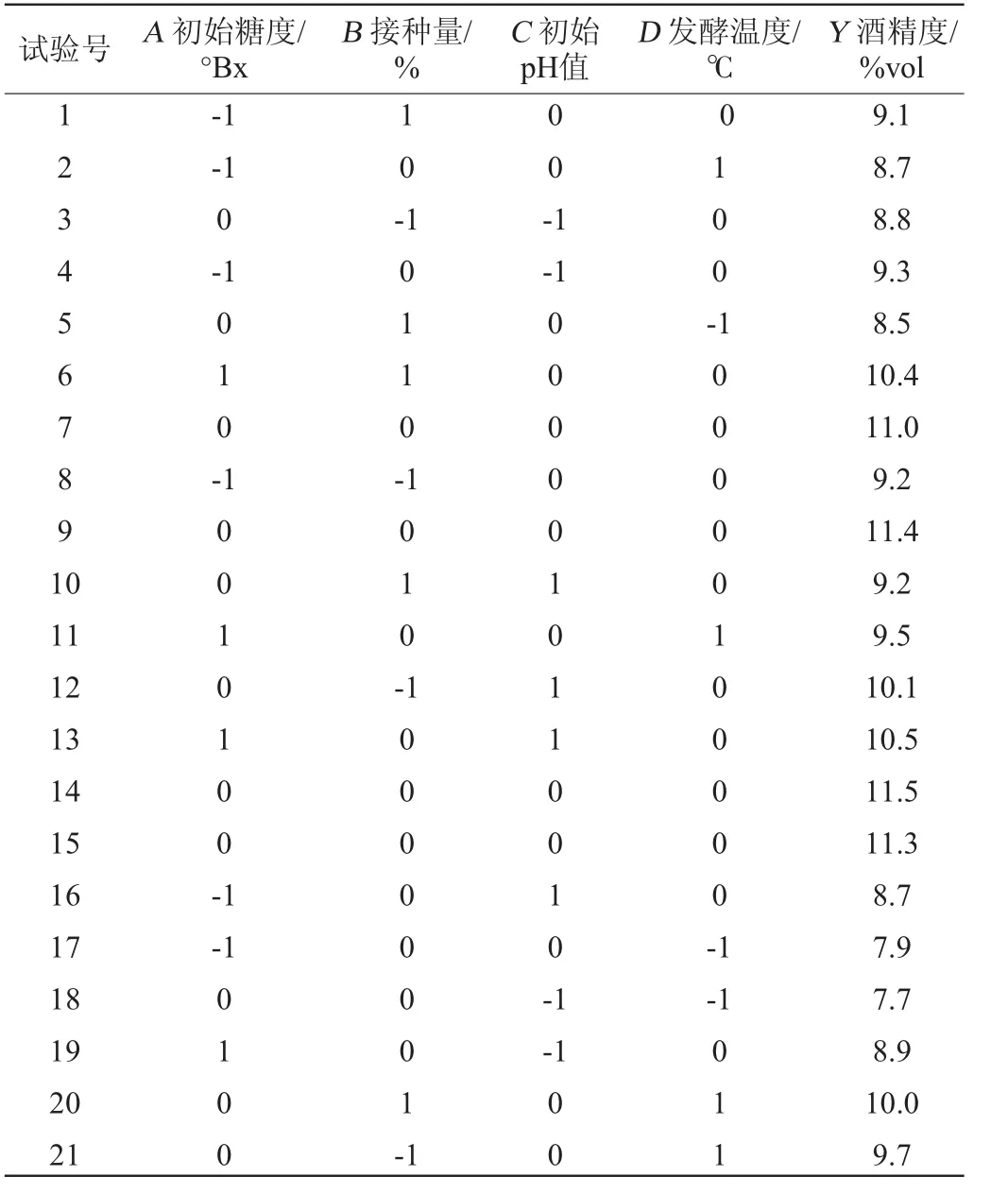
表3 大麦酒发酵条件优化Box-Behnken试验设计及结果Table 3 Design and results of Box-Behnken experiments for ginkgo-barley wine fermentation conditions optimization
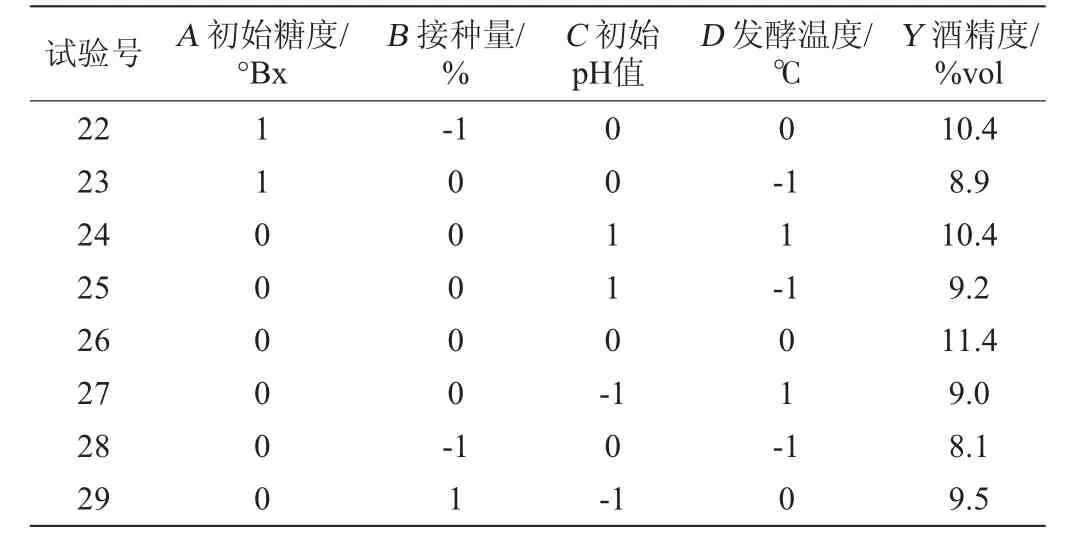
续表
2.3.3 响应面交互作用分析
银杏大麦酒酒精度对初始糖度、接种量、初始pH值和发酵温度4因素回归模型的响应曲面和等高线如图6所示。在交互作用对银杏大麦酒的酒精度影响中,初始糖度与初始pH值的交互作用最显著(P<0.01),其次是接种量与初始pH值的交互作用显著(P<0.05),而初始糖度与接种量、初始糖度与发酵温度、接种量与发酵温度和初始pH值与发酵温度的交互作用不显著(P>0.05),这与方差分析结果一致。
2.3.2 回归模型的方差分析
对银杏大麦酒发酵条件的数学模型进行方差分析,以检验方程的有效性和各因子的偏回归系数,回归模型的方差分析如表4所示。由表4可知,该试验选用的模型极显著(P<0.01),方差的失拟项不显著(P=0.074 0>0.05),即模型选择合适;同时,所选模型的校正决定系数R2=0.941 7,表明此模型能解释94.17%的结果值变化,仅有总变异5.83%不能用该模型解释,基本可用于银杏大麦酒发酵条件的分析和预测。在此试验设计的作用因素中,一次项A(初始糖度)、C(初始pH值)、D(发酵温度)、二次项A2、B2、C2、D2及交互项AC对银杏大麦酒酒精度的影响极显著(P<0.01),交互项BC对银杏大麦酒酒精度的影响显著(P<0.05),B(接种量)及交互项AB、AD、BD、CD对银杏大麦酒酒精度的影响均不显著(P>0.05)。
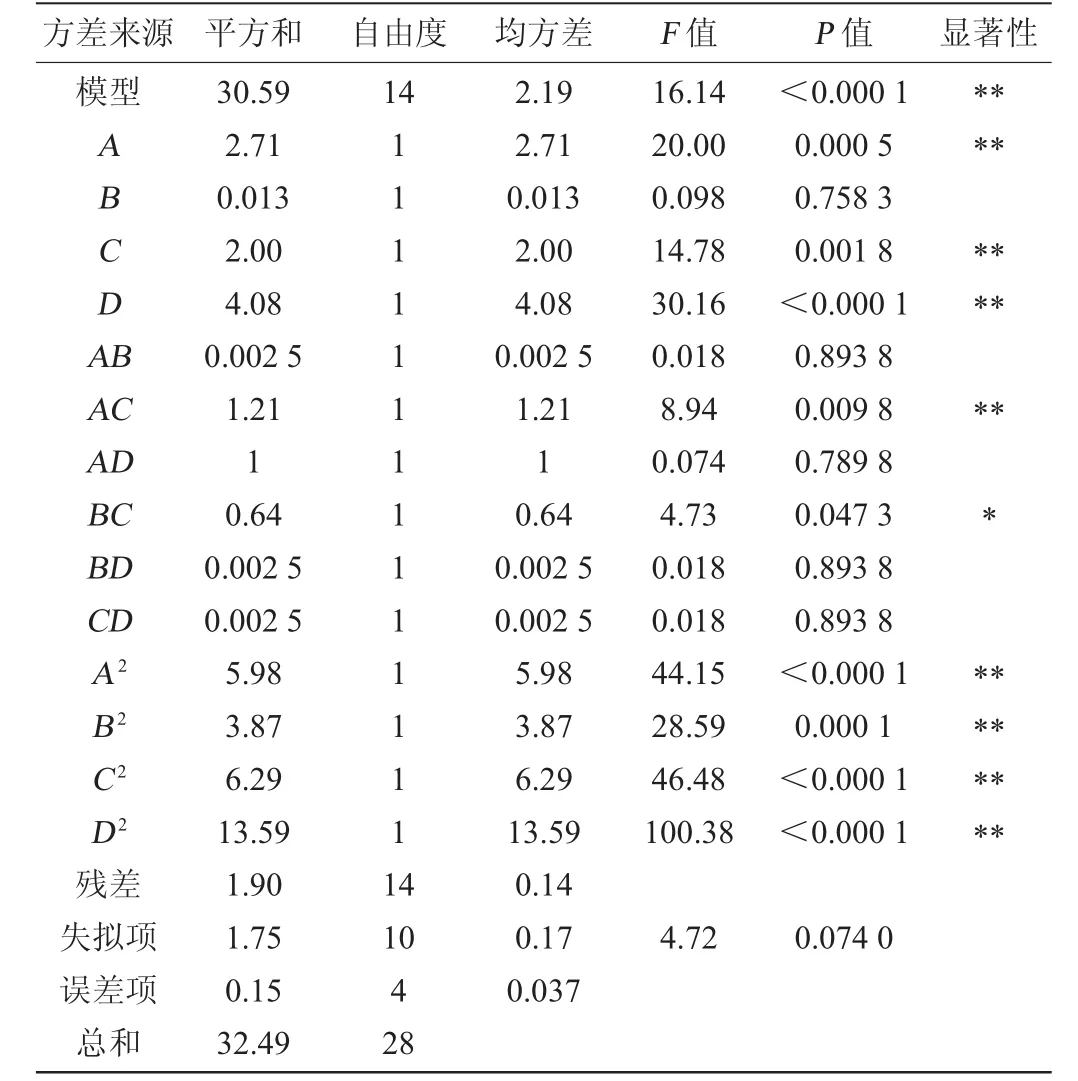
表4 回归方程方差分析Table 4 Variance analysis of regression equation
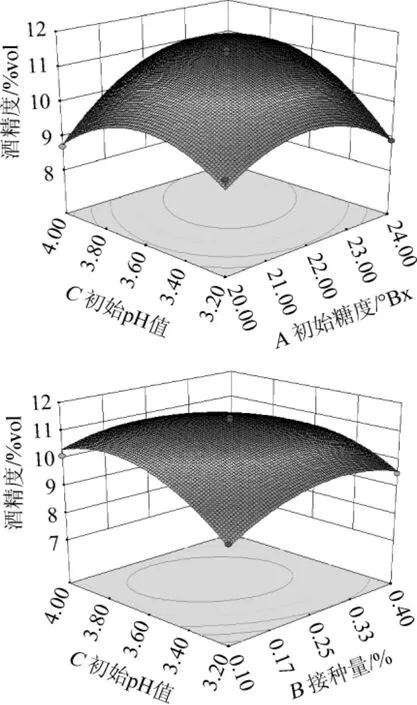
图6 初始p H值、初始糖度以及接种量的交互作用对银杏大麦酒酒精度影响的响应面和等高线Fig.6 Response surface and contour line of effects of interaction between initial pH value,sugar content and inoculum on the alcohol content of ginkgo-barley wine
2.3.4 最佳发酵条件的确定
根据Box-Behnken Design试验分析的结果和二次多项回归方程,利用Design Expert 8.0.6.1软件,可获得银杏大麦酒的最佳发酵条件,即初始糖度22.80°Bx、接种量0.24%、初始pH值3.70、发酵温度27.0℃。在此最优条件下,银杏大麦酒的酒精度最高,为11.51%vol。为验证此模型的可靠性,在最优条件下进行3次平行试验,结果表明,所得银杏大麦酒的平均酒精度为11.46%vol;与理论预测值相比,其相对误差约为0.43%,说明模型可以较好地反映出银杏大麦酒的发酵条件,也再次证明了通过响应曲面法对银杏大麦酒的发酵条件进行优化是可行的。
2.4 发酵过程中总酸含量的变化
发酵过程中总酸含量的变化如图7所示,银杏大麦酒的总酸含量在发酵过程中呈现先显著上升后缓慢下降的趋势,在发酵第3天时达到最高,为121 mg/100 mL。原因是酵母菌在发酵前3 d的发酵过程中也会形成少量的有机酸,如乙酸、月桂酸、柠檬酸和酒石酸等[20],使酒液的总酸呈显著上升趋势。在发酵后期,总酸含量在保持稳定的基础上略有下降,保持在80~100 mg/100 mL,是因为二氧化碳缓慢溢出,同时部分酸性物质转化成了酯、醛、酮等其他物质,使总酸含量缓慢下降。
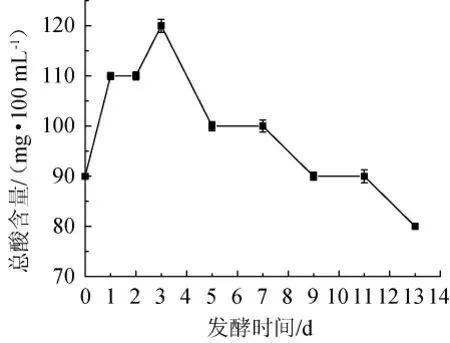
图7 发酵过程中总酸含量的变化Fig.7 Changes of total acid content during the fermentation
2.5 发酵过程中总酚含量的变化
发酵过程中总酚含量的变化如图8所示,银杏大麦酒中的总酚含量呈现先上升后下降,最后小幅升降的趋势。发酵前期由于出汁量较多或者产生的乙醇有利于酚类物质的溶出,使过久的总酚含量增加,并在发酵第2天时达到最高,为0.34 mg/mL。随着氧化时间延长,随着酵母菌和银杏果和大麦原始菌群的生长繁殖,微生物在代谢过程中产生的酶会使多酚类物质发生降解,使得总酚含量呈下降趋势。7~13 d,总酚含量呈小幅升降的趋势,这可能是由于之前未溶出的酚类物质随着发酵时间的推移慢慢溶出及后续慢慢被氧化造成的[21-22]。
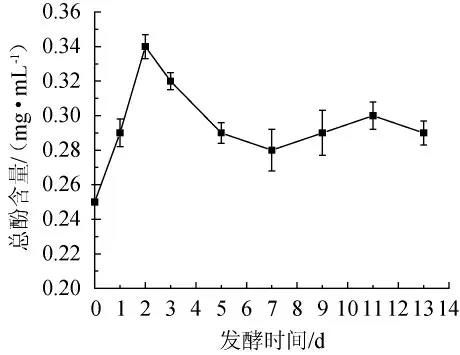
图8 发酵过程中总酚含量的变化Fig.8 Changes of total phenols content during the fermentation
2.6 发酵过程中总黄酮含量的变化
发酵过程中总黄酮含量的变化如图9所示,在银杏大麦酒的前酵阶段,发酵时间不超过2 d时,黄酮含量下降速度较快,而在银杏大麦酒的后酵阶段,发酵7 d后,银杏大麦酒中黄酮含量下降较缓慢,并趋于平稳。总黄酮的含量呈下降趋势,是由于黄酮难溶于水而较易溶于乙醇溶液,随着发酵过程的进行将有越来越多的黄酮迁移至酒体中。从而银杏大麦酒和大麦银杏酒中的黄酮的含量明显下降。
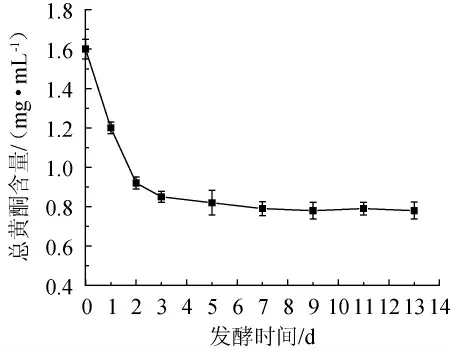
图9 发酵过程中总黄酮含量的变化Fig.9 Changes of total flavonoids content during the fermentation
2.7 抗氧化性的变化
2.7.1 羟基自由基清除能力的测定
由图10所示,羟基自由基的清除率缓慢上升,最终数值稳定在98%左右。是由于银杏大麦酒中功能性成分如总酚、多糖等含量较高,这些功能性成分对·OH具有较好的清除能力。
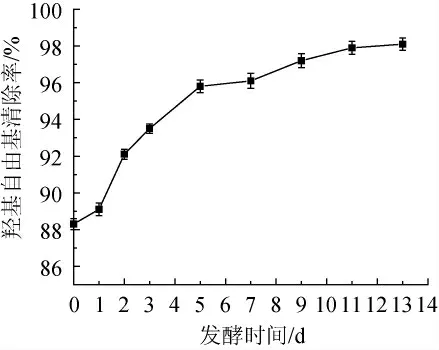
图10 不同发酵时间大麦酒的羟基自由基清除率Fig.10 Hydroxyl radical scavenging rate of ginkgo-barley wine with different fermentation time
2.7.2 DPPH自由基清除能力的测定
如图11所示,银杏大麦酒对DPPH自由基清除率呈先升后降,之后趋于稳定的趋势,最后测量值稳定在37%左右。发酵前期与总酚的变化基本一致,在发酵前期抗氧化能力提高是由于酚类化合物含量增加引起的,之后的下降是由于酚类物质被氧化或被酶解造成的,也可能因为黄酮的不稳定性及发酵过程中产生的酶分解了酚类等大分子物质,导致抗氧化性降低。
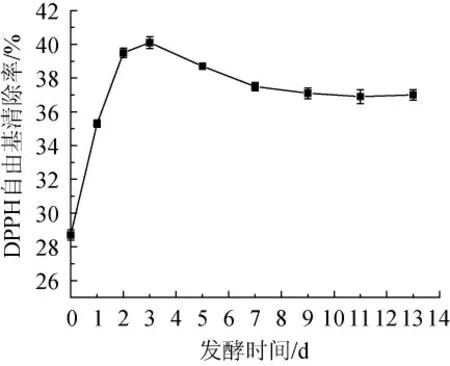
图11 不同发酵时间大麦酒的DPPH自由基清除率Fig.11 DPPH radical scavenging rate of ginkgo-barley wine with different fermentation time
2.7.3 总抗氧化能力测定
如图12所示,总抗氧化性能力总体呈先升后降,之后趋于平稳的趋势,总抗氧化能力的变化可能与发酵过程中酚类物质解离和聚合等复杂反应以及银杏果实中游离酚和结合酚的含量有关[23]。由图8和图12可知,银杏大麦酒中总酚含量与总抗氧化能力的变化基本一致。
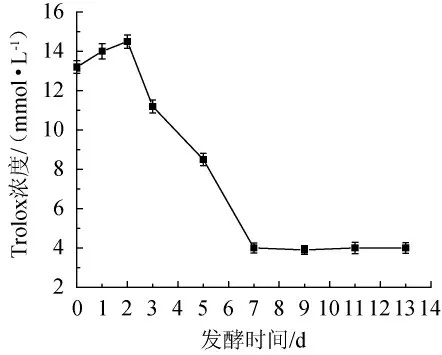
图12 不同发酵时间大麦酒的总抗氧化能力变化Fig.12 Total antioxidant capacity changes of ginkgo-barley wine with different fermentation time
3 结论
以银杏果和大麦为原料,采用单因素试验和Box-Behnken试验设计对银杏大麦酒的酿造工艺进行优化,得到最佳工艺条件:初始糖度22.80°Bx、接种量0.24%、初始pH值3.70、发酵温度27.0℃。在该工艺下酿造的银杏大麦酒的酒精含量在11.4%vol左右,属于低酒精度饮料酒。银杏大麦酒经发酵后总酸含量维持在80~100 mg/100 mL,总酚含量保持在0.3 mg/mL左右,其羟基自由基清除率稳定在98%左右,DPPH自由基清除率稳定在37%左右,总抗氧化性能力指标保持在较高的水平。但酿造过程中酒体中黄酮类物质会有一定程度的损失,因此还需要对酿造工艺进行改进,以最大程度的保留黄酮类物质,以进一步增强其保健功能。
