一株高产胞外多糖乳酸菌的分离鉴定及其产胞外多糖的研究
2019-02-14黄承敏王蓉蓉刘成国
黄承敏,肖 茜,王蓉蓉,刘成国,姚 慧,周 辉*
(1.湖南农业大学 食品科学技术学院 湖南省食品科学与生物技术重点实验室,湖南 长沙 410128;2.湖南南山牧业有限公司,湖南 城步 422512)
乳酸菌(lactic acid bacteria,LAB)是一类能够利用可发酵糖产生大量乳酸的细菌的通称,作为公认安全的益生菌,乳酸菌可促进肠道有益微生物的生长,对腹泻、肠易激症、过敏、乳糖不耐症、刺激反应等均有一定的功效[1],因而在工业、农业、医学等领域有着重要的应用价值。而许多乳酸菌的益生作用与其所产生的胞外多糖有着密切的关系。乳酸菌胞外多糖(lactic acid bacteria-exopolysaccharide,LAB-EPS)是一些特殊微生物在生长代谢过程中分泌到细胞壁外、渗透到培养基中、易与菌体分离的一类多糖类化合物,对微生物的生长有重要意义[2-3]。
胞外多糖是一种由重复单元和分支所组成的高分子量多糖,在保护微生物抵御脱水、营养缺乏、有毒物质、噬菌体、渗透压和拮抗物等不利条件时有重要作用[4]。诸如黄原胶、硬葡聚糖、结冷胶、热凝多糖、右旋糖苷、短梗霉多糖、细菌纤维素等胞外多糖都已经成功地应用于食品、医学、制药、化妆品及石油行业中[5-6]。根据存在位置的不同,LAB-EPS可以分为两种:荚膜多糖(capsular polysaccharides,CPS)和粘多糖(slimepolysaccharide,SPS),但这两种多糖因为结合在一起很难区分而统称为胞外多糖[7-8]。从化学组成上,乳酸菌胞外多糖可分为同型多糖(homopolysaccharides,Ho PS)和杂多糖(heteropolysaccharides,He PS)两种类型,在过去的10年里,Ho PS是研究最为广泛的一类LAB-EPS[9-10]。近年来,胞外多糖已成为乳酸菌资源开发利用中的研究热点,但是由于某些产胞外多糖微生物的产量较低,胞外多糖的应用受到限制,所以提高微生物胞外多糖产量至关重要。目前,通过优良高产菌株的筛选、改良菌株和优化发酵条件等方法能在一定程度上提高微生物胞外多糖的产量[11-12]。
剁辣椒属于传统发酵蔬菜,其传统加工方法是利用乳酸菌的自然发酵和食盐保存作用进行加工处理,目前从剁辣椒中分离出的乳酸菌主要是植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)、戊糖片球菌(P ediococcus pentosaceus)等,但主要以乳杆菌为主[13-15]。本研究旨在从自然发酵剁辣椒中筛选出高产胞外多糖的乳酸菌菌株,利用形态观察、生理生化试验结合分子生物学方法对其进行鉴定,并初步探讨了不同碳源、时间对乳酸菌产胞外多糖的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
自然发酵剁辣椒:食品微生物实验室自制,制作方法参照文献[15]。
1.1.2 培养基
MRS固体培养基:蛋白胨10.0 g、牛肉粉5.0 g、酵母粉4.0 g、柠檬酸三铵2.0 g、葡萄糖20.0 g、吐温80 1.0 mL、乙酸钠5.0 g、磷酸氢二钾2.0 g、硫酸镁0.2 g、硫酸锰0.05 g、琼脂15.0 g、蒸馏水1 L,pH 6.4、121 ℃灭菌15 min。
MRS液体培养基:MRS固体培养基中不添加琼脂。
1.1.3 试剂
硫酸、苯酚、无水乙醇、三氯乙酸等:均为国产分析纯试剂;细菌基因组(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限(北京)有限公司;
1.2 仪器与设备
TF-FD-1L冷冻干燥机:上海拓纷机械设备有限公司;HR/T16M台式高速冷冻离心机:湖南赫西仪器装备有限公司;GZ-400-S生化培养箱:韶关市广智科技设备有限公司;101型电热鼓风干燥箱:北京市永光明医疗仪器厂;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;V-5000可见分光光度计:上海元析仪器有限公司;AG 22331 Hamburg聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:德国Eppendorf公司。
1.3 试验方法
1.3.1 产胞外多糖乳酸菌的筛选
称量25 g自然发酵的剁辣椒,加入225 mL无菌生理盐水中,摇匀并制备梯度稀释液,吸取合适稀释度的稀释液0.1 mL涂布于MRS固体平板,37℃培养48 h。观察并记录菌落特征。用无菌移液器枪头轻轻挑取单菌落,观察有无连续的拉丝。将有连续拉丝的单菌落挑取至MRS平板上进行划线纯化,纯化得到的单菌落进行保存。
1.3.2 胞外多糖的提取及测定
(1)胞外多糖的提取[16]
将初筛得到的菌株Y-20活化后,转接至MRS液体培养基中,37℃培养24 h,取培养液于冷冻离心机中10 000 r/min、4℃离心10 min,去菌体,沸水浴5 min,冷却至室温,加80%三氯乙酸(trichloroacetic acid,TCA)至终浓度为10%,充分搅拌后静置30 min,10 000 r/min离心10 min,取上清液。将上清液移至烧杯中,加3倍体积的体积分数为95%的乙醇,4℃醇沉过夜,多糖呈絮状沉淀析出,于4℃、10 000 r/min条件下离心10 min,去上清,将沉淀溶于10 mL蒸馏水中,装入透析袋,透析2 d,每8 h换一次水,得胞外粗多糖水溶液。
(2)胞外多糖的测定[17]
取25 mL带塞试管,分别吸取100μg/mL葡萄糖标准液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL、1.8 mL、2.0 mL于每支试管中,蒸馏水补足至2 mL,然后分别加入2 mL 6%苯酚溶液,摇匀,然后迅速加入浓硫酸10 mL,立即摇匀,室温静置30 min,在波长490 nm处测定各反应液的吸光度值,以葡萄糖系列质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线。
在带塞试管中加入胞外粗多糖水溶液2 mL,另取2 mL蒸馏水作为空白对照,然后分别加入6%苯酚溶液2 mL,摇匀后迅速加入浓硫酸10 mL,立即摇匀,室温静置30 min,在波长490 nm处测定各溶液的吸光度值,按照葡萄糖标准曲线回归方程计算胞外多糖的含量。
1.3.3 菌株的鉴定
(1)形态观察
将筛选得到的菌株纯化后转接至MRS固体培养基上,观察菌落的形态、大小、透明度、色泽、致密度、边缘情况;挑取单菌落进行革兰氏染色、镜检,观察菌株的颜色、形状、有无芽孢情况[18]。
(2)生理生化鉴定
对筛选得到的乳酸菌进行碳源利用试验、产酸产气试验、硝酸盐还原试验、淀粉水解试验、明胶液化试验[19]。
(3)分子生物学鉴定
按照细菌基因组DNA提取试剂盒说明书提取乳酸菌的基因组,以其为模板进行16S rDNA PCR扩增。PCR扩增引物:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′);反向引物1541R(5′-AAGGAGGTGATCCAGCC-3′)。PCR扩增体系参照文献[15]。PCR扩增条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min 30 s,30次循环;72℃再延伸10 min。PCR扩增产物经琼脂糖凝胶检验合格后送至华大基因科技有限公司进行测序。测定后的结果登陆美国国立生物技术信息(national center for biotechnology information,NCBI)进行Blast比对,采用Mega软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.3.4 碳源种类对菌株Y-20产EPS的影响
用MRS培养基为基础培养基,培养基中的葡萄糖分别用等质量的葡萄糖、D-果糖、蔗糖、α-乳糖、麦芽糖替换,培养基灭菌后,按3%(V/V)接种量接种活化后的菌株Y-20,37℃培养48 h,测定发酵液中胞外多糖含量。探讨培养基中不同碳源对菌株Y-20胞外多糖产量的影响。
1.3.5 培养时间对菌株Y-20产EPS的影响
按3%接种量接种活化后的菌株Y-20至MRS液体培养基中,37℃条件下进行静置培养,每间隔4 h测定菌液在波长600 nm处的吸光度值,同时测定发酵液中的胞外多糖含量。
2 结果与分析
2.1 筛选结果
从自然发酵剁辣椒中筛选出一株疑似产胞外多糖的乳酸菌Y-20,根据葡萄糖标准曲线(y=0.681 5x-0.027 7,R2=0.996 1)测得菌株Y-20所产胞外多糖的产量为213 mg/L,通过与已报道文献[2-3]的比较,菌株Y-20所产胞外多糖的含量较高。
2.2 菌株Y-20的鉴定
2.2.1 形态观察
菌株Y-12的菌落形态和细胞形态见图1。

图1 菌株Y-20在MRS琼脂培养基上的菌落形态(A)及细胞形态(B)Fig.1 Colony morphology(A)and cell morphology(B)of strain Y-20 on MRS agar medium
由图1A可知,菌株Y-20的菌落呈圆形、凸起、微白色、湿润、边缘整齐、不透明,直径为3 mm左右,菌落背面为黄色。由图1B可知,菌株Y-20无芽孢、革兰氏染色阳性、杆菌。因此,初步鉴定为一株乳酸菌。
2.2.2 生理生化鉴定结果
菌株Y-20过氧化氢酶试验和硝酸盐还原试验呈阴性、不能液化明胶、不产生硫化氢气体、能在pH 4.5的MRS液体培养基中生长、能水解淀粉。菌株Y-20的碳源利用试验结果见表1。

表1 菌株Y-20的碳源利用试验结果Table 1 Carbon source utilizing test results of strain Y-20
由表1可知,菌株Y-20能利用阿拉伯糖、木糖、核糖、葡萄糖、甘露糖、果糖、半乳糖、蔗糖、麦芽糖、乳糖、棉籽糖、甘露醇、山梨醇、水杨苷、葡萄糖酸钠;不能发酵纤维二糖、松三糖、菊粉、肌醇、七叶苷、扁桃苷。根据文献鉴定标准[8],初步鉴定菌株Y-20为乳酸杆菌属(Lactobacillus)。
2.2.3 分子生物学鉴定
菌株Y-20的16S rDNA基因PCR扩增结果见图2。
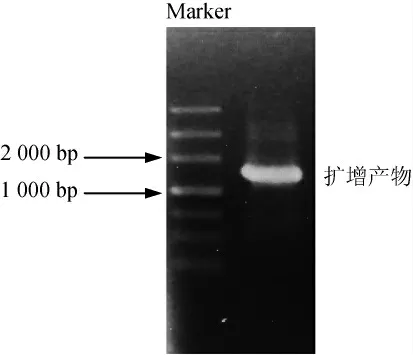
图2 菌株Y-20的16S rDNA PCR扩增产物电泳图Fig.2 Electrophoretogram of PCR amplification products of 16S rDNA of strain Y-20
由图2可知,PCR扩增得到的基因片段大小在1 500 bp左右,与预测基因相符。将PCR扩增产物进行测序,测序结果登录NCBI网站进行Blast序列比对,选取同源性较高的菌株构建系统发育树,结果见图3。

图3 基于16S rDNA序列菌株Y-20的系统发育树Fig.3 Phylogenetic tree of strain Y-20 based on 16S rDNA sequences
由图3可知,菌株Y-20与植物乳杆菌(Lactobacillus plantarum)聚于一支,结合形态观察及生理生化试验的结果,鉴定菌株Y-20为一株植物乳杆菌(Lactobacillus plantarum)。
2.3 碳源种类对菌株Y-20产胞外多糖的影响
碳源不仅可以为微生物的生长提供重要的碳素来源和能量来源,而且不同的碳源对微生物EPS的产量影响很大[20]。5种碳源对菌株Y-20产EPS的影响如图4所示。
由图4可知,当麦芽糖作为碳源时,菌株Y-12的胞外多糖产量最高,为221.38 mg/L,其次为葡萄糖,胞外多糖产量为217.12 mg/L,添加α-乳糖和D-果糖时,多糖的产量分别为214.04 mg/L和177.95 mg/L。
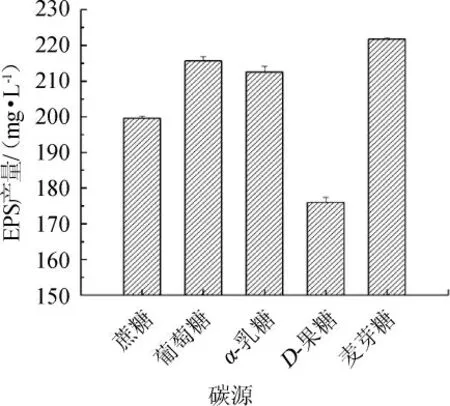
图4 不同碳源对菌株Y-20胞外多糖产量的影响Fig.4 Effect of different carbon sources on the yield of extracellular polysaccharide by strain Y-20
2.4 不同培养时间对菌株Y-20产胞外多糖的影响
菌株Y-20的生长曲线及不同时间对菌株Y-20产EPS的影响结果见图5。
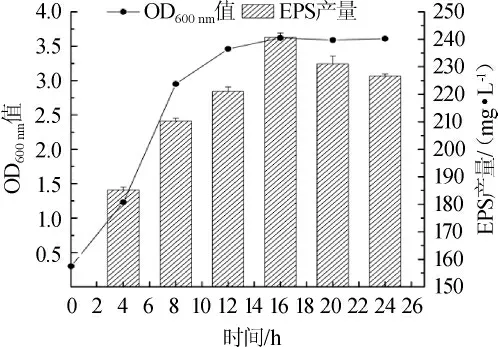
图5 菌株Y-20的生长曲线及胞外多糖产量Fig.5 Growth curve and extracellular polysaccharide yield of strain Y-20
由图5可知,菌株Y-20的延滞期较短,培养3 h以后开始进入对数生长期,逐渐产生EPS,11 h以后开始进入稳定期,稳定期较长(≥10 h),EPS含量逐渐增加并趋于稳定,培养16 h时菌体密度达到最大(3.62),EPS产量最高(242.95 mg/L)。
3 结论
本研究从自然发酵的剁辣椒中筛选出1株高产胞外多糖的乳酸菌菌株Y-20,经形态观察及生理生化鉴定和分子生物学鉴定,鉴定菌株Y-20为植物乳杆菌(Lactobacillus plantarum)。该菌产胞外多糖的最佳碳源为麦芽糖,菌株Y-20生长16 h时,菌体密度达到最大值(OD600nm值3.62),胞外多糖产量最高,为242.95 mg/L。为进一步开发利用乳酸菌菌种资源奠定一定的理论基础。
